- 772.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学中考必备识记知识点
一、测定空气中氧气体积分数的实验
1、实验现象:
(1)将红磷点燃插入集气瓶后:红磷燃烧,产生大量白烟,放出热量。
(2)打开止水夹后:水顺着导管进入集气瓶,占集气瓶体积的1/5。
2、实验结论:氧气占空气体积的1/5
3、注意事项:(1)红磷必须过量的目的:耗尽集气瓶中的氧气
(2)不能用木炭或硫代替红磷的原因:木炭或硫与氧气反应会生成气体,不能形成压强差。
4、实验误差分析:
(1)进入集气瓶中的水少于1/5的原因:①红磷不足 ②集气瓶漏气 ③集气瓶未冷却就打开止水夹
(2)进入集气瓶中的水多于1/5的原因:①燃烧匙放入的速度太慢 ②止水夹漏气
5、本实验还可得出氮气的物理性质:难溶于水; 化学性质:不能燃烧也不能支持燃烧
二、物质燃烧现象及化学方程式
名称
在空气中燃烧现象
在氧气中燃烧现象
化学反应式
磷(P)
产生白烟,放出热量
剧烈燃烧,产生大量白烟
4P+ 5O2-=== 2P2O5
硫(S)
发出微弱的淡蓝色火焰,生成一种无色有刺激性气味的气体
发出明亮的蓝紫色火焰,生成一种无色有刺激性气味的气体
S+O2===SO2
木炭(C)
发出红光,放出热量,生成无色无味气体能使澄清石灰水变浑浊
比在空气中燃烧更旺,发出白光,放出热量,生成无色无味气体能使澄清石灰水变浑浊
C+O2===CO2
铁(Fe)
不能燃烧
剧烈燃烧,火星四射,生成黑色固体
3Fe+2O2====Fe3O4
镁(Mg)
放出热量,放出耀眼的白光,生成白色粉末
2Mg+O2====2MgO
蜡烛
发出红光,放出热量,火焰上方罩一个冷而干燥的烧杯,烧杯内壁有小水珠,生成无色无味气体能使澄清石灰水变浑浊
比在空气中燃烧更旺,发出白光,放出热量,火焰上方罩一个冷而干燥的烧杯,烧杯内壁有小水珠,生成无色无味气体能使澄清石灰水变浑浊
石蜡+氧气--------
二氧化碳+水
注意事项:1、磷燃烧现象中只能说“白烟”不能说“白雾”
2、铁在氧气中燃烧,集气瓶底事先放少量水或铺一层细沙目的:防止生成的高温熔化物掉入瓶底,使瓶底炸裂
3、硫的燃烧实验,集气瓶底部放少量的水:吸收有毒的二氧化硫,防止空气污染。
三:实验室制气体知识要点整理
实验装置的选取:(固、液常温型)和(固固加热型)
(3)实验装置
(4)注意事项
①长颈漏斗下端必须插入液面以下,以免生成的气体从长颈漏斗逸出
②也可将长颈漏斗改为分液漏斗(或注射器),优点是可以控制滴加液体的速度,达到控制反应速率的目的。
③带小孔隔板:控制反应的发生和停止。
高锰酸钾加热分解
①试管口放一团棉花的目的:防止高锰酸钾颗粒进入导管。
②适宜收集氧气的时刻:导管口有连续均匀气泡冒出时。
③停止加热时先把导管移出水面,然后熄灭酒精灯的原因:防止水沿导管回流,引起灼热试管炸裂。
④检验、验证氧气的方法:将带火星的小木条伸入集气瓶内,看小木条是否复燃。
⑤试管内的导管不宜伸入过长,不利于气体排出。
1、 用排空气法收集气体时,不管是用向上排空气法还是用向下排空气法,导管必须插入集气瓶底部。
2、 用向上排空气法收集氧气验满的方法:将带火星的小木条伸入集气瓶口,看小木条是否复燃。
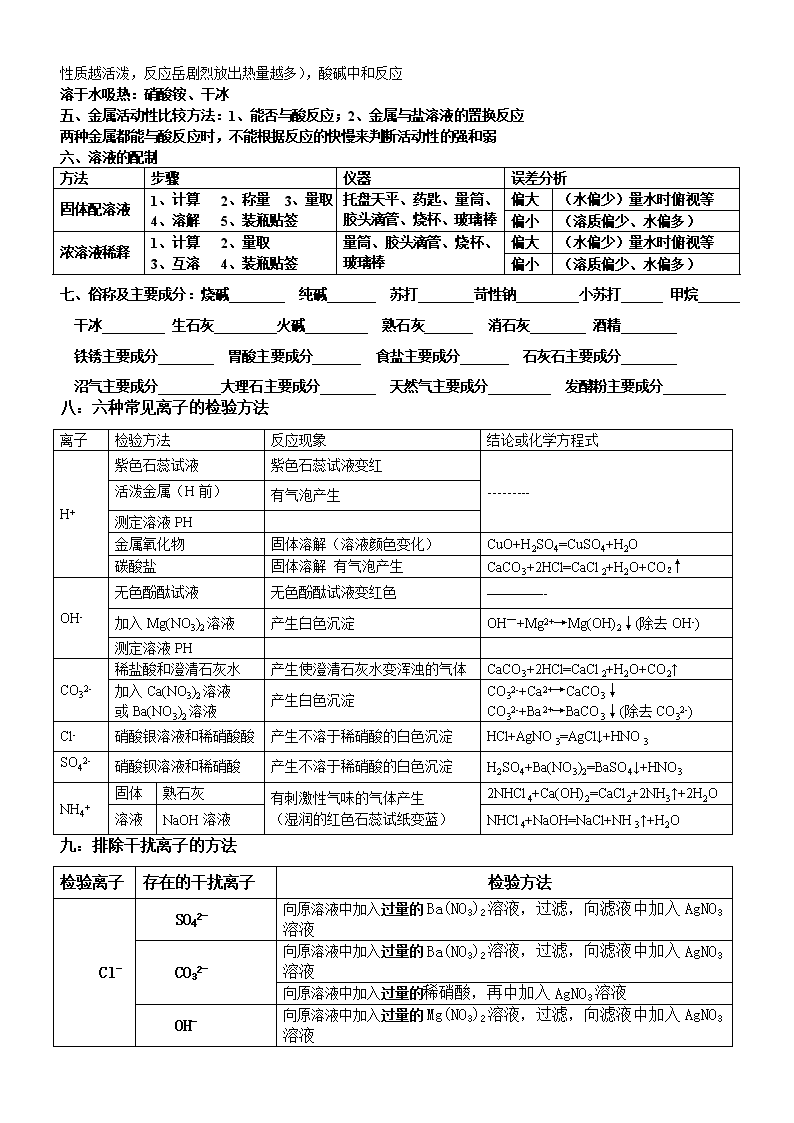
四、溶于水(与水发生反应)放热的有:生石灰 、
氢氧化钠固体、浓硫酸稀释、活泼金属与酸反应(金属化学性质越活泼,反应岳剧烈放出热量越多),酸碱中和反应
溶于水吸热:硝酸铵、干冰
五、金属活动性比较方法:1、能否与酸反应;2、金属与盐溶液的置换反应
两种金属都能与酸反应时,不能根据反应的快慢来判断活动性的强和弱
六、溶液的配制
方法
步骤
仪器
误差分析
固体配溶液
1、计算 2、称量 3、量取
4、溶解 5、装瓶贴签
托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒
偏大
(水偏少)量水时俯视等
偏小
(溶质偏少、水偏多)
浓溶液稀释
1、计算 2、量取
3、互溶 4、装瓶贴签
量筒、胶头滴管、烧杯、玻璃棒
偏大
(水偏少)量水时俯视等
偏小
(溶质偏少、水偏多)
七、俗称及主要成分:烧碱________ 纯碱_______ 苏打________苛性钠_________小苏打______ 甲烷______
干冰_________ 生石灰_________火碱_________ 熟石灰_______ 消石灰________ 酒精________
铁锈主要成分________ 胃酸主要成分_______ 食盐主要成分_______ 石灰石主要成分________
沼气主要成分_________大理石主要成分________ 天然气主要成分_________ 发酵粉主要成分_________
八:六种常见离子的检验方法
离子
检验方法
反应现象
结论或化学方程式
H+
紫色石蕊试液
紫色石蕊试液变红
---------
活泼金属(H前)
有气泡产生
测定溶液PH
金属氧化物
固体溶解(溶液颜色变化)
CuO+H2SO4=CuSO4+H2O
碳酸盐
固体溶解 有气泡产生
CaCO3+2HCl=CaCl2+H2O+CO2↑
OH-
无色酚酞试液
无色酚酞试液变红色
————-
加入Mg(NO3)2溶液
产生白色沉淀
OH—+Mg2+→Mg(OH)2↓(除去OH-)
测定溶液PH
CO32-
稀盐酸和澄清石灰水
产生使澄清石灰水变浑浊的气体
CaCO3+2HCl=CaCl2+H2O+CO2↑
加入Ca(NO3)2溶液
或Ba(NO3)2溶液
产生白色沉淀
CO32-+Ca2+→CaCO3↓
CO32-+Ba2+→BaCO3↓(除去CO32-)
Cl-
硝酸银溶液和稀硝酸酸
产生不溶于稀硝酸的白色沉淀
HCl+AgNO3=AgCl↓+HNO3
SO42-—
硝酸钡溶液和稀硝酸
产生不溶于稀硝酸的白色沉淀
H2SO4+Ba(NO3)2=BaSO4↓+HNO3
NH4+
固体
熟石灰
有刺激性气味的气体产生
(湿润的红色石蕊试纸变蓝)
2NHCl4+Ca(OH)2=CaCl2+2NH3↑+2H2O
溶液
NaOH溶液
NHCl4+NaOH=NaCl+NH3↑+H2O
九:排除干扰离子的方法
检验离子
存在的干扰离子
检验方法
Cl-
SO42-
向原溶液中加入过量的Ba(NO3)2溶液,过滤,向滤液中加入AgNO3溶液
CO32-
向原溶液中加入过量的Ba(NO3)2溶液,过滤,向滤液中加入AgNO3溶液
向原溶液中加入过量的稀硝酸,再中加入AgNO3溶液
OH-
向原溶液中加入过量的Mg(NO3)2溶液,过滤,向滤液中加入AgNO3溶液
向原溶液中加入过量的稀硝酸,再中加入AgNO3溶液
SO42- 和CO32-
向原溶液中加入过量的Ba(NO3)2溶液,过滤,向滤液中加入AgNO3溶液
向原溶液中加入过量的稀硝酸和Ba(NO3)2溶液,过滤,向滤液中加入AgNO3溶液
SO42- 和 OH-
向原溶液中加入过量的Ba(NO3)2溶液,和过量的稀硝酸,过滤,向滤液中加入AgNO3溶液
CO32-和OH-
向原溶液中加入过量的稀硝酸,再中加入AgNO3溶液
SO42- 和CO32- OH-
向原溶液中加入过量的稀硝酸和Ba(NO3)2溶液,过滤,向滤液中加入AgNO3溶液
OH-
CO32-
向原溶液中加入过量的Ba(NO3)2溶液,过滤,向滤液中加入酚酞
注意:1、只能将溶液加入另一种溶液中,不能将固体加入溶液中;
2、加入试剂时,一定要说明向XX溶液中加“XX试剂的溶液”;
3、除去有干扰的离子,所用试剂必须要过量 ;检验某离子是否存在,试剂不需要过量
十、化学方程式