- 93.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
实验内容
化学方程式
实验现象
1
拉瓦锡探究空气成分实验
2Hg+O2 =△= 2HgO
液态金属汞变成红色粉末
2
用燃烧法测定空气中O2含量
4P+5O2 =点燃=2P2O5
生成大量白烟,放热
3
物质在氧气中燃烧
(1)
硫磺
S+O2 =点燃= SO2
发出蓝紫色火焰,生成有刺激性气味的气体,放热
(2)
木炭
C+O2 =点燃= CO2
发出白光,生成气体能使澄清石灰水变浑浊,放热
(3)
红磷
4P+5O2 =点燃=2P2O5
发出白光,产生大量白烟,放热
(4)
铝箔
4Al+3O2 =点燃= 2Al2O3
剧烈燃烧,发出耀眼白光,生成白色固体,放热
(5)
铁丝
3Fe+2O2 =点燃= Fe3O4
剧烈燃烧,火星四射,生成黑色固体,放热
(6)
镁条
2Mg+O2 =点燃=2MgO
剧烈燃烧,发出耀眼白光,生成白色固体,放热
(7)
铜丝
2Cu+O2 =点燃=2CuO
铜丝表面生成黑色固体,放热
(8)
蜡烛
石蜡+氧气→水+二氧化碳
干冷的玻璃片上有水雾出现,生成能使澄清石灰水变浑浊的气体,放热
【PS: 物质在氧气中燃烧比在空气中更加剧烈】
4
三大气体的制备
(1) 制备氧气(O2)
a
分解过氧化氢
2H2O2 =MnO2= 2H2O+O2↑
实验室制氧气
b
加热高锰酸钾
2KMnO4 =△= K2MnO4+MnO2+O2↑
c
加热氯酸钾和二氧化锰混合物
2KClO3 = MnO2= 2KCl+3O2↑
d
分离液态空气
工业制氧气
(2)制备二氧化碳(CO2)
a
稀盐酸与大理石(主要成分碳酸钙)
CaCO3+2HCl == CaCl2+H2O+CO2↑
实验室制CO2
b
高温煅烧石灰石
CaCO3 =高温= CaO+CO2↑
工业制CO2
(3) 制备氢气(H2)
a
锌和稀盐酸
Zn+2HCl == ZnCl2+ H2↑
实验室制H2【PS: 稀盐酸加热易挥发出HCl气体,使制得的氢气不纯,最好用稀硫酸】
b
锌和稀硫酸
Zn+H2SO4 == ZnSO4 + H2↑
5
水的电解实验
2H2O=通电= 2H2↑+O2↑
【PS: 正氧负氢,VH2:VO2=2:1,m H2:m O2=1:8】
6
氢气( H2)的化学性质
(1)氢气的可燃性
2H2+O2 =点燃= 2H2O
纯净的氢气在空气中安静的燃烧,发出淡蓝色火焰,放热
(2)氢气的还原性
H2+CuO =△= Cu+H2O
黑色粉末变红,试管口有水生成
7
碳单质(C)的化学性质
(1)常温下,稳定性
用碳素笔记录重要文件,用墨书写字画能长久保存
点燃或
高温
(2)可燃性
C+O2 =点燃= CO2 (O2充足)
2C+O2 =点燃= 2CO(O2不足)
(3)还原性
C+2CuO =高温= 2Cu+ CO2↑
C+CO2 =高温= 2CO
8
二氧化碳(CO2)的化学性质
(1) 不燃烧,也不支持燃烧【可用于灭火】;不供给呼吸;
(2) 与水反应
CO2+H2O == H2CO3 【碳酸不稳定 H2CO3 == CO2↑+H2O】
(3) 与石灰水反应
CO2+Ca(OH)2==CaCO3↓+H2O
澄清石灰水变浑浊【此反应用于检验 CO2;解释用石灰浆抹墙原理】
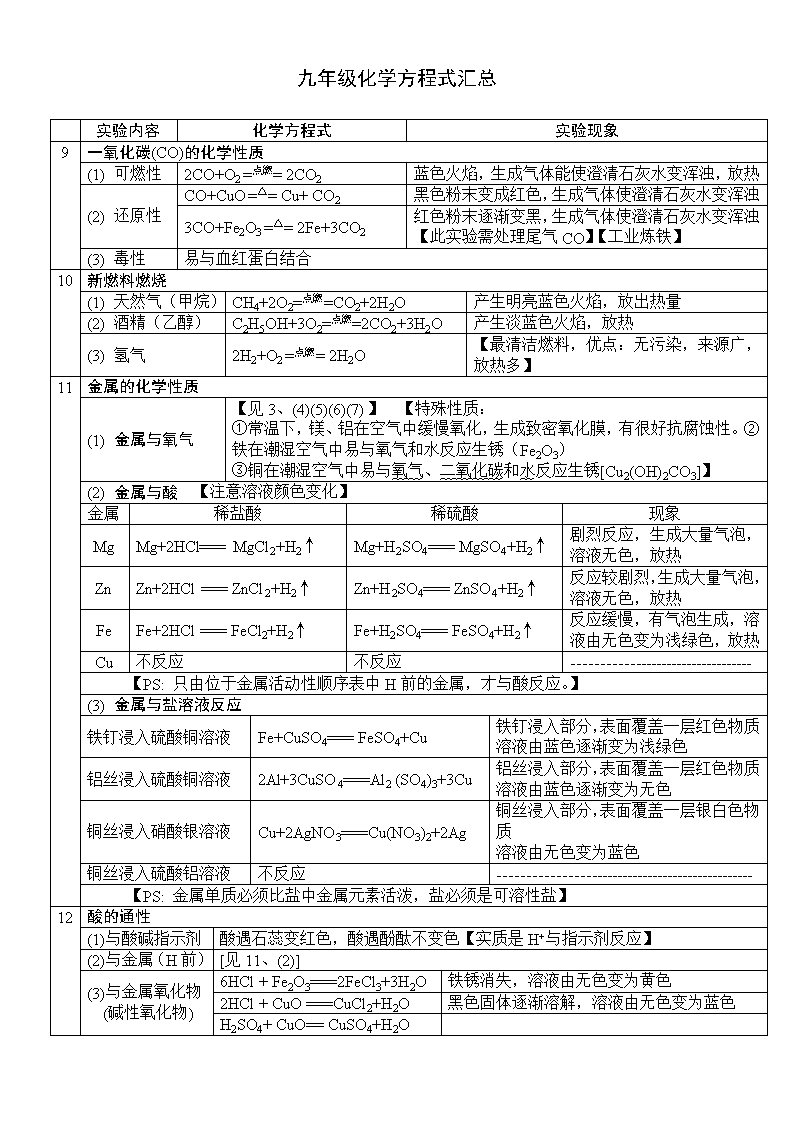
九年级化学方程式汇总
九年级化学方程式汇总
实验内容
化学方程式
实验现象
9
一氧化碳(CO)的化学性质
(1) 可燃性
2CO+O2 =点燃= 2CO2
蓝色火焰,生成气体能使澄清石灰水变浑浊,放热
(2) 还原性
CO+CuO =△= Cu+ CO2
黑色粉末变成红色,生成气体使澄清石灰水变浑浊
3CO+Fe2O3 =△= 2Fe+3CO2
红色粉末逐渐变黑,生成气体使澄清石灰水变浑浊
【此实验需处理尾气CO】【工业炼铁】
(3) 毒性
易与血红蛋白结合
10
新燃料燃烧
(1) 天然气(甲烷)
CH4+2O2=点燃=CO2+2H2O
产生明亮蓝色火焰,放出热量
(2) 酒精(乙醇)
C2H5OH+3O2=点燃=2CO2+3H2O
产生淡蓝色火焰,放热
(3) 氢气
2H2+O2 =点燃= 2H2O
【最清洁燃料,优点:无污染,来源广,放热多】
11
金属的化学性质
(1) 金属与氧气
【见3、(4)(5)(6)(7)】 【特殊性质:
①常温下,镁、铝在空气中缓慢氧化,生成致密氧化膜,有很好抗腐蚀性。②铁在潮湿空气中易与氧气和水反应生锈(Fe2O3)
③铜在潮湿空气中易与氧气、二氧化碳和水反应生锈[Cu2(OH)2CO3]】
(2) 金属与酸 【注意溶液颜色变化】
金属
稀盐酸
稀硫酸
现象
Mg
Mg+2HCl=== MgCl2+H2↑
Mg+H2SO4=== MgSO4+H2↑
剧烈反应,生成大量气泡,溶液无色,放热
Zn
Zn+2HCl === ZnCl2+H2↑
Zn+H2SO4=== ZnSO4+H2↑
反应较剧烈,生成大量气泡,溶液无色,放热
Fe
Fe+2HCl === FeCl2+H2↑
Fe+H2SO4=== FeSO4+H2↑
反应缓慢,有气泡生成,溶液由无色变为浅绿色,放热
Cu
不反应
不反应
----------------------------------
【PS: 只由位于金属活动性顺序表中H前的金属,才与酸反应。】
(3) 金属与盐溶液反应
铁钉浸入硫酸铜溶液
Fe+CuSO4=== FeSO4+Cu
铁钉浸入部分,表面覆盖一层红色物质
溶液由蓝色逐渐变为浅绿色
铝丝浸入硫酸铜溶液
2Al+3CuSO4===Al2 (SO4)3+3Cu
铝丝浸入部分,表面覆盖一层红色物质
溶液由蓝色逐渐变为无色
铜丝浸入硝酸银溶液
Cu+2AgNO3===Cu(NO3)2+2Ag
铜丝浸入部分,表面覆盖一层银白色物质
溶液由无色变为蓝色
铜丝浸入硫酸铝溶液
不反应
------------------------------------------------
【PS: 金属单质必须比盐中金属元素活泼,盐必须是可溶性盐】
12
酸的通性
(1)与酸碱指示剂
酸遇石蕊变红色,酸遇酚酞不变色【实质是H+与指示剂反应】
(2)与金属(H前)
[见11、(2)]
(3)与金属氧化物
(碱性氧化物)
6HCl + Fe2O3===2FeCl3+3H2O
铁锈消失,溶液由无色变为黄色
2HCl + CuO ===CuCl2+H2O
黑色固体逐渐溶解,溶液由无色变为蓝色
H2SO4+ CuO== CuSO4+H2O
九年级化学方程式汇总
实验内容
化学方程式
实验现象
12
酸的通性
(4) 与碱
HCl + NaOH===NaCl + H2O
白色固体逐溶解
2HCl + Cu(OH)2===CuCl2+2H2O
蓝色固体逐渐溶解,溶液变蓝
Cu(OH)2+H2SO4== CuSO4+2H2O
蓝色固体逐渐溶解,溶液变蓝
(5) 与部分盐
HCl+AgNO3===AgCl↓+HNO3
生成不溶于硝酸的白色沉淀
【用AgNO3检验盐酸或可溶性盐酸盐】
2HCl+CaCO3===CaCl2+H2O+CO2↑
白色固体逐渐消失,生成气体能使澄清石灰水变浑浊【检验CO32-: ①加稀盐酸②生成气体通入澄清石灰水】
BaCl2+H2SO4===BaSO4↓+2HCl
生成不溶于硝酸的白色沉淀
【用BaCl2检验硫酸或可溶性硫酸盐】
13
碱的通性
(1) 与酸碱指示剂
碱遇石蕊变红色,碱遇酚酞变蓝色【实质是OH—与指示剂反应】
(2) 与非金属氧化物
(酸性氧化物)
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
2NaOH+SO2==Na2SO3+H2O
(3) 与碱
[见12、(4)]
(4) 与某些盐
2NaOH+ CuSO4===Cu(OH)2↓+ Na2SO4
生成蓝色絮状沉淀
3NaOH+FeCl3===Fe(OH)3↓+ 3NaCl
生成红褐色沉淀
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
生成白色沉淀
14
盐的通性
(1)金属与盐溶液
[见11、(3)]
条件:①金属单质比盐中金属活泼;②盐可溶于水
(2)酸与盐
[见12、(5)]
条件:
①反应物中盐可溶于酸(BaSO4、AgCl是不溶于硝酸的盐)
②生成物中有水或沉淀或气体【复分解反应发生的条件】
(3)碱与盐溶液
[见13、(4)]
条件:①反应物中盐、碱均可溶于水
②生成物有水或沉淀或气体
(4)盐与盐
NaCl+AgNO3===AgCl↓+NaNO3
生成不溶于硝酸的白色沉淀
Na2SO4+BaCl2===BaSO4↓+2NaCl
15
制火碱(NaOH)
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
16
制熟石灰[Ca(OH)2]
CaO+H2O=== Ca(OH)2
【生石灰可做食品干燥剂】
17
葡萄糖在酶的作用下转换,放出热量
C6H12O6+6O2酶→6CO2+6H2O
18
铵态氮肥
NH4NO3+NaOH==NaNO3+NH3↑+H2O
生成有刺激性气味的气体
NH4HCO3 =△= NH3↑+H2O+CO2↑
生成有刺激性气味的气体
19
碳酸氢钠( NaHCO3)[ 类比:Ca(HCO3)2=△= CaCO3↓+H2O+CO2↑]
NaHCO3+HCl==NaCl+H2O+CO2↑
2NaHCO3 =△= Na2CO3+H2O+CO2↑