- 225.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
人教版中考化学重点、难点、考点集锦
一.常见沉淀的颜色
白色沉淀: CaCO3 BaCO3 AgCl BaSO4 Mg(OH)2….Al(OH)3
红褐色沉淀-----Fe(OH)3 蓝色沉淀--------Cu(OH)2
二. 常见固态物质的颜色:
①红色固体:Cu(紫红色)、Fe2O3(红棕色)、 红磷(一般不考虑)
②黄色固体:S ③白色固体:KClO3 KCl CaO P2O5 NaCl Na2CO3…………..
④黑色固体:C、CuO、MnO2、Fe3O4 铁粉(均不溶于水)
⑤紫黑色固体:KMnO4
三、常见的金属、常见的金属氧化物、常见的气体、
Fe、Cu、Zn…… 、 CuO、Fe2O3、CaO---------- O2、H2、N2、CO2、CO、CH4
四. 常见有色溶液的颜色:
①含有铜离子(Cu2+)的溶液为: 蓝色 如:CuSO4溶液、CuCl2溶液
②含有铁离子(Fe3+)的溶液为: 黄色 如:FeCl3 溶液、Fe2(SO4)3溶液
③含有亚铁离子(Fe2+)的溶液为: 浅绿色 如: FeCl2 、FeSO4溶液是浅绿色的
五. 要熟记下列物质的、化学式或主要成分
1、【化学式】 【学名】 【俗名】
CaO 氧化钙 生石灰
Ca(OH)2 氢氧化钙 熟石灰、消石灰
NaCl 氯化钠 食盐
NaOH 氢氧化钠、 火碱、烧碱、苛性钠
Na2CO3 碳酸钠 纯碱、苏打、碱面(家中的)
NaHCO3 碳酸氢钠、 小苏打
Hg 汞 水银
C2H5OH 乙醇 酒精
CO2 二氧化碳、 干冰(CO2固体)
CuSO4·5H2O 五水硫酸铜 蓝矾、胆矾
2、【主要成分】:
CaCO3 碳酸钙。大理石、石灰石、水垢、蛋壳、贝壳、珍珠、钟乳石 的主要成分
CH4 甲烷 (天然气、沼气、瓦斯气的主要成分)
Fe2O3 氧化铁(三氧化二铁) 铁锈的主要成分,赤铁矿石的主要成分。
HCl 氯化氢气体(盐酸中的溶质) (钢、生铁的主要成份是铁)
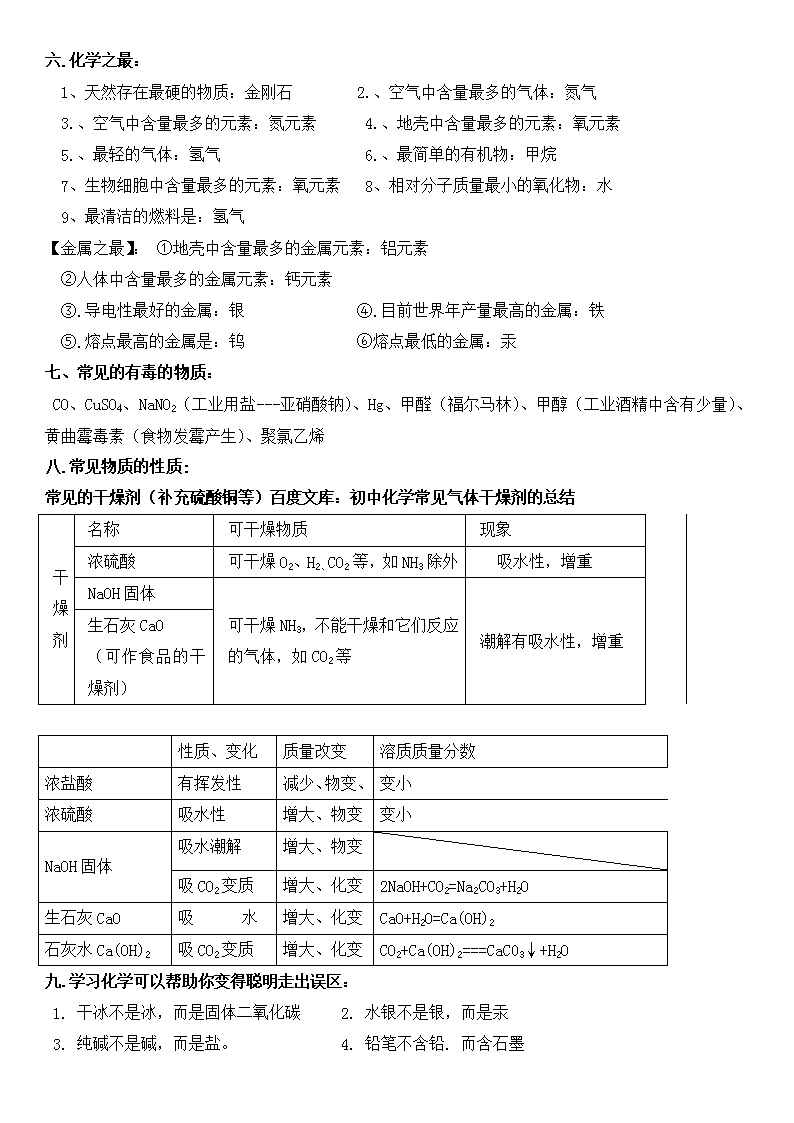
六.化学之最:
1、天然存在最硬的物质:金刚石 2.、空气中含量最多的气体:氮气
3.、空气中含量最多的元素:氮元素 4.、地壳中含量最多的元素:氧元素
5.、最轻的气体:氢气 6.、最简单的有机物:甲烷
7、生物细胞中含量最多的元素:氧元素 8、相对分子质量最小的氧化物:水
9、最清洁的燃料是:氢气
【金属之最】: ①地壳中含量最多的金属元素:铝元素
②人体中含量最多的金属元素:钙元素
③.导电性最好的金属:银 ④.目前世界年产量最高的金属:铁
⑤.熔点最高的金属是:钨 ⑥熔点最低的金属:汞
七、常见的有毒的物质:
CO、CuSO4、NaNO2(工业用盐---亚硝酸钠)、Hg、甲醛(福尔马林)、甲醇(工业酒精中含有少量)、黄曲霉毒素(食物发霉产生)、聚氯乙烯
八.常见物质的性质:
常见的干燥剂(补充硫酸铜等)百度文库:初中化学常见气体干燥剂的总结
干燥剂
名称
可干燥物质
现象
浓硫酸
可干燥O2、H2、CO2等,如NH3除外
吸水性,增重
NaOH固体
可干燥NH3,不能干燥和它们反应的气体,如CO2等
潮解有吸水性,增重
生石灰CaO
(可作食品的干燥剂)
性质、变化
质量改变
溶质质量分数
浓盐酸
有挥发性
减少、物变、
变小
浓硫酸
吸水性
增大、物变
变小
NaOH固体
吸水潮解
增大、物变
吸CO2变质
增大、化变
2NaOH+CO2=Na2CO3+H2O
生石灰CaO
吸 水
增大、化变
CaO+H2O=Ca(OH)2
石灰水Ca(OH)2
吸CO2变质
增大、化变
CO2+Ca(OH)2===CaC03↓+H2O
九.学习化学可以帮助你变得聪明走出误区:
1. 干冰不是冰,而是固体二氧化碳 2. 水银不是银,而是汞
3. 纯碱不是碱,而是盐。 4. 铅笔不含铅. 而含石墨
5. 铁锈不是铁,而是氧化铁(三氧化二铁).
6. 暖气片上的防锈“银粉”不是银,而是铝粉.
十.溶于水放热的常见三大物质
1、氧化钙和水反应放热: CaO+H2O==Ca(OH)2
2、浓硫酸溶于水放热
3、氢氧化钠溶于水放热 (溶于水吸热的是:硝酸铵----NH4NO3)
十一. 食品的保存方法:
1.真空保存法: 防止食品与氧气反应而腐烂变质.
2.充气保存法:
(1)隔绝氧气:防止食品与氧气反应而腐烂变质(物理角度:防止食品被挤压变形)
(2)常充入的气体是二氧化碳或氮气或二氧化碳和氮气,
(3)对充入的气体要求是:①不与食品反应 ②无毒无害 ③价格低廉
3.干燥剂法: 生石灰(食品的干燥剂) 4. 双吸剂(脱氧剂): 铁粉 (吸收氧气和水)
十二. 化学与社会、食品与健康:
六大营养物质: 蛋白质、糖类、油脂、维生素、水和无机盐,(前三种能提供能量)
1.维生素及微量元素在人体中的作用:(不缺不补、食补为主、药补为辅)
①缺维生素A: 会引起夜盲症. ②缺维生素C: 会引起坏血病.
③缺铁: 会引起缺铁性贫血. ④缺锌: 会引起食欲不振,生长迟缓.
⑤缺硒: 会引起表皮角质化和癌症 ⑥缺碘: 会引起甲状腺肿大.
⑦缺氟: 会引起龋齿. ⑧缺钙: 青少年易得佝偻病,老人易得骨质疏松.
2.食品与健康:
①富含蛋白质的有:鱼、肉、蛋、奶、大豆、花生
②富含油脂的有: 植物油脂:花生油、豆油、菜籽油、牛油、奶油…. 动物油脂: 脂肪
③富含糖类的有: 大米、白面、马铃薯……. ④富含维生素的有: 水果和蔬菜…..
十三:一些较特殊的反应
3CO+Fe2O32Fe + 3CO2 CO2+2NaOH===Na2CO3+H2O CaCO3CaO + CO2↑
CH4 + 2O2CO2 + 2H2O C2H5OH + 3O22CO2+ 3H2O
2KMnO4K2MnO4 + MnO2 + O2↑ 2KClO32KCl + 3O2↑
Zn + H2SO4 = ZnSO4 + H2↑ Zn + 2HCl = ZnCl2 + H2↑
CO2+Ca(OH)2====CaCO3↓+H2O CaO + H2O = Ca(OH)2
CaCO3+2HCl=CaCl2+ H2O+CO2↑ C + 2CuO2Cu + CO2↑
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O Fe2O3 + 6HCl = 2FeCl3 + 3H2O
CO2+H2O===H2CO3 CO2 + C 2CO
十四.燃烧和灭火
燃烧条件
同时具备:可燃物、与氧气(空气)接触、温度达到着火点
加快燃烧
①有充足的氧气 ②提高空气和可燃物的接触面积
灭火方法
(三选一)
①清除、移走可燃物 能举例说明
②隔绝空气或氧气 ③降低可燃物的温度至着火点以下
十五. 几种气体的实验室制法以及它们的区别:
气体
氧气(O2)
氢气(H2)
二氧化碳(CO2)
药品
①高锰酸钾(KMnO4)
②双氧水和二氧化锰
③氯酸钾 和二氧化锰
①锌粒和稀盐酸
②锌粒和稀硫酸
石灰石(大理石)
和稀盐酸
反应原理
①2KMnO4 K2MnO4+MnO2+O2↑
②2H2O22H2O+O2↑
△
③2KClO32KCl+3O2↑
Zn+H2SO4=ZnSO4+H2↑
Zn+2HCl=ZnCl2+H2↑
CaCO3+2HCl=
CaCl2+H2O+CO2↑
检验
用带火星的木条,伸进集气瓶,若木条复燃,是氧气;否则不是氧气
点燃木条,伸入瓶内,木条上的火焰熄灭,瓶口火焰呈淡蓝色,则该气体是氢气
通入澄清的石灰水,看是否变浑浊,
若浑浊则是CO2。
验满
用带火星的木条,平放在集气瓶口,若木条复燃,氧气已满,否则没满
用燃着的木条,平放在集气瓶口,若火焰熄灭,则已满;否则没满
放置
正放
倒放
正放
11、选择气体发生装置考虑:①反应物的状态 ②反应的条件
2、收集装置的选用应考虑:①密度和空气比较 ②该气体的溶解性
3、排空气法收集气体时,导气管应伸到集气瓶的底部
4、制氧气的注意事项:高锰酸钾制氧气时,试管口应略向下倾斜并放一小团棉花,
5、制二氧化碳的注意事项: ①应用大理石或石灰石,不能用碳酸钠,因为碳酸钠和盐酸反应速率太快,不容易控制。 ②不能用浓盐酸:因为有挥发性,挥发出氯化氢气体使制得的二氧化碳不纯。
③不能用硫酸:因为硫酸与大理石反应会生成硫酸钙附着在大理石表面阻碍反应进行。(若一定要用稀硫酸,可将大理石粉碎)④不能用排水集气法收集(CO2溶于水)
装
置
图
A
B长进短出
C
D
E
注意
事项
u试管口略向下倾斜(防止水倒流试管破裂)
v先预热后集中加热
w排水法时先取出导管后停止加热(防止水倒流试管破裂)
u先装固体药品后加液体药品
v长颈漏斗下端管口应伸入液体中,防止气体逃出
w导管露出橡皮塞即可,防止空气不能排净,收集的气体不纯
比较:
A的优点:分液漏斗可方便添加液体、控制反应速率;
B的优点:可方便加入液体;
C的优点:装置简单
D的优点:注射器可准确控制液体加入量、还可控制反应速率;
E可通过根据需要让反应随时进行和停止。
方法
排水法
(用于收集难溶于水或不易溶于水气体、和水不反应的气体)
向上排空气法
(用于收集密度大于空气的气体)
向下排空气法
(收集密度小于空气的气体)
装置图
(集气瓶应垂直)
量多
量少
导管伸到集气瓶口内
导管伸到集气瓶底
注意
事项
u收集的气体较纯
v瓶口有气泡向外冒出时集满
u收集的气体比排水法不纯(含少量空气)
v在瓶口处验满
物质
无机物
混合物
氧化物
酸
碱
盐
金属氧化物
非金属氧化物
金属单质
非金属单质
稀有气体单质
有机物
纯净物
单质
化合物
十六.物质的分类
※有机物:含碳的化合物叫做有机物。
如:甲烷、酒精、葡萄糖等。(除CO、CO2、含CO3的)
有机小分子:CH4、C2H5OH 、C6H12O6等
有机高分子:蛋白质、淀粉等
有机物
天然:羊毛、棉花、蚕丝、天然橡胶等
有机高分子材料 热固性: 电视机的外壳、电木插座、炒菜锅的手柄等
塑料
合成 热塑性:聚乙烯、聚氯乙烯等
合成纤维:涤纶、锦纶、氨纶等
合成橡胶:如:轮胎
◆天然纤维和合成纤维的区分:用点燃的方法
羊毛:点燃后有烧焦羽毛的气味 棉花:有烧纸的气味
合成纤维:燃烧后的灰烬呈黑色小球
十七.物质的构成
1、物质、元素、分子、原子之间的关系
构成
分子
元素
组成
物质
原子
离子
构成
得失电子
构成
构成
2、分子和原子的对比
分子
原子
相同点
分子可以构成物质
原子也可以构成物质
分子总是不断地运动
原子总是不断地运动
分子间有一定的间隔
原子间有一定的间隔
分子质量小、体积小
原子质量小、体积小
分子可以保持物质的化学性质
原子也可以保持物质的化学性质
分子是由原子构成的
原子可以构成分子
不同
在化学反应中,分子可分成原子,而原子不可分,只是重新组成新的分子
十八:酸、碱、金属的化学性质
酸的化学性质
碱的化学性质
金属的化学性质
与指示剂反应
与指示剂反应
与氧气反应
与氢前金属反应
与非金属氧化物反应
与酸反应
与金属氧化物反应
与酸反应
与金属的盐溶液反应
与碱反应
与某些盐反应
与某些盐反应
十九、.酸碱度的标示法:
酸碱度的表示方法——pH值
酸性(H+)
中性
碱性(OH-)
石蕊溶液
红色
紫色
蓝色
酚酞溶液
无色
无色
红色
pH值
说明
(1)pH值=7,溶液呈中性, 一般为水或大部分的盐溶液.
(2)pH值<7,溶液呈酸性, pH值越小,酸性越强,但呈酸性的不一定是酸溶液, 也许是某些盐溶液.
(3)pH值>7,溶液呈碱性, pH值越大,碱性越强,但呈碱性的不一定是碱溶液, 也许是某些盐溶液. 如:Na2CO3属于盐, 但其溶液呈碱性.
二十、金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性有强逐渐变弱
1、 在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2、 在金属活动性顺序里,只有排在氢前面的金属才能置换出盐酸、稀硫酸中的氢
3、 在金属活动性顺序里,位于前面的金属能将后面的金属从它的化合物(溶于水)溶液中置换出来(前面的金属不能用K、Ca、Na)
二十一、常见物质的性质和用途
1、氧气的主要用途:
①供给呼吸----------如:医院急救病人、登山、航空等。
②支持燃烧----------燃料燃烧离不开氧气,如:富氧炼钢、气焊、宇宙航行。
2、二氧化碳的主要用途:
①用来灭火------------因为在一般情况下,既不燃烧也不支持燃烧,而且密度比空气大
(如果是液态二氧化碳灭火器还有降温的作用)
②用来制汽水--------------因为二氧化碳能溶于水,(压强越大,溶解度越大)
③干冰作制冷剂、人工降雨、制造舞台云雾----因为干冰升华吸热,使周围温度降低。
④可用来保存食品(充气法)---二氧化碳隔绝空气,细菌无法繁殖,食品不容易腐烂。
⑤作温室肥料-------增强植物的光合作用。
3、氢氧化钙的用途:
①腐蚀性-----------a、野外可处理伤口;b、冬天在树干涂一层石灰浆(防虫害杀菌保暖)
②与二氧化碳、二氧化硫反应----------a检验或除去二氧化碳气体;b保存鲜鸡蛋;c建筑材料;
d吸收工业废气中的二氧化硫气体
③与酸的反应-----------a、改良酸性土壤; b、处理工业或生活废酸水
④与碳酸钠反应--------a制少量的氢氧化钠; b制松花蛋的原料; c检验氢氧化钠是否变质或除去氢氧化钠中的杂质碳酸钠
高温
4、一氧化碳的主要用途:
①可作燃料; ②工业上利用一氧化碳来冶炼金属。(3CO+Fe2O3===2Fe+3CO2)
5、酸酸氢钠的主要用途: ①治疗胃酸过多; ②作发酵粉(制蛋糕、蒸馒头) ③干粉灭火器
6、稀盐酸的用途:除铁锈、除水垢、实验室制氢气、实验室制取二氧化碳、人胃中有盐酸帮助消化
7、稀硫酸的用途:除铁锈、实验室制取氢气。
二十二、其它
1、三大有机合成材料:合成橡胶、合成纤维、塑料
2、当今世界上最重要的三大化石燃料是:煤、石油、天然气。(都是混合物)
3、氢气作为燃料有三大优点:资源丰富、发热量高、燃烧后的产物是水不污染环境。
4、可以直接加热的三种仪器:试管、蒸发皿、燃烧匙
5、构成物质的三种粒子:分子、原子、离子
6、溶液的特征有三个:(1)均一性;(2)稳定性;(3)混合物。
7、具有还原性的三大物质:C CO H2
8、污染空气的三大有害气体:NO2 、 SO2 、CO
9、溶解度曲线有三个类型:陡升型(硝酸钾)、缓升型(氯化钠)、下降性(氢氧化钙)
10、粗盐提纯的步骤主要有三个:
①溶解(玻璃棒的作用:搅拌,加快溶解) ②过滤(玻璃棒的作用:引流)
③蒸发(玻璃棒的作用:搅拌,使液体受热均匀防止飞溅)
11、溶液的配制的主要三个步骤:
(1)固体配制溶液(以配制50克5%的氯化钠溶液为例)---------- 计算、称量(量取)、溶解
(2)浓溶液配制稀溶液(如:浓盐酸配成稀盐酸)----------------- -------计算、量取、溶解
12、造成水污染的主要三个方面:
①工业“三废”---废渣废水废气任意排放 ②农业的农药化肥任意施放 ③生活污水任意排放
13、人吸入的气体和呼出的气体主要有三点不同:
①人呼出的气体中二氧化碳多了 ②人呼出的气体中水蒸气多了 ③人呼出的气体中氧气少了
14、纯金属与合金的对比(主要有三点不同):
①变成合金之后硬度大 ②变成合金之后熔点低了 ③变成合金之后强度、抗腐蚀性能更好了
15、反应前后六不变:原子的种类没有变、原子的质量没有变、原子的数目没有变,
元素的种类没有变、元素的质量没有变、质量总和没有变
16、六大营养物质:糖类、蛋白质、油脂、维生素、无机盐、水。其中前四位是有机物,
17、白色污染:不可降解的塑料的随意弃置
18、有待开发的新能源:核能,太阳能,风能,地热能,潮汐能等
19、实验室最常用的溶剂:是水。 另外酒精、汽油也可作溶剂,酒精能溶解碘、汽油能溶解油脂。
20、特别的混合物:溶液,合金,矿石,空气,煤、石油、天然气、水煤气、钢、生铁都是混合物
21、洗洁精、洗涤灵、洗手液、肥皂、香皂、洗发膏、沐浴液等清除油污用了乳化的原理。
22、含有较多钙、镁化合物的水是硬水。含较少钙、镁化合物的水是软水
①区别硬水与软水用肥皂水。②硬水转化为软水的方法:生活中----煮沸,实验室中-----蒸馏
23、电解水的实验现象:“负氢正氧,氢二氧一”(氢气与氧气的体积比为2﹕1)
24、气体的溶解度随压强的减小而减小,随温度的升高而减小。
二十三、课本中的一些逻辑推理
① 化学变化中一定有物理变化,但物理变化中不一定有化学变化。
② ②分子由原子构成,但分子不一定比原子大。
③氧气能支持燃烧,但燃烧不一定都需要氧气。④燃烧不一定需要点燃,燃烧不一定有火焰。
⑤燃烧一定发光、放热,但发光、放热的不一定是燃烧。
⑥中和反应一定生成盐和水,但生成盐和水的不一定是中和反应。⑦碱溶液一定呈碱性,但呈碱性的不一定是碱溶液。
⑧酸溶液一定呈酸性,但呈酸性的不一定是酸溶液。
⑨原子核由质子和中子构成,但原子中不一定都含中子。
⑩溶液是均一稳定的,但均一稳定的液体不一定是溶液。
⑾单质中含有一种元素,但含有一种元素的不一定是单质。
⑿酸中一定含氢元素,碱中一定含氢、氧元素,盐中不一定有氢、氧元素。
⒀有机物中一定含碳元素,但含碳元素的不一定是有机物⒁氧化反应不一定是化合反应,化合反应不一定是氧化反应。
⒂氧化物一定含氧元素,但含氧元素的不一定是氧化物。
⒃最外层电子数为8的粒子不一定是稀有气体的原子。
⒄有金属离子和酸根离子的化合物是盐,但盐不一定含金属离子,如:铵盐。
⒅置换反应一定有单质和化合物生成,但有单质和化合物生成的反应不一定是置换反应。
⒆复分解反应的生成物和反应物都是化合物,但反应物、生成物都是化合物的不一定是复分解反应。
⒇同种元素质子数一定相同,但质子数相同的粒子不一定是同种元素。
二十四、碳和碳的化合物之间的关系