- 2.01 MB
- 2021-05-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017北京各区中考化学二模生产实际分析汇编
西城区
〖生产实际分析〗
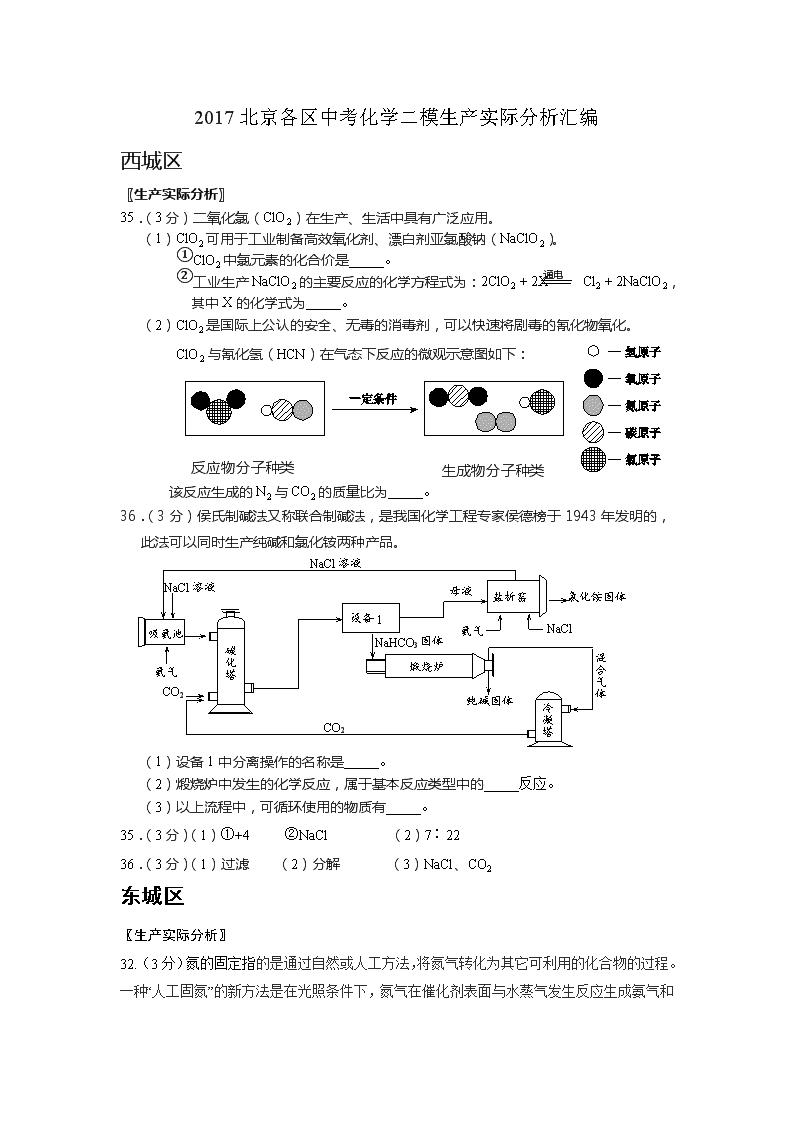
35.(3分)二氧化氯(ClO2)在生产、生活中具有广泛应用。
(1)ClO2可用于工业制备高效氧化剂、漂白剂亚氯酸钠(NaClO2)。
通电
①ClO2中氯元素的化合价是_____。
②工业生产NaClO2的主要反应的化学方程式为:2ClO2 + 2X Cl2 + 2NaClO2,其中X的化学式为_____。
(2)ClO2是国际上公认的安全、无毒的消毒剂,可以快速将剧毒的氰化物氧化。
ClO2与氰化氢(HCN)在气态下反应的微观示意图如下:
反应物分子种类
生成物分子种类
该反应生成的N2与CO2的质量比为_____。
CO2
NaHCO3固体
NaCl
氯化铵固体
设备1
碳
化
塔
煅烧炉
冷
凝
塔
氨气
纯碱固体
混
合
气
体
盐析窑
CO2
NaCl溶液
NaCl溶液
母液
氨气
吸氨池
36.(3分)侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的,此法可以同时生产纯碱和氯化铵两种产品。
(1)设备1中分离操作的名称是_____。
(2)煅烧炉中发生的化学反应,属于基本反应类型中的_____反应。
(3)以上流程中,可循环使用的物质有_____。
35.(3分)(1)①+4 ②NaCl (2)7∶22
36.(3分)(1)过滤 (2)分解 (3)NaCl、CO2
东城区
〖生产实际分析〗
32.(3分)氮的固定指的是通过自然或人工方法,将氮气转化为其它可利用的化合物的过程。一种“人工固氮”的新方法是在光照条件下,氮气在催化剂表面与水蒸气发生反应生成氨气
和氧气,该反应的微观示意图如下。
(1)依据反应的微观示意图写出化学方程式 ,反应的基本类型是 。
(2)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
则加入的X 应为 (填字母序号)。
A.H2SO4 B.CaSO4 C.SO2
33.(4分)金属锰可以增强合金材料的硬度、耐磨性等。工业上通常用菱锰矿(主要成分为MnCO3)冶炼金属锰。其工艺流程如下:
(1)浸出是将菱锰矿与稀硫酸混合制得硫酸锰(MnSO4),反应的化学方程式是_______。
(2)除去浸出液中的Fe2+,获得金属锰。这个过程中发生的主要反应有(其中NH3·H2O中各元素的化合价与NH3、H2O中各元素化合价相等):
I.2FeSO4 +MnO2 + 2H2SO4 = MnSO4+ Fe2(SO4) 3 + 2H2O
II.Fe2(SO4)3 + 6NH3·H2O = 2Fe(OH)3↓ + 3(NH4)2SO4
通电
III.2MnSO4 + 2H2O 2Mn + 2H2SO4 + O2↑
上述三个反应中,反应前后有化合价变化的元素有________。
(3)浸出过程中产生的气体可以用氨水吸收得到化肥碳酸氢铵,碳酸氢铵属于 肥。
(4)现代化工生产必须考虑节能减排,在上述生产①~⑤过程中,符合“减排”做法的是______。
32.(3分)(1)2N2+ 6H2O 4NH3 + 3O2 置换反应 (2)B
33.(4分)(1)MnCO3 + H2SO4 = MnSO4+ H2O + CO2↑ (2)Mn、Fe、O
(3)氮 (4)④⑤
海淀区
〖生产实际分析〗
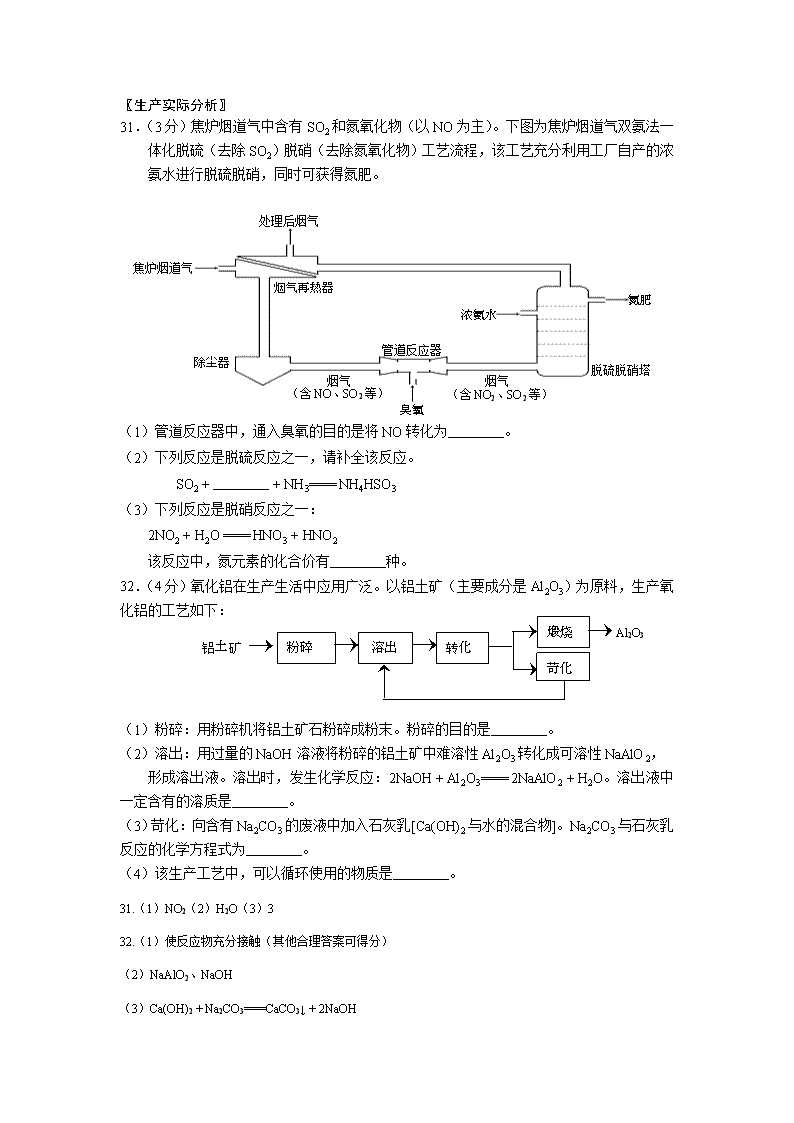
31.(3分)焦炉烟道气中含有SO2和氮氧化物(以NO为主)。下图为焦炉烟道气双氨法一
体化脱硫(去除SO2)脱硝(去除氮氧化物)工艺流程,该工艺充分利用工厂自产的浓
氨水进行脱硫脱硝,同时可获得氮肥。
烟气再热器
氮肥
除尘器
臭氧
管道反应器
焦炉烟道气
处理后烟气
(含NO、SO2等)
浓氨水
(含NO2、SO2等)
烟气
脱硫脱硝塔
烟气
烟气
烟气
(1)管道反应器中,通入臭氧的目的是将NO转化为________。
(2)下列反应是脱硫反应之一,请补全该反应。
SO2 + ________ + NH3==== NH4HSO3
(3)下列反应是脱硝反应之一:
2NO2 + H2O ==== HNO3 + HNO2
该反应中,氮元素的化合价有________种。
32.(4分)氧化铝在生产生活中应用广泛。以铝土矿(主要成分是Al2O3)为原料,生产氧
铝土矿
粉碎
溶出
煅烧
Al2O3
转化
苛化
化铝的工艺如下:
(1)粉碎:用粉碎机将铝土矿石粉碎成粉末。粉碎的目的是________。
(2)溶出:用过量的NaOH溶液将粉碎的铝土矿中难溶性Al2O3转化成可溶性NaAlO2,
形成溶出液。溶出时,发生化学反应:2NaOH + Al2O3==== 2NaAlO2 + H2O。溶出液中一定含有的溶质是________。
(3)苛化:向含有Na2CO3的废液中加入石灰乳[Ca(OH)2与水的混合物]。Na2CO3与石灰乳反应的化学方程式为________。
(4)该生产工艺中,可以循环使用的物质是________。
31.(1)NO2(2)H2O(3)3
32.(1)使反应物充分接触(其他合理答案可得分)
(2)NaAlO2、NaOH
(3)Ca(OH)2 + Na2CO3====CaCO3↓ + 2NaOH
(4)NaOH
朝阳区
〖生产实际分析〗
32.(3分)二氧化氯(ClO2)在生产、生活中具有广泛应用。
(1)ClO2可用于工业制备高效氧化剂、漂白剂亚氯酸钠(NaClO2)。
①ClO2中氯元素的化合价为__________。
② 工业生产NaClO2的主要反应的化学方程式为2ClO2 + 2X 通电 Cl2 + 2NaClO2,其中X的化学式为_________________________________。
(2) ClO2是国际上公认的安全、无毒的消毒剂,可以快速将剧毒的氰化物氧化。ClO2与氰化氢(HCN)在气态下反应的微观示意图如下:
该反应生成的N2与CO2的质量比为________________。
33.(4分)下图为工业制备硝酸的生产过程示意图。
(1)步骤①中发生反应的化学方程式为______________________。
(2)从微观角度解释NO和NO2化学性质不同的原因_____________________________。
(3)步骤③中发生反应的化学方程式为_____________________________________。
(4)制取硝酸过程中可循环使用的物质是________________________________________。
〖生产实际分析〗
32.(3分)
(1)①+4②NaCl (2)7:22
33.(4分)
(1)2H2O通电2H2↑+O2↑(2)构成物质的分子不同
(3)3H2+N2高温高压催化剂2NH3(4)NO
丰台区
【生产实际分析】
32.(3分)二氧化氯(ClO2)在生产、生活中具有广泛应用。
(1)ClO2可用于工业制备高效氧化剂、漂白剂亚氯酸钠(NaClO2)。
①ClO2中氯元素的化合价为 。
②工业生产NaClO2的主要反应的化学方程式为2ClO2 + 2X 通电 Cl2 + 2NaClO2,其中X的化学式为 。
(3) ClO2是国际上公认的安全、无毒的消毒剂,可以快速将剧毒的氰化物氧化。ClO2与氰化氢(HCN)在气态下反应的微观示意图如下:
该反应生成的N2与CO2的质量比为 。
33.(3分)钛(Ti)被称为继铁、铝之后的第三金属。
如下图所示,将钛厂、氯碱厂和甲醇(CH4O)厂组成产业链可以大大提高资源利用率,减少环境污染。
(1)电解食盐水反应的化学方程式为 。
(2)由四氯化钛和镁制取钛的反应,基本反应类型为 。该过程中,氩气的作用是 。
【生产实际分析】
32.(1)①+4 ②NaCl通电
(2)7:22
33.(1) 2H2O+2NaCl===2 NaOH+H2↑+Cl2↑
(2)置换 隔绝空气,防止镁与空气中的成分(O2、N2)反应
石景山区
〖生产实际分析〗
34.(3分)二氧化氯(ClO2)在生产、生活中具有广泛应用。
(1)ClO2可用于工业制备高效氧化剂、漂白剂亚氯酸钠(NaClO2)。
① ClO2中氯元素的化合价为 。
② 工业生产NaClO2的主要反应的化学方程式为2ClO2+2X 通电 Cl2+2NaClO2,其中X的化学式为 。
(2)ClO2是国际上公认的安全、无毒的消毒剂,可以快速将剧毒的氰化物氧化。ClO2 与氰化氢(HCN)在气态下反应的微观示意图如下:
该反应生成的N2与CO2的质量比为 。
35.(3分)某烟气脱硫的工艺不仅能消除SO2,还能将其转化为石膏(CaSO4·2H2O
)等产品,实现“变废为宝”。主要物质转化关系如下:
(1)设备1中加入原料水的目的是 。
(2)设备2中发生了复分解反应,反应的化学方程式为 。
(3)CaSO4中的氧元素来自原料 和水。
34.(3分)
(1)① +4 ② NaCl (2)7:22
35.(3分)
(1)作为反应物,脱去烟气中的SO2
(2)CaCO3 + H2SO3 === CaSO3 + H2O + CO2↑ (3)二氧化硫、氧气
顺义区
【生产实际分析】
31.(3分)二氧化氯(ClO2)在生产、生活中具有广泛应用。
(1)ClO2可用于工业制备高效氧化剂、漂白剂亚氯酸钠(NaClO2)。
① ClO2中氯元素的化合价为__________。
② 工业生产NaClO2的主要反应的化学方程式为2ClO2 + 2X 通电 Cl2 + 2NaClO2 ,其中X的化学式为__________。
(2) ClO2是国际上公认的安全、无毒的消毒剂,可以快速将剧毒的氰化物氧化。ClO2与氰化氢(HCN)在气态下反应的微观示意图如下:
该反应生成的N2与CO2的质量比为__________ 。
32.(3分)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
(1)20oC时,食盐的溶解度为36g,则20oC 的饱和食盐水中溶质的质量分数是__________。计算结果保留一位小数)
(2)反应II的化学方程式为__________。
(3)母液经分离后可得到一种化肥,该化肥属于__________(填“氮肥”、“磷肥”或“钾肥”)。
【生产实际分析】
31.(3分)(1)①+4 ②NaCl (2)7:22
△
32.(3分)(1) (2)2NaHCO3 ==== Na2CO3 +CO2↑ +H2O (3)氮肥
昌平区
〖生产实际分析〗
31.(2分)“太阳能光伏发电”能有效推行“低碳经济”的发展,其最关键的材料是高纯硅(Si)。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法。生产流程示意
石英砂
粗硅
HCl
300℃以上
精馏
300℃以上
H2
1084℃
高纯硅
SiHCl3(粗)
SiHCl3(精)
焦炭
高温
图如下:
已知:石英砂的主要成分是SiO2,其纯度为80%。
(1)请完成三氯甲硅烷(SiHCl3)和H2反应的化学方程式SiHCl3+ H2=Si+_______。
过滤
反应②
石灰乳
反应③
一定条件
H2
反应①
煅烧
贝壳
N2
CO2
NH3
母液
纯碱
CO2
NaHCO3固体
NH3等
(2)用300t石英砂,理论上最多可制得高纯硅(Si)为_______t。
饱和食盐水
32.(5分)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知:贝壳的主要成分是CaCO3
反应②的化学方程式为:NaCl(饱和溶液)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
(1)反应①的另一种产物是配制石灰乳的主要原料之一,配制石灰乳时发生反应的化学方程式为 。
(2)反应③的基本反应类型是 ,反应的化学方程式为 。
(3)母液中含有的溶质是 。
(4)整个生产过程中可循环利用的物质是 。
31.(2分,每空1分)
(1)3HCl (2)112
△
32.(5分,每空1分)
(1)CaO+H2O==== Ca (OH)2(2)分解反应2NaHCO3==== Na2CO3 +H2O+CO2↑
(3) NH4Cl、 NaHCO3(4)CO2、NH3
平谷区
【生产实际分析】
29.(3分)烟道气中含有大量CO2,经“捕捉”可用于生产尿素、甲醇等产品。
(1)尿素[CO(NH2)2]属于化学肥料中的 肥。
(2)用“捕捉”CO2生产甲醇,反应的微观示意图如下:
四种物质中属于氧化物的是_________(写化学式),若捕捉22吨二氧化碳,可得到甲醇_________吨。
30.(3分)蒽醌法是工业生产过氧化氢主要的方法。主要流程如下:
(1) 氢化釜中发生的变化属于 (填“物理变化”或“化学变化”)。
(2) 反应生成过氧化氢的设备为_________。
A、氢化釜 B、氧化釜 C、分离塔 D、蒸馏塔
(3)蒸馏塔的作用是_________
29.(3分)(1)氮肥 (2)CO2 和H2O 16吨
30. (3分)(1)化学变化 (2)氧化釜 (3)增大过氧化氢溶液的溶质质量分数
通州
【生产实际分析】
31.(2分)乙醇是一种重要的化工原料。可以通过多种方法制取乙醇。
Ⅰ.发酵法:含淀粉的农产品,如谷类、薯类或野生植物果实等;或者用含纤维素的木屑、植物茎秆等。这些物质经一定的预处理后,经水解、发酵,即可制得乙醇。这一过程属于 变化(填“物理”或“化学”)。
Ⅱ.乙烯水化法:
该反应的微观示意图如下:
一定条件
请写出反应的化学方程式 。
32.(4分)工业用石灰石吸收废气中的二氧化
硫,并制取石膏(主要成分为硫酸钙),简
易流程如右图,主要的反应为:
2CaCO3 + O2 + 2SO2 === 2CaSO4 + 2X。
(1)主要反应中物质X的化学式为: 。
(2)反应前后,硫元素化合价从+4→ 。
(3)减少二氧化硫的排放,主要为了 。(填序号)
A.减少酸雨形成 B.减少温室效应 C.防止破坏臭氧层
(4)若处理含有3.2kg二氧化硫的废气,要将其完全吸收,至少需要碳酸钙 kg。
31.Ⅰ.化学 Ⅱ.C2H4 +H2O C2H6O
32.(1)CO2 (2)+6 (3)A (4)5 Kg
怀柔区
【生产实际分析】
30.(2分)右图是某燃煤发电厂处理废气的装置示意图。
(1)该厂处理废气后,获得的最终产物是 。
(2)此过程中出现化合价变化的元素是 。
31.(4分)以粗盐为原料生产ClO2(可用于自来水消毒)的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图,其中反应Ⅲ制取ClO2的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
⑴试剂X是______(填化学式);操作A的名称是_____。
(2)加入适量HCl除为了满足电解时的微酸性外,还能除去溶液中的杂质离子,其中所发生的中和反应的化学方程式:______________________。
(3)为提高经济效益,生产过程中除将H2和Cl2制成HCl充分利用外,还可循环使用的物质Y是______。
【生产实际分析】
30.(2分)(1)CaSO4(2)S、O
31.(4分) ⑴Na2CO3 过滤(2)NaOH+HCl=NaCl+H2O(3)NaCl
房山区
〖生产实际分析〗
高温
30.(3分)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来并加以利用。用氢氧化钠溶液来“捕捉”CO2,其过程如下图所示(部分条件及物质未标出)。
(提示:高温反应炉中的反应为:CaCO3 CaO + CO2↑)
请根据有关信息回答问题:
(1)用氢氧化钠溶液“捕捉”CO2的化学方程式为_____。
(2)反应分离室中需进行的实验操作为_________。
(3)整个工业流程中,可以循环使用的物质是______。
31.(3分)处理废旧相纸和胶片的过程中,可得到含硝酸银的废液。通过以下方法可从
磁铁吸引
步骤2
稀硫酸
步骤3
硝酸银
溶液
固体A
2.2g
铁粉
步骤1
固体B
1.0 g
滤液
无明显
变化
废液中回收银。
(1)步骤2发生的是_________(填“物理”或“化学”)变化。
(2)步骤3的目的是_________。
(3)固体A中的成分及其质量分别为_________。
30. (1)2NaOH + CO2 = Na2CO3 + H2O (2)过滤
(3)氢氧化钠 氧化钙
31. (1)物理 (2)检验固体B中是否含有铁粉
(3)Fe:1.2g,Ag:1.0g
门头沟
〖生产实际分析〗
29. (3分)在催化剂的作用下,用O2将HCl转化为Cl2,可提高效益,减少污染。主要流程如下:
(1)写出反应I的化学方程式 。
(2)反应Ⅱ所属基本反应类型为 。
(3)钠在氯气中燃烧生成氯化钠,4.6g钠完全转化为氯化钠,至少需要氯气的质量为 g。
30.(3分)氨碱法生产纯碱工艺如下图所示,图中生成的NaHCO3受热后会转化成纯碱。
(已知碳酸钙在设备甲中高温分解生成二氧化碳和氧化钙)
(1)设备丙中发生反应的化学方程式为 。
(2)设备乙中反应物所含元素除C、H、O外,还有 (用元素符号表示)。
(3)设备丁中反应后的产物是 。
29.(3分)
(1)2HCl + CuO===CuCl2+ H2O (2)置换反应 (3)7.1g
30.(3分)
(1)CaO + H2O == Ca(OH)2 (2)Na、N、Cl (3)CaCl2、NH3、H2O