- 910.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点34 气体的制取
一、选择题
12.(2015·泰安)下列有关实验室制取气体的说法错误的是
A.装置①可作为C02的发生装置 B.装置②干燥02时,气体由a管进b管出
C.装置③可用作O2的收集装置 D.装置④是收集C02气体的验满方法
10. (2015·泰安)如图所示,龙龙同学采用手握试管外壁的方法检査装置的气密性,若装置的气密性良好,则将双手移开一会后,烧杯内导管处的现象(画圈部分)是C
5、(2015.成都)实验室用氯酸钾和二氧化锰制取氧气,有关该实验的说法错误的是
A、二氧化锰是反应物
B、与高锰酸钾制取氧气装置相同
C、可用向上排空气法收集
D、可用带火星的木炭检验氧气
5.(2015·德州)下图是干燥、收集某气体的装置。由实验装置可以推测该气体的有关性质,请你在表中找出相对应的选项。
序号
气体性质
A
B
C
D
溶于水中所得溶液的pH
>7
<7
>7
<7
其密度(ρ1)与空气密度(ρ2 )的比较
ρ1>ρ2
ρ1>ρ2
ρ1<ρ2
ρ1<ρ2
在水中的溶解性
极易溶
难溶
极易溶
难溶
7.(2015·德州)要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①硝酸铵和水;②铁和稀硫酸;③固体氢氧化钠和水;④生石灰和水;⑤石灰石和稀盐酸
A.①②③④⑤ B.②③④⑤
C.②③⑤ D.②④⑤
二、填空题
36.(2015·泸州)下图装置适当组合可用于O2、H2、CO2等气体的制备和收集。
(1)仪器①的名称是 分液漏斗 ,若A装置内药品为Zn和稀盐酸,反应的方程式为Zn+2HCl=ZnCl2+H2↑ 。
(2)B装置正放桌面,用于收集A生成的O2,则a接 b (选填“b”或“c”);若B装满水,用于收集A生成的H2,则a接 c (选填“b”或“c”)。
(3)如果要制取和收集干燥的CO2,需要在A装置之后连接两个B装置,则在前一个B装置内加入的试剂是 浓硫酸 (选填“浓硫酸”或“氢氧化钠”)。
41.(2015·娄底)请结合下列实验装置,回答有关问题:
A B C D E
(1)写出仪器a的名称 53
(2)实验室若用石灰石和稀盐酸制取并收集干燥的二氧化碳,选用的装置为 54
(填字母)。加试剂前,要连接好装置并检查装置的 55 。将二氧化碳通入紫色石蕊溶液中,紫色石蕊溶液变 56 色。
(3)用B装置能否制取氧气? 57 (填“能”或“不能”)
(1)铁架台 (2)BD 气密性 红 (3)能
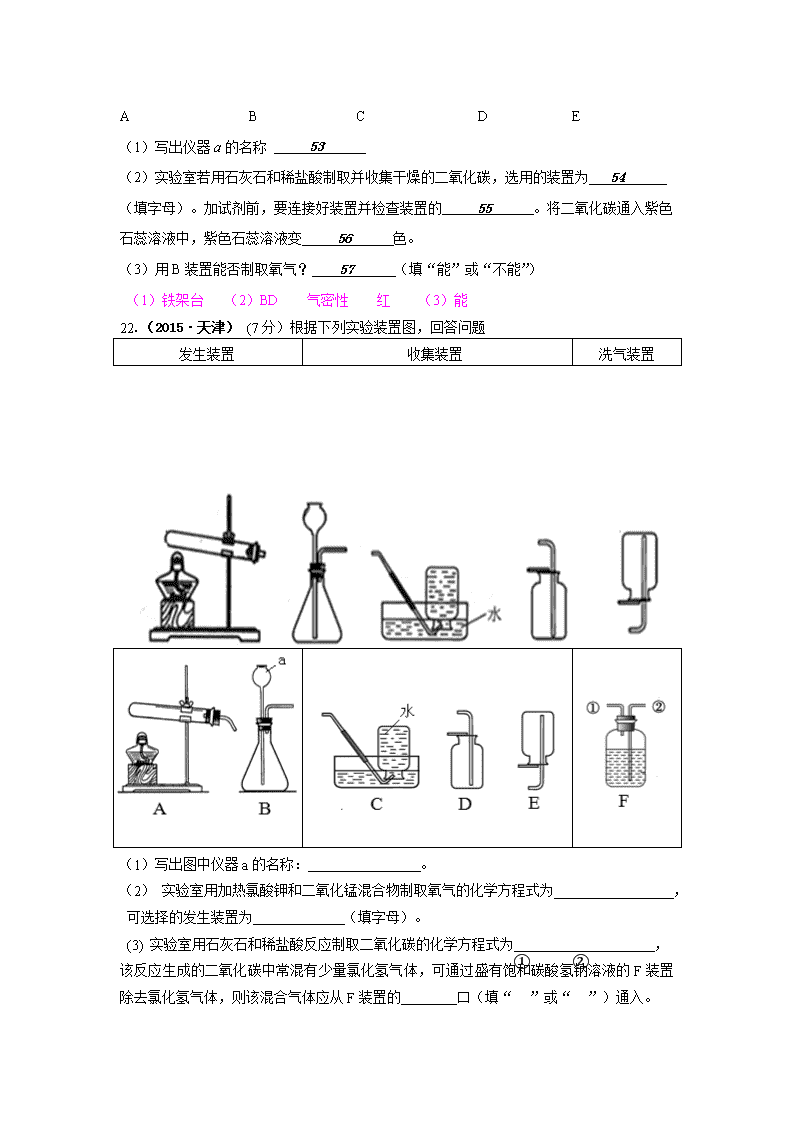
22.(2015·天津) (7分)根据下列实验装置图,回答问题
发生装置
收集装置
洗气装置
(1) 写出图中仪器a的名称: 。
(2) 实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为 ,
可选择的发生装置为 (填字母)。
(3) 实验室用石灰石和稀盐酸反应制取二氧化碳的化学方程式为 ,
该反应生成的二氧化碳中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置除去氯化氢气体,则该混合气体应从F装置的 口(填“①”或“②”)通入。
22.(7分)(1)长颈漏斗
△
(2)2KClO3 MnO2 2KCl + 3O2 ↑ A
(3)CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ ②
三、实验题
12.(2015·安徽)(5分)通过近一年的化学学习,你已经掌握了实验室制取气体的有关方法。请根据下图回答问题:
(1)仪器①的名称是________,利用A装置制取的气体有H2、O2和_________。
(2)B装置在化学实验中有广泛的用途。
①用排水法收集氢气,可在B装置中装满水后,使氢气从_______口进入(填“a”或“b”);
②若想得到干燥的氢气,可在B装置中加入________,气体应从_______口进入(填“a”或“b”);
答案:(1)锥形瓶;二氧化碳(CO2)
(2)①a ②浓硫酸;b
17. (2015·呼和浩特)实验室常用下列装置制取气体,请你根据所学知识回答下列问题。
(1)仪器a的名称是 。
(2)实验室制取氧气时,选用的收集装置是 (填字母序号)。
若改用右图装置收集氧气,则气体应从 进(填“a”或“b”)。
(3)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为______________________________;将生成的气体通入澄清石灰水中,未见变浑浊。为探究其原因,进行了如下过程:
【作出猜想】 A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体。
【实验探究】[来源:学#科#网]
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色。于是排除了猜想A,你认为排除猜想A的理由是_____________。
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验。请你帮他完成实验,填写
以下表格:
实验步骤
实验现象
实验结论
气体中有HCl
【查阅资料】
碳酸钠溶液中通入二氧化碳发生反应: Na2CO3 + CO2 + H2O = 2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为 (填字母)。
17.(1)酒精灯(1分) (2) C (1分) b (1分)
(3) CaCO3+2HCl=CaCl2+CO2↑+H2O (1分)
①酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2(1分)
实验步骤
实验现象
实验结论
将生成的气体通入AgNO3 溶液中(1分)
产生白色沉淀(1分)
气体中有HCl
②
B H E C(1分)
51. (2015·上海)实验室常用的制取气体的发生装置如下:
①仪器a的名称是___________;搭建B装置时,酒精灯应在固定仪器a之_________(选填“前”或“后”)放置。
②实验室用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学方程式是__________。
③在实验室制取二氧化碳的研究中,进行了如下实验:
实验
编号
药品
甲
乙
丙
丁
大理石
m g,块状
m g,块状
m g,粉末状
m g,粉末状
盐酸(过量)
w g,稀盐酸
w g,浓盐酸
w g,稀盐酸
w g,浓盐酸
I .上述实验中反应的化学方程式是____________。
II.若要研究盐酸浓度大小对反应的影响,可选择实验甲与_______对照(选填实验标号)。
III.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是_______。
IV.研究发现酸的浓度越大,产生气体的速度越快。与甲比较,对丁分析正确的是_______(选填标号)。
a.反应更为剧烈 b.最终剩余溶液的质量更小
c.产生二氧化碳的质量更大 d.粉末状大理石利用率更高
④下表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳地产生。请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因。
目的
原料
发生装置
气体较平稳产生的最主要的一个原因
制取二氧化碳
块状大理石
稀盐酸
A
__________________
制取氧气
粉末状二氧化锰
3%的过氧化氢溶液
C
__________________
①试管 前 ②2H2O2 MnO2 2H2O+ O2↑
③CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 乙 固体反应物的颗粒大小(或反应物的接触面积) ab ④反应物的接触面积较小 通过分液漏斗控制液体滴加速度
18. (2015·广安)下列是实验室制取气体和收集气体的实验装置,根据装置图回答下列问题。
(1) 实验室用氯酸钾和二氧化锰制取氧气,发生装置应选择_________(填编号),装置中还缺少的玻璃仪器是____________。
(2) 实验室用过氧化氢溶液与二氧化锰制取氧气,其化学反应方程式是_________________________,为了便于观察氧气是否集满,应选用的收集装置是___________(填编号)。
(1)A 酒精灯 (2)2H2O2 MnO2 2H2O+ O2↑ E
23.(2015·益阳)在一次化学课上,老师提供了以下装置探究制取气体的方法。
请回答:
(1)可用于实验室制取CO2的发生装置和收集装置是 ▲ ;
A.①与③ B.①与④ C.②与③ D.②与④
(2)写出实验室制取CO2的化学方程式 ▲ ;
(3)利用装置③收集的气体具有的性质是 ▲ 。
23.(每空2分,共6分) (1)B(或填①与④)
(2)CaCO3+2HCl=== CaCl2+H2O+CO2↑ (未配平不给分)
(3)密度比空气小
31.(2015·济南)(6分)如下图所示为实验室中常见气体制备、净化、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各探究实验。
(1)以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体。按照要求设计实验装置、连接仪器,并检验装置的气密性。
①所选仪器的连接顺序为_______________(从左至右填写仪器序号字母)(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)。
②用石灰石和稀盐酸制取二氧化碳的化学方程式为_________________________
③若将二氧化碳气体通入酚酞试液中,试液显_________色。
(2)用一氧化碳气体(含少量水蒸气)测定某铁的氧化物(FexOy)的元素组成比例,并验证反应中气体生成物的性质。所选仪器按A1 -----B-----C----- A2顺序连接(A1、A2为浓硫酸洗气瓶),并检验装置的气密性,所设计的实验装置中气体流向是从左向右。
①反应前大玻璃管中加入铁的粉末状氧化物(FexOy)试样的质量为ag,实验结束后,继续通入一氧化碳气体,直至大玻璃管冷却。这时测量到E处大玻璃管中粉末状固体的质量减少了bg,试推算该铁的氧化物的化学式中x、y的比值:x/y=__________.(用含a和b的代数式表示)。(设所发生的反应均完全进行)
②将少量二氧化碳通入大量澄清石灰水中,出现白色浑浊,且溶液质量减小。试解释溶液质量减小的原因: _______________________________________________________.
③对于该实验方案设计还存在不完善之处,你的具体改进方案是_________________________
31. (1)①B→D→A→G ②CaCO3+2HCl=CaCl2+H2O+CO2↑ ③ 无
(2)① 2(a-b)/7b ② 生成碳酸钙沉淀的质量大于通入二氧化碳的质量
③装置末端加一只燃着的酒精灯,处理尾气
四、计算题
16.(2015·南充)实验室有不纯的氯酸钾样品12.5g,把该样品与少量二氧化锰混合加热制取氧气(杂质参加反应),充分反应后,固体混合物质量变化如下所示:
反应前固体总质量
反应后固体总质量
13.5g
8.7g
(1)生成氧气的质量为__g;
(2)氯酸钾在样品中的质量分数是多少?
16.(1)4.8
(2)解:设样品中氯酸钾的质量为x
2KClO3 2KCl + 3 O2 ↑
245 96
x 4.8g
245/96=x/4.8g
x=12.25g
样品中氯酸钾的质量分数为:12.25g/12.5g×100%=98%
答:氯酸钾在样品中的质量分数是98% 。
50. (2015·上海)实验室用氯酸钾和二氧化锰的混合物制取氧气,某次实验中固体的质量变化如下:
①生成氧气的质量是__________g,其物质的量为______mol 。
②求参加反应的氯酸钾的物质的量。(根据化学反应方程式列示计算)_______________
①4.8 0.15
②解:设参加反应的氯酸钾的物质的量为x
2KClO3 2KCl + 3 O2 ↑
2 3
x 0.15mol
答:参加反应的氯酸钾的物质的量为0.1mol。
17.(2015·宜宾)(10分)有关资料介绍,制取氧气有多种方法,其中氧化铜与氯酸钾混合加热,也能很快产生氧气。先将2.5g氧化铜与24. 5g氯酸钾的混合物充分加热,残余固体经冷却、称量,质量为17.4g。然后将固体溶于65.1g水中,充分搅拌,过滤,得到滤液和黑色的滤渣。滤渣又经洗涤、烘干、称量,质量为2.5g。(不考虑过程中物质的损失,计算结果保留1位小数)
(1)该反应中氧化铜起 _作用。
(2)生成的O2质量为_ 克。
(3)所得滤液中溶质是 _,其质量分数为 。
(4)向所得滤液中加入质量分数为16%的AgNO3溶液恰好完全反应,需AgNO3溶液的质量为多少克?(列出必要的计算过程)。
17.(1)催化 (2)9.6 (3)氯化钾 18.6%
(4)设需要AgNO3的质量是x
KCl + AgNO3 === AgCl↓ + KNO3
74.5 170
14.9g X
需要AgNO3溶液的质量是:
答:需要AgNO3溶液的质量是225g。
25.(2015·重庆B)(7分)取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16 .4g ,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失)。计算:
(1)生成氧气的质量。
(2)二氧化锰的质量。
(3)氯化钾溶液中水的质量。
25.解:(1)生成氧气的质量为26g-16.4g=9.6g;
(2)设:原混合物中氯酸钾的质量为x,生成氯化钾的质量为y
2 KClO3 2 KCl + 3 O2↑
245 149 96
X y 9.6g
X=24.5g y=14.9g
所以二氧化锰的质量为26g—24.5g=1.5g
(3)根据题意易知氯酸钾已全部分解,生成氯化钾的质量为14.9g
所以氯化钾溶液质量为
氯化钾溶液中水的质量为149g—14.9g=134.1g
答:(1)生成氧气质量为9.6g
(2)二氧化锰的质量为1.5g
(3)氯化钾溶液中水的质量为134.1g
25.(2015·益阳)某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
反应前物质的质量/g
充分反应后物质的质量/g
过氧化氢溶液
二氧化锰
固体与液体混合物质量
68.0
0.1
66.5
请计算:
(1)该同学制得氧气的质量为 ▲ 。
(2)该同学所用过氧化氢溶液的溶质质量分数。(相对原子质量:H-1 O-16)
25.(6分)
(1)1.6 g(2分)
MnO2
(2)解:设参加反应的H2O2的质量为x
2H2O2 === 2H2O + O2↑ ……………………(1分)
68 32
x 1.6 g ……………………(1分)
x=3.4 g ……………………(1分)
…………………………………(1分)
答:该同学所用过氧化氢溶液的溶质质量分数是5%。