- 1.35 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018年北京市日坛中学中考初中化学期末测试模拟题
可能用到的相对原子质量:H—1 C—12 O—16 S—32 Cu—64
一、单项选择题(每小题4分,共24分)
7、化学与生活息息相关,下列说法不正确的是
A、加热能杀死流感病毒是因为病毒的蛋白质受热发生变性
B、淀粉、油脂和蛋白质均可水解并都是重要的营养物质
C、乙酸和葡萄糖均属电解质
D、在轮船船身嵌上锌块可保护船体
8、在水溶液中能大量共存的一组是
A.NH4+、Ag+、C032-、S042- B.Fe2+、H+、Mn04-、HC03_
C.K+、Na+、N03-、S042- D.Al3+、Mg2+、C1-、Si032-
9、设NA为阿伏伽德罗常数的数值,下列说法正确的是
A、常温下,40gS03含有1.5NA个氧原子
B、1L 0.1mol/L的醋酸溶液中含有0.1NA个H+
C、标准状况下,22.4L CCl4含有4NA个C—C1键
D、lmolNa与足量的H20反应,转移2NA个电子
A
B
C
D
10、短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。
下列判断不正确的是
A、最简单气态氢化物的热稳定性:A>C
B、最高价氧化物对应水化物的酸性:CC>A
D、含B元素的盐溶液一定显酸性
11、下列有关实验的叙述,正确的是
A、用碱式滴定管量取20.00mL KMn04溶液
B、用玻璃棒蘸取浓硫酸点在PH试纸上,测其PH
C、取用一小块钠后,剩余的钠放到垃圾桶里
D、配制一定物质的量浓度的稀硫酸时,定容时俯视,则所配溶液的浓度偏高
12、下列物质的用途,应用了氧化还原反应的是
A、用食醋除去热水瓶胆壁上的水垢 B、用次氯酸钠溶液消毒浴池
C、盐卤用于制豆腐 D、用小苏打发酵面团制作馒头
二、双项选择题(每小题6分,共12分)
22.下列陈述I、II正确并且有因果关系的是
选项
陈述I
陈述II
A
Br2蒸气和N02都是红棕色气体
可用淀粉碘化钾水溶液鉴别
B
BaS04和BaC03都是难溶物
医疗上都能用作“钡餐”
C
硬铝是合金
其熔点比金属铝的熔点低
D
电镀时阴极上发生还原反应
可在铁的镀件上镀铜
23、对于常温下0.0lmol/L的氨水,下列叙述正确的是
A、c(H+)+c(NH4+)=c(0H-)
B、与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3· H20)=0.02 mol·L-1
C、与等体积等浓度的盐酸混合后所得溶液显酸性
D、由H20电离出的c(H+)=1.0×10-12 mol·L-1
三、非选择题
30、(16分)贝诺酯是由扑热息痛、阿司匹林经化学法拼合制备的解热镇痛抗炎药,其合成如下(反应条件略去):
(1)扑热息痛的分子式是_________________
(2)下列叙述正确的是___________________
A、生成贝诺酯的反应属于取代反应
B、FeCl3溶液可区别阿司匹林和扑热息痛
C、常温下贝诺酯在水中的溶解度小于扑热息痛
D、贝诺酯既是酯类物质,也是氨基酸
(3)1mol阿司匹林最多可跟________mol的H2反应。
(4)写出阿司匹林与足量的NaOH溶液反应的化学方程式__________________________________________________________。
(5)病人服用贝诺酯或阿司匹林,都能在消化液的作用下发生水解反应,且有两种产物相同,其中属芳香族化合物的结构简式是__________________________________________________________
(6)扑热息痛可由对氨基苯酚和乙酸酐[(CH3CO)20]在一定条件下制备,写出其反应的化学方程式
__________________________________________________________
31.(16分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:___________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H2将N02还原为N2 。已知:
2H2(g)+02(g)=2H20(g) △H= a kJ·mol-1
N2(g)+202(g)=2N02(g) △H= b kJ·mol-1
H20(1)=H20(g) △H= c kJ·mol-1 则反应2NO2(g)+4H2(g)=N2(g)+4H20(1)的△H=_________。(用a、b、c表示)
(3)①合成氨反应的化学方程式为N2+3H22NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
A、容器内N2、H2、NH3的浓度之比为1:3:2
B、3v正(N2)=v逆(H2)
C、容器内压强保持不变
D、混合气体的相对分子质量保持不变
E.1mol N三N键断裂,同时1mol H—H键断裂
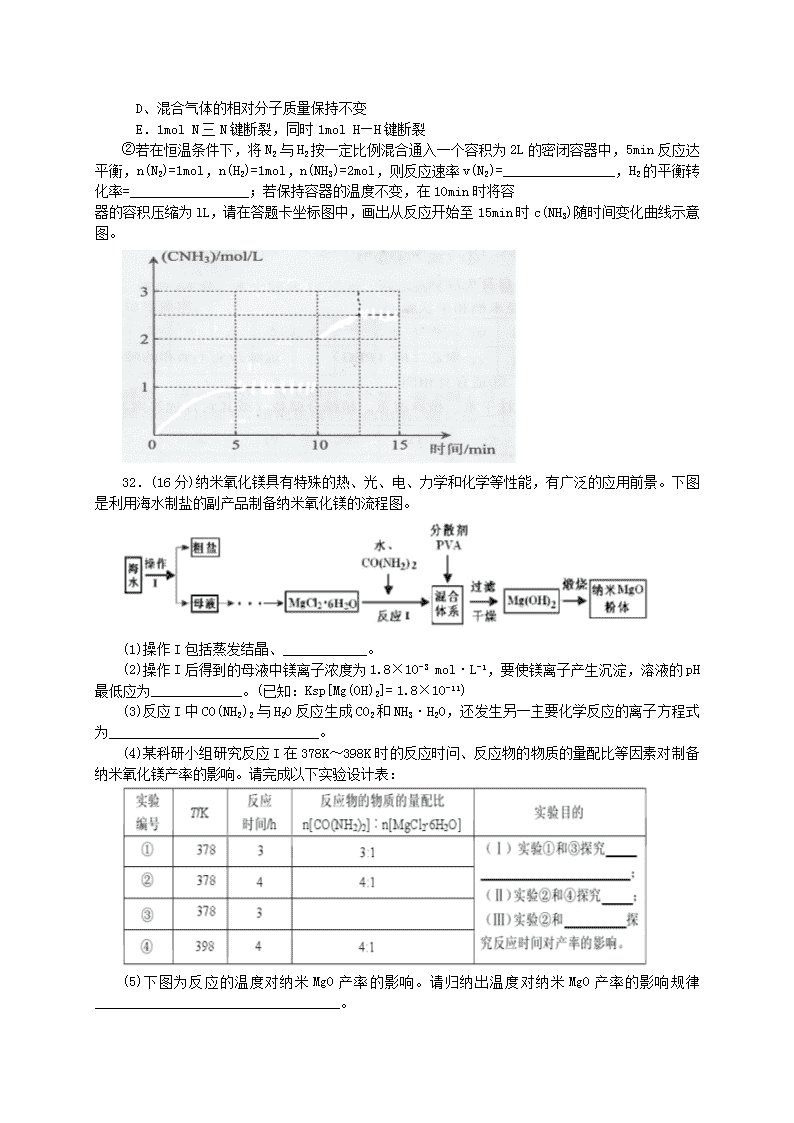
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L的密闭容器中,5min反应达平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,则反应速率v(N2)=________________,H2的平衡转化率=_________________;若保持容器的温度不变,在10min时将容
器的容积压缩为lL,请在答题卡坐标图中,画出从反应开始至15min时c(NH3)随时间变化曲线示意图。
32.(16分)纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景。下图是利用海水制盐的副产品制备纳米氧化镁的流程图。
(1)操作I包括蒸发结晶、____________。
(2)操作I后得到的母液中镁离子浓度为1.8×10-3 mol·L-1,要使镁离子产生沉淀,溶液的pH最低应为_____________。(已知:Ksp[Mg(OH)2]= 1.8×10-11)
(3)反应I中CO(NH2)2与H20反应生成C02和NH3·H20,还发生另一主要化学反应的离子方程式为______________________________。
(4)某科研小组研究反应I在378K~398K时的反应时问、反应物的物质的量配比等因素对制备纳米氧化镁产率的影响。请完成以下实验设计表:
(5)下图为反应的温度对纳米MgO产率的影响。请归纳出温度对纳米MgO产率的影响规律___________________________________。
33、(16分)某研究性学习小组将一定浓度的Na2C03溶液滴入CuSO4。溶液中得到蓝色沉淀。关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3;
假设2:沉淀是Cu(OH)2;
假设3:沉淀是_____________________________________
(1)若假设1成立,则发生反应的离子方程式为__________________________________________________________
(2)若假设2成立,原因是____________________________________
(3)该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。已知:①CuC03和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。
实验步骤
预期现象
结论
①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。
②称取一定质量的沉淀______________________,然后___________________冷却后再称量B、D的质量分别为m3 、 m4
(1)若m1 = m3,m2 < m4
(2)若m1___m3,m2___m4
(3)若ml___m3,m2___m4
(1)假设1成立
(2)假设2成立
(3)假设3成立
(4)若沉淀样品的质量为w克,装置B质量增加了n克,则沉淀中Cu(OH)2的质量分数为__________________________。
参考答案及评分标准
一、选择题部分
题号
7
8
9
10
11
12
22
23
答案
C
C
A
D
D
B
CD
AC
三、非选择题部分
30、(16分)
(1)C8H902N (2分)
(2)ABC (3分,错选或漏选1个扣1分)
(3)3 (2分)
(4) (3分,不写△不扣分,漏写H20或不配平扣1分)
(5) (3分)
(6)
(3分,不写“一定条件”不扣分)
31.(16分)
(1)4NH3+502 4NO + 6H20 (2分) 减小(2分)
(2)(2a-b-4c)kJ/mol (2分,不写单位扣1分)
(3)①B C D(3分)
②0.1mol/(L·min) (2分,不写或写错单位0分) 75%(2分)
(共3分,前10min的曲线1分;10~15min的曲线2分,到达平衡的时间应小于15min,NH3
平衡浓度小于2.67 mol/L)
32.(16分)
(1)过滤(2分)(写趁热过滤1分)
(2)10(3分)
(3)Mg2++2NH3·H20=Mg(OH)2↓ + 2NH4+ (3分)
(4)③4:1 (2分) (II)温度对产率的影响(2分) (III)③(1分)
(5)其他条件相同时,在378K~398K,纳米MgO的产率随温度升高而升高,之后纳米MgO的产率随温度升高而降低。(或其他条件相同时,纳米MgO的产率随温度的升高先升高后降低)(3分)
33.(16分)
假设3:CuC03和Cu(OH)2的混合物。(2分) 、
(1)Cu2+ + C032—=CuC03↓ (2分)
(2)发生水解反应(1分),且Cu(OH)2比CuC03更难溶(1分)。
(3)
(4)49n/9w (2分) (或4900n/9w%)