- 515.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2讲 工艺流程分析型实验题
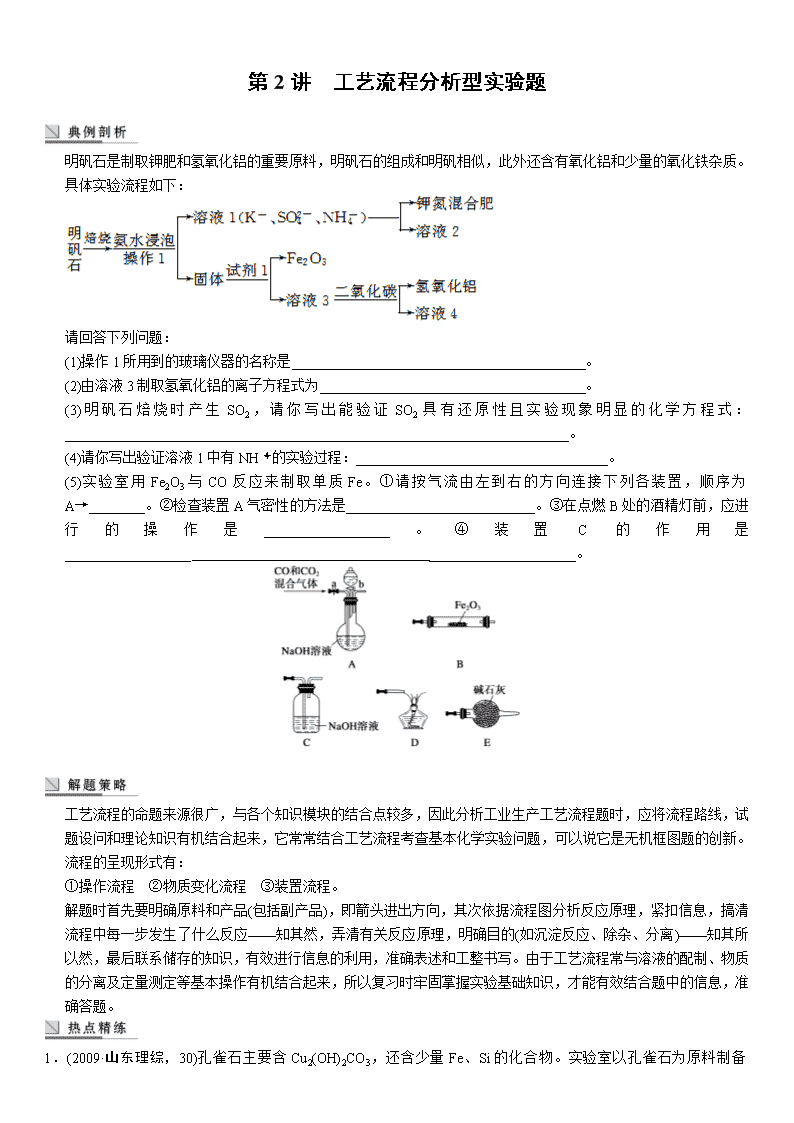
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是__________________________________________。
(2)由溶液3制取氢氧化铝的离子方程式为______________________________________。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式:________________________________________________________________________。
(4)请你写出验证溶液1中有NH的实验过程:____________________________________。
(5)实验室用Fe2O3与CO反应来制取单质Fe。①请按气流由左到右的方向连接下列各装置,顺序为A→________。②检查装置A气密性的方法是___________________________。③在点燃B处的酒精灯前,应进行的操作是__________________。④装置C的作用是__________________ _____________________。
工艺流程的命题来源很广,与各个知识模块的结合点较多,因此分析工业生产工艺流程题时,应将流程路线,试题设问和理论知识有机结合起来,它常常结合工艺流程考查基本化学实验问题,可以说它是无机框图题的创新。流程的呈现形式有:
①操作流程 ②物质变化流程 ③装置流程。
解题时首先要明确原料和产品(包括副产品),即箭头进出方向,其次依据流程图分析反应原理,紧扣信息,搞清流程中每一步发生了什么反应——知其然,弄清有关反应原理,明确目的(如沉淀反应、除杂、分离)——知其所以然,最后联系储存的知识,有效进行信息的利用,准确表述和工整书写。由于工艺流程常与溶液的配制、物质的分离及定量测定等基本操作有机结合起来,所以复习时牢固掌握实验基础知识,才能有效结合题中的信息,准确答题。
1.(2009·山东理综,30)孔雀石主要含Cu2(OH)2CO3
,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4)2S
c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式)。若实验过程中有氨气逸出,应选用下列__________装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到_________________________________________________________。
用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
2.过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是___________________________________;
(2)检验“水洗”是否合格的方法是_____________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①______________________;②________________________________________________________________________。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O=2I-+S4O】
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”
),原因是________________________________________________________________________。
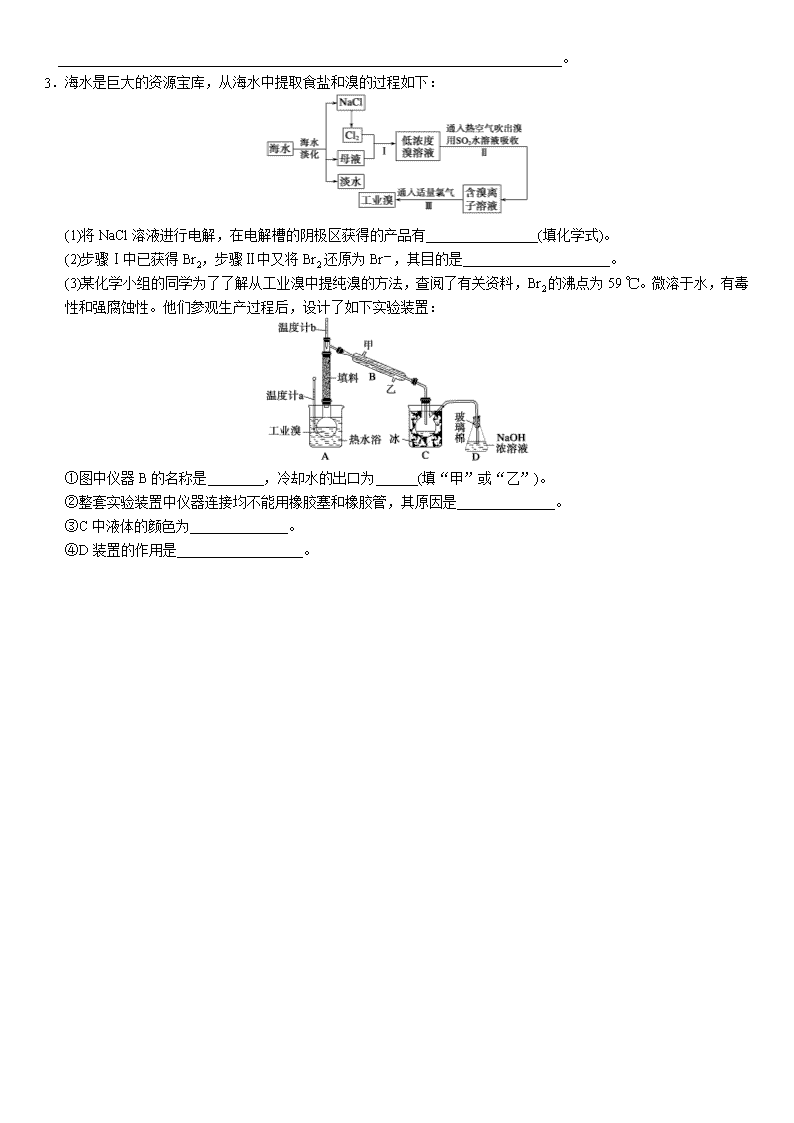
3.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)将NaCl溶液进行电解,在电解槽的阴极区获得的产品有________________(填化学式)。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
①图中仪器B的名称是________,冷却水的出口为______(填“甲”或“乙”)。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是______________。
③C中液体的颜色为______________。
④D装置的作用是__________________。
第1讲 评价与探究型实验题
第2讲 工艺流程分析型实验题
1.实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是__________。
2.实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4===ZnSO4+H2↑
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置__________(填代号)和制备并收集干燥、纯净Cl2的装置______________(填代号)。
可选用制备气体的装置:
3.铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药物不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂Ⅰ是__________。
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是________________________________________________________________________。
(3)在实验中发现放置一段时间后,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
编号
猜想
甲
溶液中的+3价Fe又被还原为+2价Fe
乙
溶液中的SCN-被过量的氯水氧化
丙
新制氯水具有漂白性,将该溶液漂白
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。
编号
实验操作
预期现象和结论
4. 根据要求完成下列各小题的实验目的,a、b为活塞,加热及固定装置已略去。
(1)验证碳、硅非金属性的相对强弱。
①连接仪器、 、加药品后,打开a,关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是____________________________________________,
装置A中的试剂是 。
③能说明碳的非金属性比硅的非金属性强的实验现象是 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①(1)中①操作改为打开b,关闭a,其他不变。
②H2S溶液中有浅黄色浑浊出现,其化学反应方程式是 。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入表中相应位置。
滴加的溶液
氯水
氨水
沉淀的化学式
写出其中SO2显还原性生成沉淀的离子方程式:________________________________。
5.纯碱、烧碱等是重要的化工原料。
(1)利用右图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹将胶头滴管中的液体挤入烧瓶,此时的实验现象是______________,反应的离子方程式是________________________________________________________________。
(2)向100 mL 2 mol·L-1的NaOH溶液中通入一定量CO2,充分反应后将溶液在一定条件下蒸发结晶,得到少量的白色固体。试设计实验确认该白色固体的成分。
①提出合理假设。
假设1:该白色固体为NaOH和Na2CO3;
假设2:该白色固体为Na2CO3;
假设3:该白色固体为NaHCO3;
假设4:该白色固体为____________。
②基于假设1,设计实验方案进行实验证明固体的成分是NaOH和Na2CO3。请在答题卡上写出实验步骤及预期现象和结论。(步骤可不填满也可增加)
限选实验试剂及仪器:1 mol·L-1HCl溶液、1 mol·L-1MgCl2溶液、0.5 mol·L-1BaCl2溶液、1 mol·L-1Ba(OH)2溶液、甲基橙试液、酚酞试液、试管、胶头滴管、过滤装置。
实验步骤
预期现象和结论
步骤1:
步骤2:
步骤3:
6. 过碳酸钠,俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等行业中,它的制备原理和路线如下:
2Na2CO3+3H2O2===2Na2CO3·3H2O2 ΔH<0
↓ ↓
→→→
↑ ↓
请回答下列问题。
(1)与过碳酸钠的用途相关的化学性质是________________________________________。
(2)下列物质可使过碳酸钠较快失效的是________。
a.MnO2 b.H2S
c.稀硫酸 d.NaHCO3
(3)加入NaCl的作用是_______________________________________________________。
(4)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是___________________________________________________________。
(5)反应的最佳温度控制在15~20 ℃,温度偏高时造成产率低的原因可能是________________________________________________________________________,
温度偏低时造成产率低的原因可能是__________________________________________。
(6)以上流程中遗漏了一步操作,造成所得产品纯度偏低,该步操作的名称是______________。进行该操作的方法是__________________________________。
(7)抽滤也称吸滤或减压过滤,是一种实验室常用的过滤方
法。如图为减压过滤装置图。
①抽滤能加快过滤速度的原因是____________________。
②写出图中A、B、C三种仪器的名称:
A 、B 、C 。
③吸滤完毕时,应先拆下B与C或C和抽气泵间的橡皮
管,然后关闭水龙头,其原因是_________________________________________________。
7.硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:
请回答下列问题:
(1)确定锌镀层被除去的标志是____________________;
计算上述铁片锌镀层的厚度,不需要的数据是____________(填序号)。
a.锌的密度ρ(g·cm-3) b.镀锌铁片质量m1(g)
c.纯铁片质量m2(g) d.镀锌铁片面积S(cm2)
e.镀锌铁片厚度h(cm)
(2)上述流程中:操作 Ⅰ 是取出铁片、________、________、称量。
(3)A物质可以为________(填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(4)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是________________________________________________________________。
(5)鉴定所得晶体中含有Fe2+、NH、SO离子的实验方法正确的是________(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
答案
典例剖析
(1)玻璃棒、烧杯和漏斗 (2)AlO+2H2O+CO2===Al(OH)3↓+HCO (3)SO2+Cl2+2H2O===H2SO4+2HCl(其他合理答案也可) (4)取少量溶液1,加入浓NaOH溶液后加热,有能使湿润的红色石蕊试纸变蓝的气体产生,证明有NH+4(其他合理答案也可) (5)①E→B→C→D ②将导气管插入水槽中,关闭弹簧夹a和活塞b,微热圆底烧瓶,导管口有气泡产生,撤去热源,导管中形成一段水柱 ③检查CO的纯度 ④除去CO中的CO2,有利于点燃CO
热点精练
1.(1)c d
(2)冷却结晶 引流
(3)NH3 (或NH3·H2O) bd
(4)平视凹液面(或平视刻度线) 凹液面的最低处与刻度线相切 酸式
2.(1)CaCl2+H2O2+2NH3+8H2O===CaO2·8H2O↓+2NH4Cl
(2)可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀
(3)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率
②该反应是放热反应,温度低有利于提高CaO2·8H2O的产率
(4)① ②偏高 ③滴速太慢,S2O在滴定过程中被氧气氧化
3.(1)H2、NaOH (2)提高溴的富集程度
(3)①冷凝管 甲 ②Br2腐蚀橡胶
③深棕红色或红棕色 ④吸收尾气
课时规范训练
1.bd
2.e d
3.(1)稀盐酸(或稀硫酸)
(2)部分Fe2+被空气中的氧气氧化成Fe3+
(3)
编号
实验操作
预期现象和结论
①
取少量褪色后的溶液,加入KSCN溶液
如果溶液变血红色,说明乙同学的猜想是合理的;如果溶液不变血红色,说明乙同学的猜想是不合理的
(其他合理答案也可)
4.(1)①检查装置气密性 ②Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 酸性KMnO4溶液 ③A中酸性KMnO4溶液颜色变浅,盛有Na2SiO3溶液的试管中出现白色沉淀
(2)②2H2S+SO2===3S↓+2H2O ③BaSO4 BaSO3 Ba2++SO2+Cl2+2H2O===BaSO4↓+4H++2Cl-
5.(1)水沿导管由广口瓶进入烧瓶(或水倒吸进入烧瓶) 2OH-+CO2===CO2-3+H2O(或OH-+CO2===HCO) (2)Na2CO3和NaHCO3
实验步骤
预期现象和结论
步骤1:取少量白色固体于试管中,加适量水溶解,再加0.5 mol·L-1BaCl2溶液至过量
产生白色沉淀,说明固体中含有Na2CO3;
步骤2:过滤,取少量滤液(或:静置,用胶头滴管取上层清液少许)于试管中,再向试管中滴加1~2滴酚酞试液
溶液变红色,说明固体中含有NaOH
6. (1)强氧化性(漂白性)
(2)a、b、c
(3)使2Na2CO3·3H2O2在水中的溶解度降低,析出更多晶体
(4)催化双氧水的分解
(5)温度偏高时双氧水易分解 温度偏低时反应缓慢
(6)晶体的洗涤 向过滤器中加蒸馏水至刚好淹没沉淀,静置,待水自然流出后,再重复操作2~3次
(7)①因为通过抽气泵(或其他方法)使过滤器下方的压强降低,滤液上下压强差增大,从而加快过滤的速度 ②布氏漏斗 抽滤瓶 安全瓶 ③防止倒吸
7.(1)反应速率突然减小(或铁片表面生成的气泡突然减少) e
(2)洗涤 烘干(或干燥)
(3)b、d
(4)避免加热过程中晶体受热分解(或被氧化)
(5)b、c、d