- 666.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题 :实验装置的分析和判断
[题型专练]
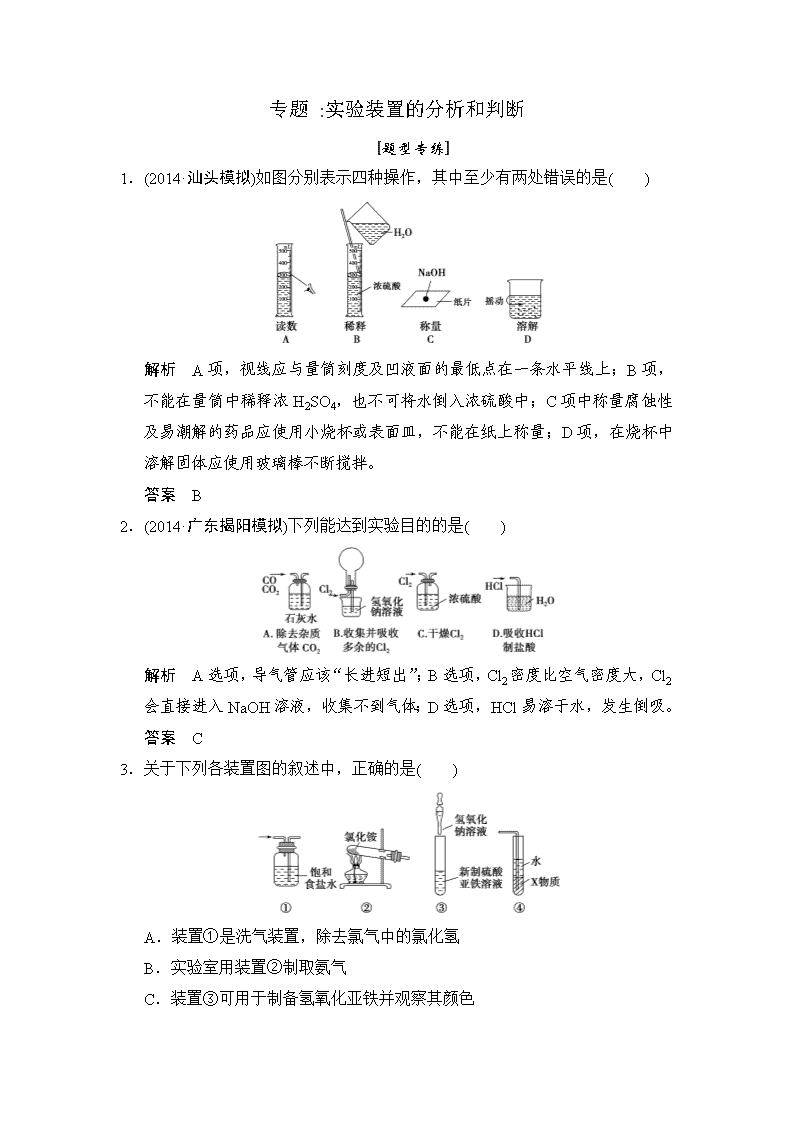
1.(2014·汕头模拟)如图分别表示四种操作,其中至少有两处错误的是( )
解析 A项,视线应与量筒刻度及凹液面的最低点在一条水平线上;B项,不能在量筒中稀释浓H2SO4,也不可将水倒入浓硫酸中;C项中称量腐蚀性及易潮解的药品应使用小烧杯或表面皿,不能在纸上称量;D项,在烧杯中溶解固体应使用玻璃棒不断搅拌。
答案 B
2.(2014·广东揭阳模拟)下列能达到实验目的的是( )
解析 A选项,导气管应该“长进短出”;B选项,Cl2密度比空气密度大,Cl2会直接进入NaOH溶液,收集不到气体;D选项,HCl易溶于水,发生倒吸。
答案 C
3.关于下列各装置图的叙述中,正确的是( )
A.装置①是洗气装置,除去氯气中的氯化氢
B.实验室用装置②制取氨气
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸
解析 装置①作洗气装置时,应“长进短出”;制取氨气时的药品不能选择氯化铵,因为加热生成的氯化氢和氨气在试管口处反应重新生成氯化铵;制备氢氧化亚铁时,胶头滴管要伸入溶液中;由于氨气在四氯化碳中溶解度很小,可以防止倒吸,D正确。
答案 D
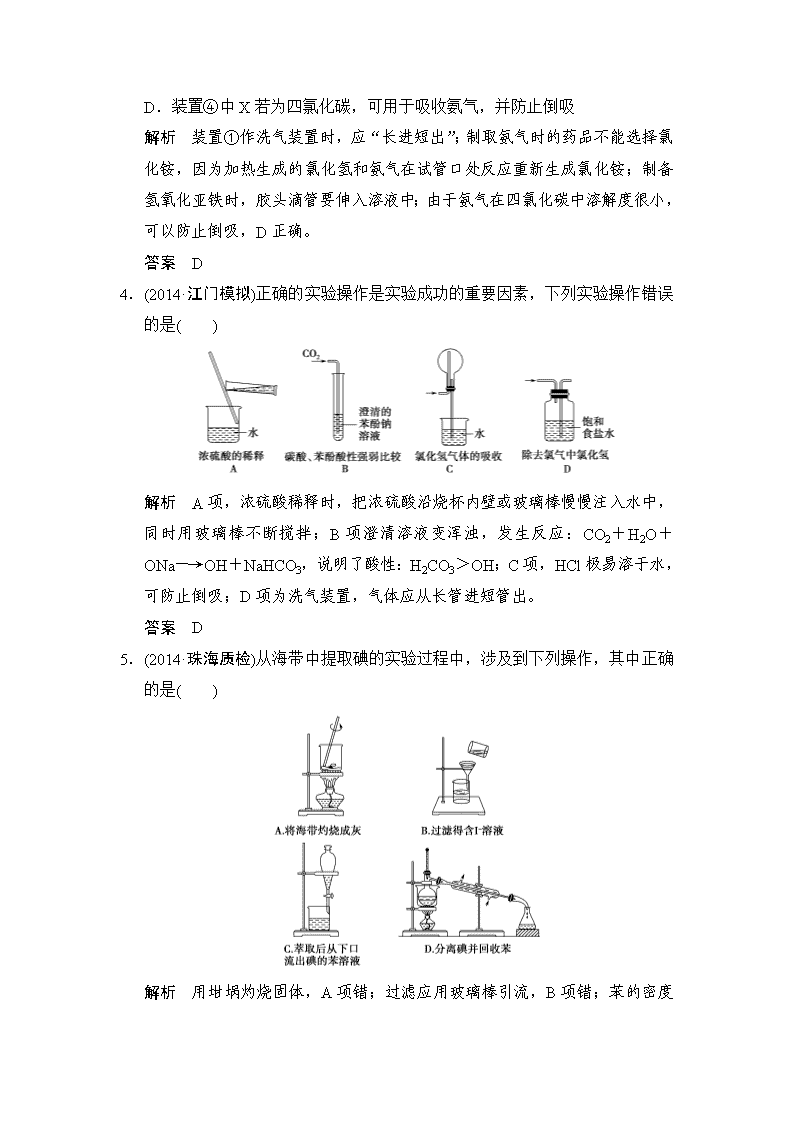
4.(2014·江门模拟)正确的实验操作是实验成功的重要因素,下列实验操作错误的是( )
解析 A项,浓硫酸稀释时,把浓硫酸沿烧杯内壁或玻璃棒慢慢注入水中,同时用玻璃棒不断搅拌;B项澄清溶液变浑浊,发生反应:CO2+H2O+ONa―→OH+NaHCO3,说明了酸性:H2CO3>OH;C项,HCl极易溶于水,可防止倒吸;D项为洗气装置,气体应从长管进短管出。
答案 D
5.(2014·珠海质检)从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是( )
解析
用坩埚灼烧固体,A项错;过滤应用玻璃棒引流,B项错;苯的密度比水小,应从上层倒出,C项错。
答案 D
6.(2014·佛山模拟)下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置检验电流的方向
解析 NaOH溶液应放在碱式滴定管内,B项错;制取氯气必须用浓盐酸,1 mol·L-1的盐酸不能与二氧化锰反应,C项错;图4未形成闭合回路,D项错。
答案 A
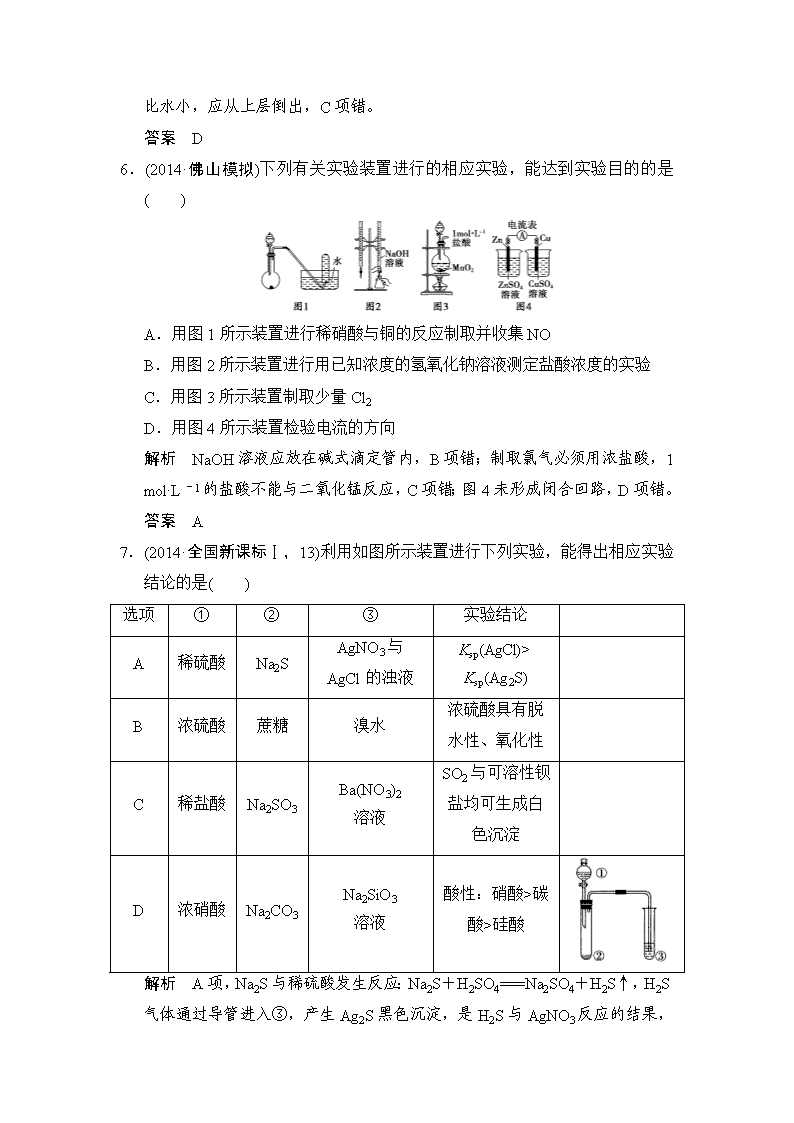
7.(2014·全国新课标Ⅰ,13)利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
A
稀硫酸
Na2S
AgNO3与
AgCl的浊液
Ksp(AgCl)>
Ksp(Ag2S)
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2
溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3
溶液
酸性:硝酸>碳酸>硅酸
解析 A项,Na2S与稀硫酸发生反应:Na2S+H2SO4===Na2SO4+H2S↑,H2S气体通过导管进入③,产生Ag2S黑色沉淀,是H2S与AgNO3
反应的结果,不能得出Ksp(AgCl)>Ksp(Ag2S),错误;B项,将浓H2SO4滴入蔗糖,蔗糖变黑,可以说明浓H2SO4具有脱水性,通过溴水褪色,说明浓H2SO4与生成的碳发生氧化还原反应生成了SO2,由此可以进一步证明浓H2SO4具有强氧化性,正确;C项,稀盐酸与Na2SO3发生反应:Na2SO3+2HCl===2NaCl+SO2↑+H2O,SO2与Ba(NO3)2溶液发生氧化还原反应生成BaSO4沉淀,若③中为BaCl2等可溶性钡盐,则不能生成沉淀,错误;D项,浓硝酸与Na2CO3发生反应:Na2CO3+2HNO3===2NaNO3+CO2↑+H2O,说明HNO3的酸性强于H2CO3;③中Na2SiO3溶液中产生白色沉淀,并不能据此证明H2CO3的酸性强于H2SiO3,其原因是浓硝酸具有易挥发性,挥发出的硝酸蒸气与CO2一并进入Na2SiO3溶液,且均能与其发生反应而产生H2SiO3沉淀。
答案 B
8.根据实验目的判断下列实验操作或装置正确的是( )
选项
A
B
C
D
目的
实验室制O2
配制稀硫酸溶液
在铁制品上镀铜
净化精制淀粉胶体
装置或操作
解析 A中长颈漏斗应插入液面以下,其目的是防止气体逸出;B中稀释浓H2SO4应在烧杯中进行;C中铁上镀铜时,Cu片应作阳极而待镀铁制品应作阴极。
答案 D
9.关于下列各装置图的叙述中,正确的是( )
解析 B项NaHCO3应在小内管内。C项NH4Cl分解产生的NH3、HCl在试管口又化合成NH4Cl,不能产生NH3。D项中温度计应测蒸气的温度,不能插入溶液中,另外,冷凝水的进水方向错。
答案 A
10.(2014·信阳模拟)下列实验能达到实验目的且符合安全要求的是( )
解析
向新制的硫酸亚铁溶液中滴加氢氧化钠溶液时会生成氢氧化亚铁沉淀,在溶液表面生成的氢氧化亚铁与空气接触,由白色沉淀迅速变成灰绿色沉淀,最终变成红褐色沉淀,这个过程变化很快,无法观察到白色沉淀的生成,不能达到实验目的。正确的操作是将装有氢氧化钠溶液的滴管插入新制硫酸亚铁溶液液面以下,滴加氢氧化钠溶液,A选项错误。氧气不易溶于水,可以用排水法收集,B选项正确。开始排出的氢气中混有空气,点燃后会发生爆炸,不符合实验安全要求。正确的操作是先检验氢气的纯度,后点燃,C选项错误。浓硫酸的密度大于水的密度,混合后放出大量的热,将水注入浓硫酸中,会造成液滴飞溅,不符合实验安全要求,正确的操作是将浓硫酸沿烧杯内壁缓缓注入水中,并不断搅拌,D选项错误。
答案 B
11.(2014·汕头模拟)下图所示的实验装置中,不能达到实验目的的是(双选)( )
A.装置①可制取少量蒸馏水
B.装置②可用于干燥、收集氨气,并吸收多余的氨气
C.装置③可用于排空气法收集H2、CO2、Cl2、HCl、NO等气体
D.装置④中X物质若为四氯化碳,则可用于吸收氨气或氯化氢
解析 B项中不能用CaCl2干燥NH3,二者易生成CaCl2·8NH3;C项中NO与O2易反应生成NO2,故应用排水法收集NO;D中由于NH3、HCl不溶于CCl4,气体通过CCl4后能均匀分散被H2O吸收,从而防止倒吸。
答案 BC
12.(2014·广州期末,23)下列实验装置图正确的是(双选)( )。
A.装置①可用于做HCl喷泉实验
B.装置②可用于吸收HCl气体,并防倒吸
C.装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2等气体
解析 HCl极易溶于水,因此装置①可用于做HCl喷泉实验,故A正确;装置②中水在下层,HCl溶于水,易发生倒吸,故B错误;CO2的密度比空气大,应用向上排空气法收集,故D错误。
答案 AC
13.(2014·广州增城期末,23)根据下列实验现象,所得结论正确的是(双选)( )。
实验
实验现象
结论
A
左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡
活动性:Al>Fe>Cu
B
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
白色固体先变为淡黄色,后变为黑色
溶解性:AgCl>AgBr>Ag2S
D
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
解析 A中形成的均是原电池,由金属性强的作负极可以判断,金属性:Al>Fe>Cu;B不对,该实验中Cl2分别与NaBr、KI反应,故不能判断Br2与I2的氧化性的强弱;C正确,根据沉淀的颜色变化可知发生了沉淀转化,可判断其Ksp大小顺序;D不对,HCl不是Cl元素最高价氧化物对应水化物的酸,不能得出非金属性:Cl>C的结论。
答案 AC,
[对点回扣]
1.实验操作中的数据
(1)酒精灯内酒精容量不超过其容积的,不少于。
(2)蒸发皿所盛液体量不超过其容积的。
(3)烧杯、烧瓶加热时所盛液体量应在到之间。
(4)试管在加热时,所盛液体不能超过试管容积的。
(5)试管在加热时,要与桌面成45度角。
(6)试管在加热时,试管夹应夹在离管口约处。
(7)测定晶体中结晶水含量时,最后两次称量值之差不超过0.1 g。
2.牢记常见的防倒吸装置
3.漏斗的类型与用途
漏斗
过滤或加注液体
长颈漏斗
与试管(或具支试管)、广口瓶等配合组装气体发生装置
分液漏斗
萃取、分液操作的仪器,与烧瓶、广口瓶等仪器配合组装气体发生装置
4.牢记常见仪器和装置使用时的注意事项
(1)几种定量仪器的精确度
滴定管的读数小数点后保留2位,量筒、托盘天平的读数保留小数点后1位,广泛pH试纸的读数为整数。
(2)使用前需检漏的仪器:分液漏斗、滴定管、容量瓶。
(3)气体制备、性质实验的组合装置,在添加药品前要检查气密性。
5.容易忽视的4个实验安全问题:
(1)有毒气体的尾气必须处理。通常将H2S、SO2、Cl2、NO2等气体用水或NaOH溶液吸收。
(2)易爆气体如H2、CO、CH4、C2H4、C2H2等在点燃之前必须要验纯。
(3)用H2、CO还原CuO、Fe2O3等实验时,应先通气,等体系内的空气排尽后再加热,若先加热后通气可能会发生爆炸事故。
(4)加热制取的气体用排水法收集完毕,应先将导气管移出水面,再熄灭酒精灯,防止水倒吸入发生装置而使发生装置破裂。
6.气体干燥剂的选择
(1)酸性干燥剂,如浓硫酸、五氧化二磷等,酸性干燥剂能够干燥酸性或中性气体,如能干燥CO2、SO2、NO2、HCl、H2、Cl2、O2、CH4等;
(2)碱性干燥剂,如生石灰、碱石灰、固体NaOH等,碱性干燥剂可以用来干燥碱性或中性气体,如能干燥NH3、H2、O2、CH4等;
(3)中性干燥剂,如无水氯化钙等,中性干燥剂可以干燥中性、酸性和碱性气体,如能干燥O2、H2、CH4等,注意:氯化钙不能干燥NH3。
7.一种判断
淀粉水解程度判断
(1)实验操作
(2)实验结论
现象A
现象B
结论
①
未出现银镜
溶液变蓝色
淀粉尚未水解
②
出现银镜
溶液变蓝色
淀粉部分水解
③
出现银镜
溶液不变蓝色
淀粉完全水解