- 3.80 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年高考模拟试卷理科综合化学部分
考试时间:理综150分钟 满分:100分
(相对原子量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 K 39 Si 28 Fe 56 S 32 P 31)选择题部分共7小题,每小题6分,共42分。
7.下列说法不正确的是 ( )
A、硝化甘油在体内能够分解出NO,少量的NO会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛。
B、TNT爆炸的方程式为:2C7H5N3O6(s)→6CO2(g)+5H2(g) +3N2(g) +8C(s),,因而爆炸过程会产生大量的黑烟
C、为迎接G20峰会,全市努力植树造林,节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物
D、用中子轰击Hg核能发生下面的反应:80196Hg+ 01n → 80197Hg→79197Au + e+ 制得金核,这个过程不属于化学变化。
8.下列说法正确的是 ( )
A. 除去NaCl中少量的KNO3,可将固体混合物制成热饱和溶液,冷却结晶、过滤
B. 探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生浑浊的快慢,来反映试剂反应速率的大小。从而探究浓度,温度等外界条件对该反应的化学反应速率的影响。
C. 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行
D. 为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法
X
W
Y
Z
9.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,X与Z形成的化合物常用于漂白纸张。下列说法正确的是 ( )
A.X元素形成的氢化物液态比固态的密度小
B.四种元素行成的简单离子半径从大小的排列顺序Y>Z>X>W
C.常温下,Y形成的简单离子和W形成的简单离子在水溶液中可以大量共存
D.Y常用于冶炼难熔的金属
10.下列说法正确的是: ( )
A. 屠呦呦女士通过研究青蒿素获得了“诺贝尔医学奖”以表彰她对疟疾治疗所做的贡献。那么青蒿素的结构式为,分子式为C15H20O5
B.向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同
C.淀粉,纤维素,油脂均能发生水解,同时它们都是高分子化合物
D. 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
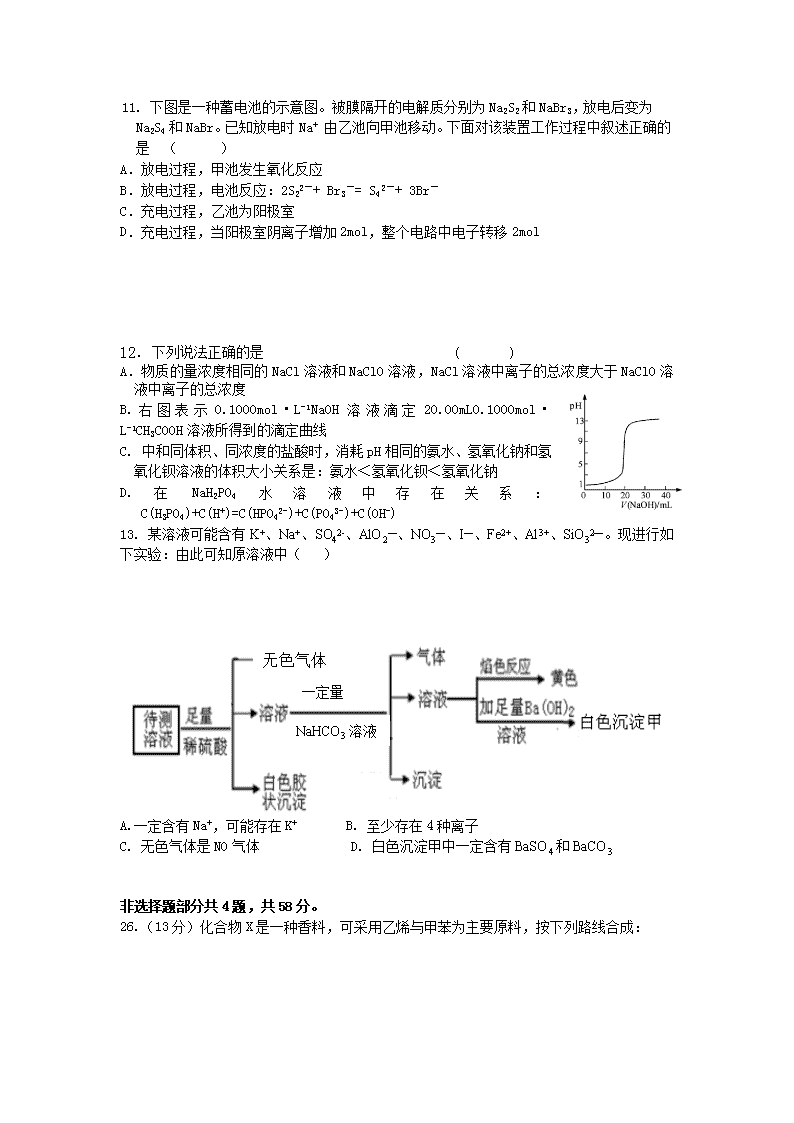
11. 下图是一种蓄电池的示意图。被膜隔开的电解质分别为Na2S2和NaBr3,放电后变为Na2S4和NaBr。已知放电时Na+ 由乙池向甲池移动。下面对该装置工作过程中叙述正确的是 ( )
A.放电过程,甲池发生氧化反应
B.放电过程,电池反应:2S22-+ Br3-= S42-+ 3Br-
C.充电过程,乙池为阳极室
D.充电过程,当阳极室阴离子增加2mol,整个电路中电子转移2mol
12.下列说法正确的是 ( )
A.物质的量浓度相同的NaCl溶液和NaClO溶液,NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度
B.右图表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线
C. 中和同体积、同浓度的盐酸时,消耗pH相同的氨水、氢氧化钠和氢氧化钡溶液的体积大小关系是:氨水<氢氧化钡<氢氧化钠
D.在NaH2PO4水溶液中存在关系:C(H3PO4)+C(H+)=C(HPO42-)+C(PO43-)+C(OH-)
13. 某溶液可能含有K+、Na+、SO42-、AlO2—、NO3—、I—、Fe2+、Al3+、SiO32—。现进行如下实验:由此可知原溶液中( )
无色气体
NaHCO3溶液
一定量
A.一定含有Na+,可能存在K+ B. 至少存在4种离子
C. 无色气体是NO气体 D. 白色沉淀甲中一定含有BaSO4和BaCO3
非选择题部分共4题,共58分。
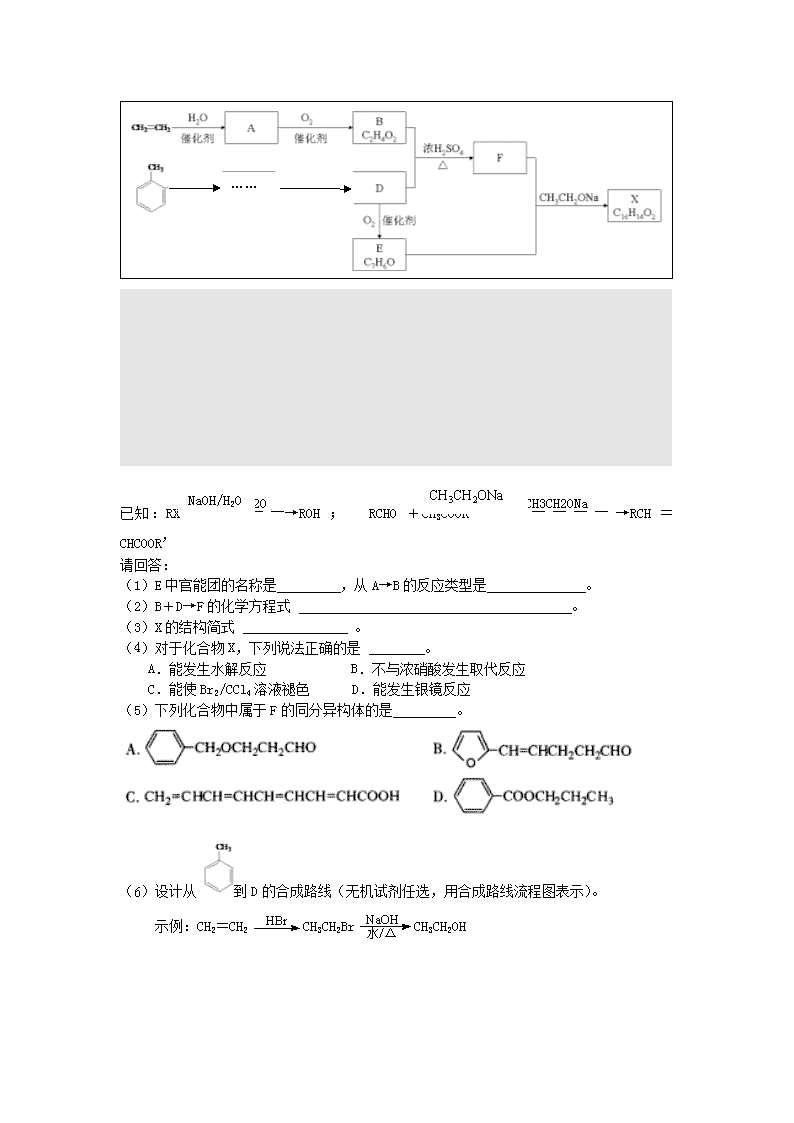
26.(13分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
……
CH3CH2ONa
NaOH/H2O
已知:RXROH; RCHO+CH3COOR’RCH=CHCOOR’
请回答:
(1)E中官能团的名称是 ,从A→B的反应类型是 。
(2)B+D→F的化学方程式 。
(3)X的结构简式 。
(4)对于化合物X,下列说法正确的是 。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是 。
(6)设计从到D的合成路线(无机试剂任选,用合成路线流程图表示)。
示例:CH2=CH2CH3CH2BrCH3CH2OH
27.(14分)某无机化合物A是一种正盐,A与氢氧化钠浓溶液反应,产生无色气体B,B气体可以使湿润的红色石蕊试纸变为蓝色;A与稀硫酸溶液反应,产生无色气体C,C气体可以使品红溶液褪色。请回答下列问题:
(1)B气体的电子式 ;C气体的化学式是 。
(2)化合物A受热容易分解,写出A受热分解的化学反应方程式: 。
(3)工业排放的C气体会污染环境,通常用过量的B的水溶液吸收,请写出相关的离子方程式: 。
(4)利用互补金属氧化物半导体与气体接触时电阻或功函数发生变化的这一特性,可以制成气体传感器,用来检测各种气体。其中Fe2O3系传感器可以检测B气体,反应时,铁的氧化物转化为低价态氧化物,同时有单质气体生成。写出该反应的化学方程式: 。
(5)将B气体和氧气按一定比例混合,置于密闭容器中,里面连接铂丝,通过尖端间歇性放电,混合气体完全反应,只得到一种正盐D的水溶液。那么D的化学式是 ,原混合气体中,B气体和氧气的体积比是 。
28.(15分)碳是一种生命元素,碳元素的循环对地球环境,从中衍生出来的CO2可以有许多用途。回答下面问题:
Ⅰ(1)已知温度为T时:
CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41KJ•mol
电解得到的CO、H2在合适催化剂的作用下可以合成CH4的反应,温度为T时,该反应的热化学方程式为_____ 。
(2)在固态金属氧化物电解池中,高温电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。请问:X是电源的(填正极或负极) ;写出生成H2的电极反应式: 。
Ⅱ以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应(均自发进行)可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s); ΔH1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(l); ΔH2
反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g); ΔH3
已知:H2O(g) H2O(l) ; ΔH4
请回答下列问题:
(1)反应Ⅰ的ΔH1=__________(用其他ΔH表示)。
(2)反应Ⅱ的ΔS______0 (填“>”、“=”或“<”) 。
(3)某研究小组为探究反应Ⅲ影响CO2转化率的因素,在其它条件一定时,图1为CO2转化率受温度变化影响的曲线,图2是按不同氨碳比 [n(NH3)/n(CO2)]投料时CO2平衡转化率的变化曲线。
图1 图2
当温度高于T℃后,CO2转化率变化趋势如图1所示,其原因是____ ______。
(4)在某恒定温度下,将NH3和CO2物质的量之比按2:1充入一体积为10 L的密闭容器中(假设容器体积不变,生成物的体积忽略不计且只发生反应Ⅰ),经15 min达到平衡,各物质浓度的变化曲线如下图所示。
①在上述条件下,反应Ⅰ的平衡常数的值为______________。
②若保持平衡的温度和体积不变,25 min时再向该容器中充入2 mol NH3和1 mol CO2,在40 min时重新达到平衡,请在上图中画出25~50 min内CO2的浓度变化趋势曲线。
29.(16分)随着手机、手提电脑、数码相机等电器的普及,锂电池的生产量和消费量大。造成资源短缺,钴的毒性又很大。因此,回收锂电池既有较大的经济价值,又有益于保护生态环境。某课题小组提出如下方案对某钴酸锂正极材料(主要含LiCoO2、铝箔、性质稳定的导电剂等)进行回收钴等金属。
已知:金属氢氧化物沉淀的pH值
金属氢氧化物
金属离子浓度
金属离子浓度
沉淀完全时的pH值
1mol·L—1
0.1mol·L—1
分子式
Ksp
开始沉淀时的pH
Fe(OH)2
4.87×10-17
5.8
6.3
8.3
Fe(OH)3
2.79×10-39
1.2
1.5
2.8
Co(OH)2
5.92×10-15
6.9
7.4
9.4
回答下列问题:
(1)写出钴酸锂正极材料用加5%氢氧化钠溶液,发生的离子反应方程式
(2)操作1所用到的玻璃仪器除烧杯、漏斗外,还必须有 (填仪器名称)。
(3)滤液4到沉淀2可以选择抽滤,抽滤不仅能加快过滤速度,而且能得到比较干燥的晶体。但是,太细的晶体不适合于抽滤。一般情况下,下列哪些因素有利于得到较大的晶体____。(填写序号)
A.缓慢冷却溶液 B.溶质溶解度较小
C.缓慢蒸发溶剂 D.溶液浓度较高
(4)该课题组同学将滤渣1酸浸溶解得到Co2+用盐酸进行溶解。发生如下反应:
在此反应中,体现了盐酸的 性。
指导老师建议采用稀硫酸和H2O2溶液溶解,发生如下反应:
LiCoO2+ + H2O2= Co2++ O2↑+ Li++
在上述方程式的 中填上缺少的微粒,并进行配平。
你认为指导老师提出该建议的主要依据是
(5)试剂a最好选用下列试剂中的
A.NaOH溶液 B.(NH4)2CO3溶液 C.NH4HCO3
(6)沉淀2的化学式是 。
2019年高考模拟试卷理科综合化学部分参考答案与评分标准
选择题部分共7小题,每小题6分,共42分。
7
8
9
10
11
12
13
C
B
D
D
B
A
C
非选择题部分共4题,共58分。
26.(共13分)
(1)醛基…………………(1分)氧化反应 …………………(1分)
(2) …………(2分)
(3) …………………(2分)
(4)AC ……………………………………(2分,少选得1分,错选或多选不得分)
(5)BC ……………………………………(2分,少选得1分,错选或多选不得分)
(6)…………………(3分)
27.(共14分)
(1) …………………(2分);SO2 …………………(2分);
(2)(NH4)2SO3 === NH3↑+ SO2↑+ H2O …………………(2分)
(3)SO2 + 2NH3·H2O === 2NH4++SO32—+ H2O ………………… (2分)
(4)3Fe2O3 + 2NH3 === 6FeO + N2 + 3H2O …………………(2分)
(5)NH4NO3 …………………(2分);1∶1 …………………(2分)
28.(15分)
Ⅰ(1)CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H=-206kJ•mol‾1…………………(2分)
(2)X是电源的负极…………(1分);电极反应式是: CO2+2eˉ=CO+O2ˉ(2分)
Ⅱ(1)△H3+△H4-△H2…………………(2分)
(2)>…………(1分)
(3)温度高于T℃时,因为反应Ⅲ为自发反应,△S<0,则反应ΔH3<0,是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低…………(2分)
(4)①250…………(2分)
②如下图(3分)
29. (共16分)
(1)2Al+2OH—+2H2O=2AlO2—+3H2↑………………………(2分)
(2) 玻璃棒………(1分)
(3) AC…………(2分,少选得1分,错选或多选不得分)
H2O
(4)酸性和还原性………(2分,少写不得分)
H+
2 LiCoO2+ 6 + 1 H2O2= 2 Co2++ 1 O2↑+ 2 Li++ 4 (3分)
用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦。………(2分)
(5)C ……………………………………………………………(2分)
(6)Co(OH)2 …………………………………………………… (2分)