- 395.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学试卷分类汇总(概念题)
2000年
四、(本题共28分)
23.KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:
_____KClO3+___HCl(浓)¾®___KCl+___ClO2+___Cl2+___ _____
(1)请完成该化学方程式并配平(未知物化学式和系数填入横线上)。
(2)浓盐酸在反应中显示出来的性质是_____
① 只有还原性 ② 还原性和酸性 ③ 只有氧化性 ④ 氧化性和酸性
(3)产生0.1 mol Cl2,则转移的电子的物质的是为_____mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_____倍。
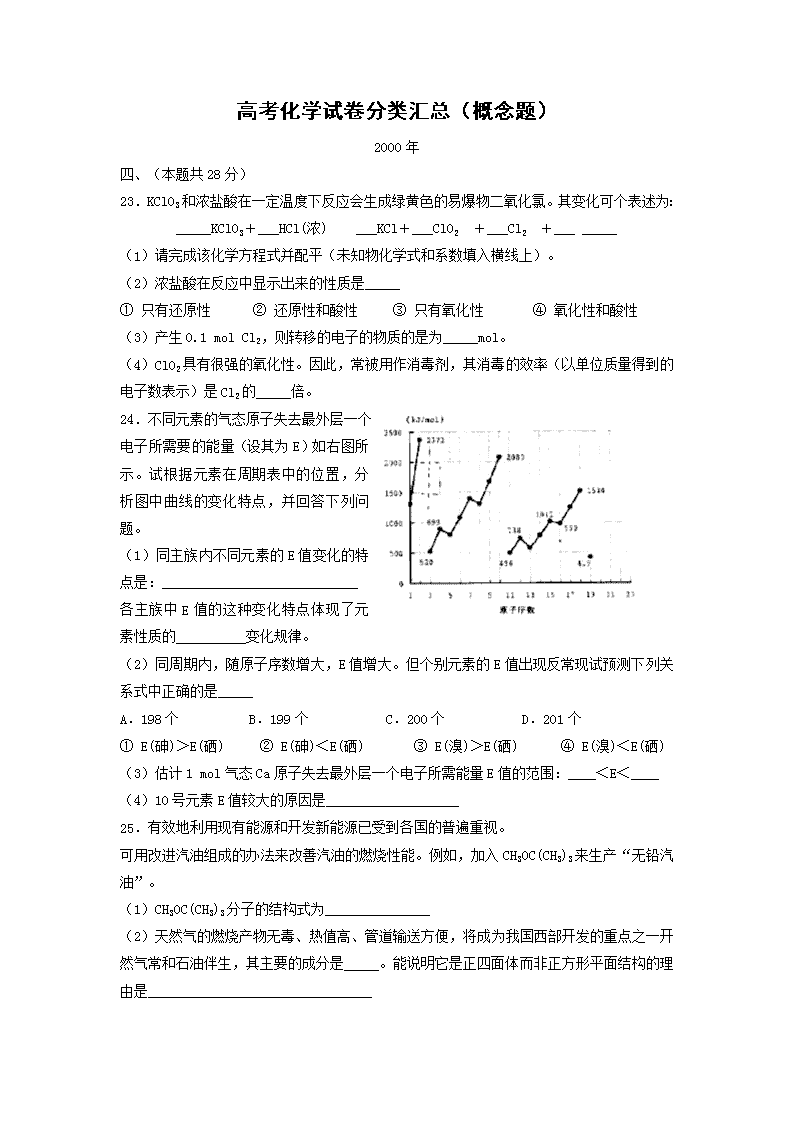
24.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:____________________________
各主族中E值的这种变化特点体现了元素性质的__________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现试预测下列关系式中正确的是_____
A.198个 B.199个 C.200个 D.201个
① E(砷)>E(硒) ② E(砷)<E(硒) ③ E(溴)>E(硒) ④ E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:____<E<____
(4)10号元素E值较大的原因是___________________
25.有效地利用现有能源和开发新能源已受到各国的普遍重视。
可用改进汽油组成的办法来改善汽油的燃烧性能。例如,加入CH3OC(CH3)3来生产“无铅汽油”。
(1)CH3OC(CH3)3分子的结构式为_______________
(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一开然气常和石油伴生,其主要的成分是_____。能说明它是正四面体而非正方形平面结构的理由是________________________________
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50公里/小时行驶了40公里。为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济的制氢方法是_____
① 电解水 ② 锌和稀硫酸反应 ③ 光解海水
其次,制得纯氢气后还需要解决的问题是_____________________
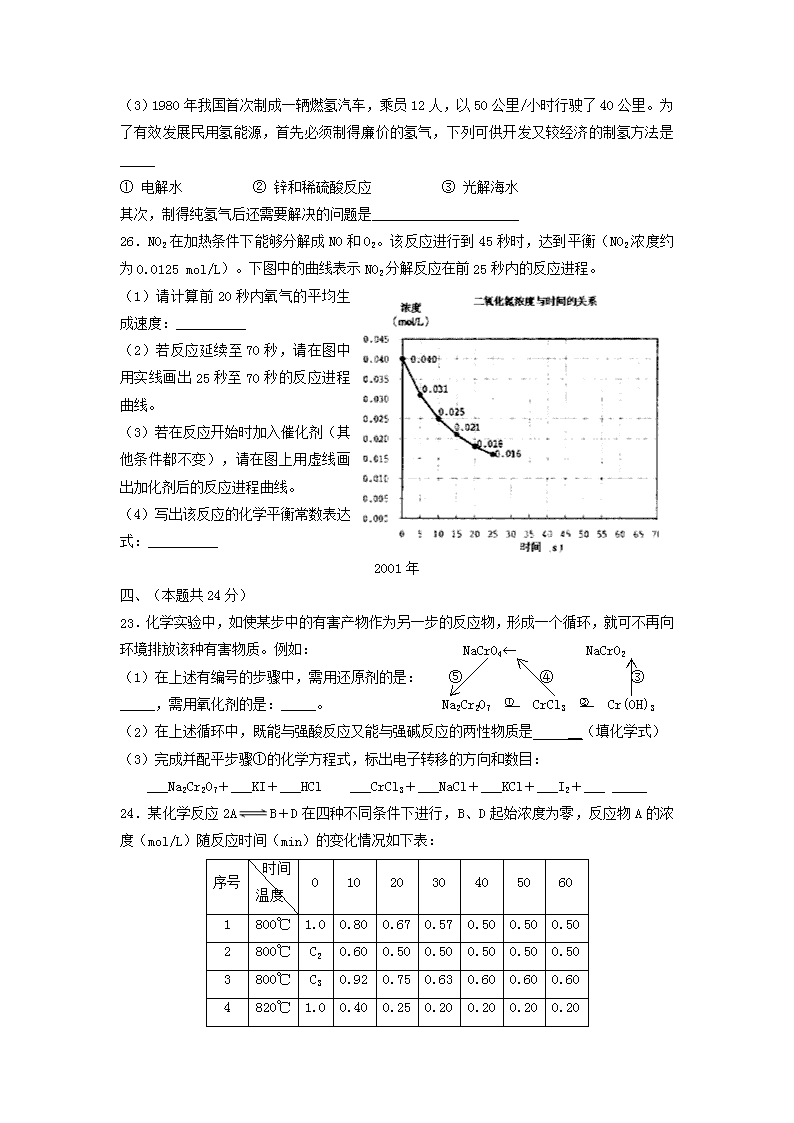
26.NO2在加热条件下能够分解成NO和O2。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125 mol/L)。下图中的曲线表示NO2分解反应在前25秒内的反应进程。
(1)请计算前20秒内氧气的平均生成速度:__________
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式:__________
2001年
四、(本题共24分)
23.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: NaCrO4¬¾¾¾¾¾NaCrO2
(1)在上述有编号的步骤中,需用还原剂的是: ⑤ ④ ③
_____,需用氧化剂的是:_____。 Na2Cr2O7¾① ®CrCl3¾② ®Cr(OH)3
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 __(填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
___Na2Cr2O7+___KI+___HCl¾®___CrCl3+___NaCl+___KCl+___I2+___ _____
24.某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
序号
时间
温度
0
10
20
30
40
50
60
1
800℃
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800℃
C2
0.60
0.50
0.50
0.50
0.50
0.50
3
800℃
C3
0.92
0.75
0.63
0.60
0.60
0.60
4
820℃
1.0
0.40
0.25
0.20
0.20
0.20
0.20
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内,用A物质浓度的变化表示的平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度C2=_____mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是__________________
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3_____V1(填:>、=、<),且C3_____1.0 mol/L(填:>、=、<)。
(4)比较实验4和实验1,可推测该反应是_____反应(填:吸热、放热)。理由是_______________
25.请阅读下列信息:
在含羰基(-C=O)的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮。
当两个烃基都是脂肪烃基时,叫脂肪酮,如甲基酮R-C=O;
都是芳香烃基时,叫芳香酮; CH3
如两个烃基是相互连接的闭合环状结构时,叫环酮,如环己酮 =O。
像醛一样,酮也是一类化学性质活泼的化合物,如羰基也能进行加成反应。加成时试剂的带负电部分先进攻羰基中带正电的碳,而后试剂中带正电部分加到羰基带负电的氧上,这类加成反应叫亲核加成。
但酮羰基的活泼性比醛羰基稍差,不能被弱氧化剂氧化。
许多酮都是重要的化工原料和优良溶剂,一些脂环酮还是名贵香料。
试回答:
(1)写出甲基酮与氢氰酸(HCN)反应的化学方程式_____________________________
(2)下列化合物中不能和银氨溶液发生反应的是_____
(a)HCHO (b)HCOOH (c)(CH3)2CO (d)HCOOCH3
CH-(CH2)6-CH2
(3)有一种名贵香料一灵猫香酮CH-(CH2)7-C=O是属于_____
(a)脂肪酮 (b)脂环酮 (c)芳香酮
(4)樟脑也是一种重要的酮, 它不仅是一种家用杀虫剂,且是香料、塑料、医药工业重要原料,它的分子式为__________
2002年
四、(本题共24分)
23.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2¾®KOCN+2KCl+H2O。被氧化的元素是_____
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
___KOCN+___KOH+___Cl2¾®___CO2+___N2+___KCl+___H2O
(3)若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯_____g。
t℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
24.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表。
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________
(2)该反应为__________(填:吸热、放热)反应。
(3)能判断该反应是否达到化学平衡状态的依据是_____
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
25.致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:_____>_____>H2O、HF;SiH4>PH3>_____>_____。
(2)化合物的毒性:PH3>NH3;H2S_____H2O;CS2_____CO2;CCl4_____CF4。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似的还可以是____________________
(4)然而,这种致冷剂造成了当今的某一环境问题是______________________________
但求助于周期表中元素及其化合物的__________变化趋势来开发致冷剂的科学思维方法是值得借鉴的。
① 毒性 ② 沸点 ③ 易燃性 ④ 水溶性 ⑤ 颜色
(a)①②③ (b)②④⑤ (c)②③④
2003年
四、(本题共24分)
23.钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l)NaCl(l)+K(g)一Q
压强(kPa)
K的沸点(℃)
Na的沸点(℃)
KCl的沸点(℃)
NaCl的沸点(℃)
13.33
590
700
53.32
710
830
101.3
770
890
1437
1465
该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见上表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为__________,而反应的最高温度应低于__________
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是_______________
B
H
J
A
C
F
I
L
M
E
G
D
K
(3)常压下,当反应温度升高900℃时,该反应的平衡常数可表示为:K=__________
24.右表是元素周期表一部分。
表中所列的字母分别代表某一
化学元素。
(1)下列_____组元素的单质
可能都是电的良导体。
① A、C、H ② B、G、K ③ C、H、L ④ D、E、F
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ/mol):
失去第一个电子
失去第二个电子
失去第三个电子
失去第四个电子
锂
519
7296
11799
X
502
4570
6920
9550
Y
580
1820
2750
11600
① 通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。_____________________________________________
② 表中X可能为以上13种元素中的_____(填写字母)元素。用元素符号表示X和J形成化合物的化学式____
③ Y是周期表中_____族元素。
④ 以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。
24.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg¾®Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显_____价。
(2)以上反应中的氧化剂为_____,当有1 mol CuI参与反应时,转移电子_____mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
___Cu2++___I-¾®___CuI+___
2004年
23.某化学反应的反应物和产物如下:
KMnO4+KI+H2SO4¾®MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是__________
(2)如果该反应方程式中I2和KIO3的系数都是5
① KMnO4的系数是_____
② 在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 ¾®
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是:______________________
24.在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)2SO3(g)+Q(Q>0)
(1)写出该反应的化学平衡常数表达式K=__________
(2)降低温度,该反应K值__________,二氧化硫转化率_____,化学反应速度_____(均填:增大、减小、不变)。
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是__________
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是_____________________
10 min到15 min的曲线变化的原因可能是_____
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
25.右表是元素周期表的一部分。
(1)表中元素 ⑩ 的氢化物的化学式
为_____,此氢化物的还原性比元素 ⑨
的氢化物的还原性_____(填:强、弱)。
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是_____,其单质的电子式为__________。
(3)俗称为“矾”的一类化合物通常含有共同的元素是__________
(4)已知某些不同族元素的性质也有一定的相似性,如元素 ③ 与元素 ⑧ 的氢氧化物有相似的性质。写出元素 ③ 的氢氧化物与NaOH溶液反应的化学方程式:
____________________________________________
又如表中与元素 ⑦ 的性质相似的不同族元素是_____(填元素符号)。
2005年
四、(本题共24分)
23.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2¾®O2。
(1)该反应中的还原剂是__________
(2)该反应中,发生还原反应的过程是__________¾®__________
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________________
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为_____
24.(A)
(1)在上面元素周期表中画出
金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提
议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的_____族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是_____(填名称),
A
B
C
D
写出可以验证该结论的一个化学反应方程式______________________
24.(B)
(1)在上面元素周期表中全部
是金属元素的区域为_____
(a)A (b)B
(c)C (d)D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是_____
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是_____(填名称),可以验证该结论的实验是_____
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
25.在某一容积为2L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)2HI(g)+Q(Q>0)
反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为_______________
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为__________
(3)反应达到平衡后,第8分钟时:
① 若升高温度,化学平衡常数K__________(填:增大、减小、不变),HI浓度的变化正确_____(用图2中a~c的编号回答);
② 若加入I2,H2浓度的变化正确的是_____(用图2中d~f的编号回答)。
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
2006年
四、(本题共24分)
23.(A)
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:_____>_____
甲、乙的最高价氧化物水化物的酸性强弱为:__________>__________(用化学式表示)
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的______,请写出元素在元素周期表中的位置与元素原子结构的关系:________________________
23.(B)下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
(1)请在下表中用实线补全元素周期表边界。
(2)元素 ⑤ 的原子核外p电子数比s电子总数多_____个。
元素 ③ 氢化物的电子式为__________
(3)元素 ④ —般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素 ① 的单质、元素 ② 的单质和元素 ① ② 形成的合金这三种物质中,熔点最低的是_____
a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断
24.(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
__________+__________¾®__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_____
(3)反应中1 mol氧化剂_____(填:得到、失去)_____mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
__________+__________¾®
25.(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______________,K值大小与温度的关系是:温度升高,K值__________(填:增大、减小、不一定)。
(2)在一体积为10 L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)CO2(g)+H2(g)+Q(Q>0)
CO和H2O浓度变化如下图,则 0-4 min的平均反应速率v(CO)=______ mol/(L·min)
(3)t℃(t>850)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
① 表中3 min-4 min之间反应处于__________状态;
C1数值_________0.08 mol/L (填大于、小于或等于)。
② 反应在4 min-5 min问,平衡向逆方向移动,可能的原因是_____,
表中5 min-6 min之间数值发生变化,可能的原因是_____。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
2007年
四、(本题共24分)
23.(A)现有部分短周期元素的性质或原子结构如下表:
元素编号
元素性质或原子结构
T
M层上有2对成对电子
X
最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
元素最高正价是+7价
(1)元素T的原子最外层共有_____种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是_____(用元素符号表示,下同)。
(2)元素Y与氢元素形成一种离子,写出该微粒的电子式
(3)元素Z与元素T相比,非金属性较强的是_____,下列表述中能证明这一事实的是_____
A.常温下Z的单质和T的单质状态不同 B.Z的氢化物比T的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是__________,理由是______________ ______________________________________________
(B)现有部分短周期元素的性质或原子结构如下表:
元素编号
元素性质或原子结构
T
单质能与水剧烈反应,所得溶液呈弱酸性
X
L层p电子数比s电子数多2个
Y
第三周期元素的简单离子中半径最小
Z
L层有三个未成对电子
(1)写出元素X的离子结构示意图__________
写出元素Z的气态氢化物的电子式__________(用元素符号表示,下同)。
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是_____,下列表述中能证明这一事实的是_____
A.常温下氯气的颜色比T单质的颜色深 C.氯与T形成的化合物中氯元素呈正价态
B.T的单质通入氯化钠水溶液不能置换出氯气
(4)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是_____,理由__________________________________
24.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
+4H++3e¾®NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:______________________________________
(2)反应中硝酸体现了_____、_____性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是_____mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:_________
25.一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=_________,升高温度,K值_____(填:增大、减小、不变)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=__________
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____
A.氢气的浓度减少 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_______________________________(用化学方程式表示)。
2008年
四、(本题共24分)
23.某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内。
Au2O3+__________+__________¾®__________+__________+__________
(2)反应中,被还原的元素是_____,还原剂是__________
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
__________+__________+……
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为_____
24.在2 L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.01.
0.008
0.007
0.007
0.007
(1)写出该反应的平衡常数表达式:K=__________
已知:K300℃>K350℃,则该改反应是_____热反应。
(2)右图中表示NO2的变化的曲线是_____
用O2表示从0~2s内该反应的平均速率v=__________
(3)能说明该反应已达到平衡状态的是_____
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
25.(A)四种短周期元素的性质或结构信息如下表。氢根据信息回答下列问题。
元素
A
B
C
D
性质
结构
信息
室温下单质呈粉末状固体,加热易熔化。
单质在空气中燃烧,发出明亮的蓝紫色火焰。
单质常温、常压下是气体,能溶于水。
原子的M层有1个未成对的p电子。
单质质软、银白色固体、导电性强。
单质在空气中燃烧发出黄色的火焰。
原子最外层电子层上s电子数等于p电子数。
单质为空间网状晶体,具有很高的熔、沸点。
(1)B元素在周期表中的位置_______________,写出A原子的电子排布式__________
(2)写出C单质与水反应的化学方程式_________________________________________
A与C形成的化合物溶于水后,溶液的pH_____7(填:大于、等于、小于)。
(3)D元素最高价氧化物晶体的硬度_____(填:大、小),其理由是____________
(4)A、B两元素非金属性较强的是(写元素符号)_____。写出证明这一结论的一个实验事实________________________________________
25.(B)元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
元素
A
B
C
D
性质
结构
信息
单质制成的高压灯,发出的黄光透雾力强、射程远。
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。
单质常温、常压下是气体,原子的L层有一个未成对的p电子。
+2价阳离子的核外电子排布与氖原子相同。
(1)上表中与A属于同一周期的元素是_____,写出D离子的电子排布式__________
(2)D和C形成的化合物属于_____晶体。
写出C单质与水反应的化学方程式_____________________________________________
(3)对元素B的单质或化合物描述正确的是_____
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应
(4)A和D量元素金属性较强的是(写元素符号)_____。写出能证明该结论的一个实验事实 _____________________
2009年
四、(本题共24分)
23.海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
① Cl2¾®Cl+Cl ② Cl+H2¾®HCl+H ③ H+Cl2¾®HCl+Cl ……
反应 ② 中形成的化合物的电子式为__________;反应③中被破坏的化学键属于_______键(填:极性、非极性)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是______(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第_____周期_____族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是_____
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
________________________________________________________________________________________________________
键能kJ/mol
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 250
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(4)卤素单质的键能大小如右图。由图推断: 100
① 非金属性强的卤素,其单质分子的化学键__________ 50
断裂(填:容易、不容易、不一定容易)。 F-F Cl-Cl Br-Br I-I
② 卤素单质键能大小与键长的关系为:_________________________________________
24.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO3、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为 _____
(3)根据上述反应可推知_____
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目: +
25.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3+3CO(g)2Fe+3CO2(g)
① 该反应的平衡常数表达式为:K=_______________
② 该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为__________
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
① _________________________________;②_________________________________。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是_____
v v v v
a. T b. T c. T d. T
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:____________________________欲使上述体系中Al3+浓度增加,可加入的物质是__________
2010年
四、(本题共24分)
23.胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。
(1)三硅酸镁的氧化物形式为_______________,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为__________
(2)铝元素的原子核外共有__ 种不同运动状态的电子、_____种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径_____(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:________________________________________
(4)Al2O3、MgO和SiO2都可以制耐火材料, 其原因是_____
a.Al2O3、MgO和SiO2都不溶于水 b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物 d.Al2O3、MgO和SiO2都有很高的熔点
24.向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
___ __________+___ __________+___ __________¾®___ HIO3+___ __________
(2)整个过程中的还原剂是____________________
(3)把KI换成KBr,则CCl4层变为_____色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HbrO3氧化性由强到弱的顺序是_______________
(4)加碘盐中含碘量为20 mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若KI与Cl2反应制KIO3,至少需要消耗Cl2__________L(标准状况,保留2位小数)。
25.接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)2SO3+190 kJ
(1)该反应所用的催化剂是___________(填写化合物名称),该反应450℃时的平衡常数__________500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是_____________________________________________
(3)下列描述中能说明上述反应已达到平衡的是_____
a.v(O2)正=2v(SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=_____mol/L.min:若继续通入0.20 mol SO2和0.10 mol O2,则平衡_______________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,__________mol<n(SO3)<__________mol。
Tes oon
天/星教育/网
天.星教.育网
相关文档
- 安徽专用版高考化学 课时提能演练2021-05-138页
- 2014年版高考物理二模试题目天津市2021-05-137页
- 高考数学试题3函数与导数试题2021-05-1331页
- 高考物理一轮练习知能演练实验十六2021-05-135页
- 2014年版高考英语完形填空二轮突破2021-05-1312页
- 2019高考物理一轮复习 第五章 第72021-05-132页
- 2008江苏省高考语文附加题汇总2021-05-1310页
- 高考经济生活部分试题汇编ljt2021-05-1325页
- 高考英语短文改错专项训练含答案wo2021-05-1317页
- 2020版高考生物二轮复习 高考重点2021-05-134页