- 1.15 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2016年高考化学真题分类解析
[题型一] 化学实验综合大题
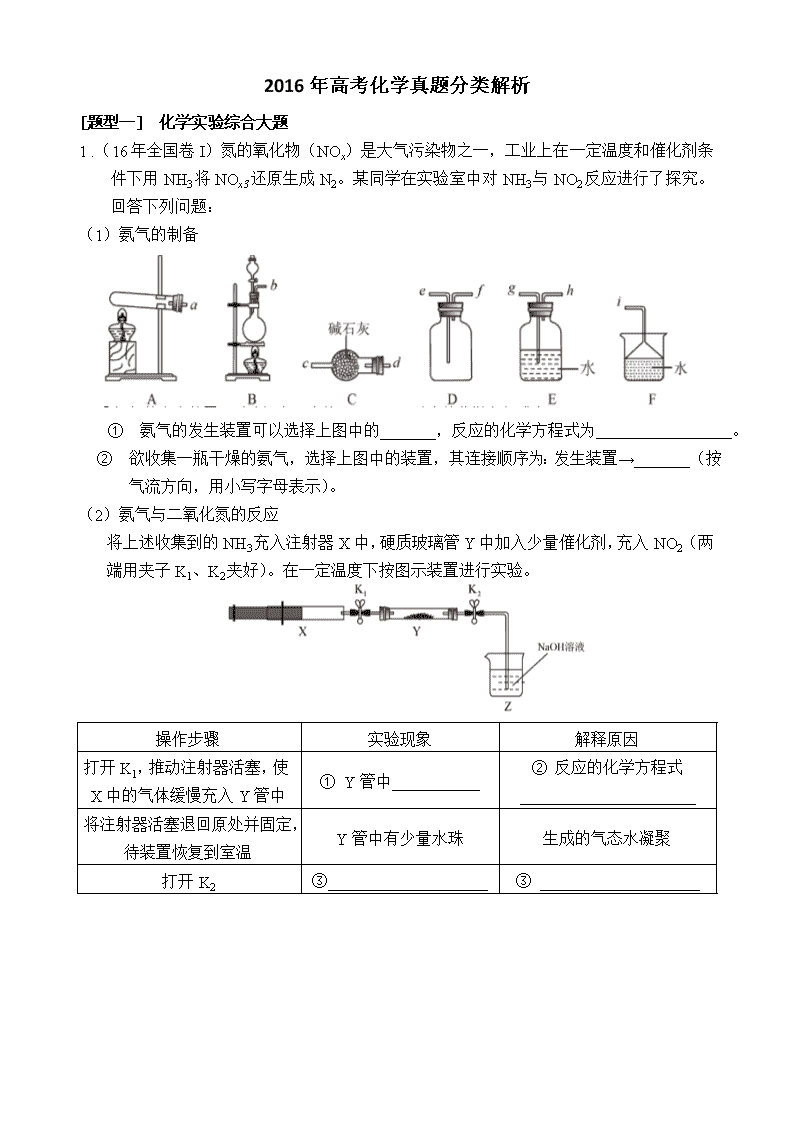
1 .(16年全国卷I)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx3还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
① 氨气的发生装置可以选择上图中的 _______,反应的化学方程式为 。
② 欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
操作步骤
实验现象
解释原因
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中
① Y管中___________
② 反应的化学方程式
______________________
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝聚
打开K2
③____________________
③ ____________________
2 .(16年全国卷II)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用
是_____________。
(4)丙组同学取10 ml 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取
2 mL 此溶液于3支试管中进行如下实验:
① 第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
② 第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为_______。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是______________________,生成沉淀的原因是__________________________(用平衡移动原理解释)。
【答案】
3 .(16年全国卷III)
过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
(1)步骤①加入氨水的目的是 。小火煮沸的作用是使沉淀颗粒长大,
有利于___ 。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二) 过氧化钙的制备
CaCO3滤液白色晶体
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为 ,该反应需要在冰浴下进行,原因是 。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是 ,产品的缺点是 。
【答案】
4、(2016年 北京卷)以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验
试剂
现象
滴管
试管
2 mL
0.2 mol·L−1 Na2SO3溶液
饱和Ag2SO4溶液
Ⅰ.产生白色沉淀
0.2 mol·L−1 CuSO4
Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀
0.1 mol·L−1 Al2(SO4)3溶液
Ⅲ.开始无明显变化,继续滴加产生白色沉淀
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42−,含有Cu+、Cu2+和SO32−。
已知:Cu+Cu +Cu2+,Cu2+CuI↓(白色)+I2。
① 用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
① 通过下列实验证实,沉淀中含有Cu2+和SO32−。
②
a. 白色沉淀A是BaSO4,试剂1是____________。
b. 证实沉淀中含有Cu+和SO32−的理由是 。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42−,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
① 推测沉淀中含有亚硫酸根和________。
② 对于沉淀中亚硫酸根的存在形式提出两种假设:
i. 被Al(OH)3所吸附;
ii. 存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a. 将对比实验方案补充完整。
步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与________有关。
5、(2016 江苏卷)过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2OCaO2·8H2O
反应时通常加入过量的Ca(OH)2,其目的是_____________。
(2) 向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有_____
(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
(3) 水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2MnO(OH)2 I2 S4O62-
① 写出O2将Mn2+氧化成MnO(OH)2的离子方程式: 。
② 取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧, 消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L-1表示),写出计算过程。
5、(2016 江苏卷选做)焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
当溶液pH约为4时,停止反应。在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3=Na2S2O5+H2O
(1) SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃-30℃干燥,可获得Na2S2O5固体。
① 组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
② 依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是_________________。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是______。
6、(2106上海卷)乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
完成下列填空:
(1).实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________ ;浓硫酸用量又不能过多,原因是____________ 。
(2).饱和Na2CO3溶液的作用是_______________ 。
(3).反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4).若用b装置制备乙酸乙酯,其缺点有__________ 、__________ 。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
【答案】
(1)增大反应物浓度,使平衡向生成酯的方向移动,提高脂的产率。(合理即给分)
浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率。
浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率。
(2)中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解
(3)振荡、静置
(4)原料损失较大、易发生副反应 乙醚;蒸馏
7、(2016 四川卷)CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是a→______→c(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。
(4)装置D中发生的氧化还原反应的离子方程式是________________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
① 若杂质是CuCl2,则产生的原因是_______________
② 若杂质是CuO,则产生的原因是________________。
8、(2016 天津卷)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
1、测定原理:
碱性体积下,O2将Mn2+氧化为MnO(OH)2:① 2Mn2++O2+4OH- = 2MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2:② MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-
2、测定步骤
a. 安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200ml水样
c.向烧瓶中依次迅速加入1mlMnSO4无氧溶液(过量)2ml碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d. 搅拌并向烧瓶中加入2ml硫酸无氧溶液至②完全,溶液为中性或若酸性。
e.从烧瓶中取出40.00ml溶液,以淀粉作指示剂,用0.001000mol/LNa2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管 ②注射器 ③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50ml,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填是或否)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
9、(2016 浙江)无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5MgBr2·3C2H5OC2H5
请回答:
(1) 仪器A的名称是________。实验中不能用干燥空气代替干燥N2,原因是___ __ ____ _ _。
(2)如将装置B改为装置C(图2),可能会导致的后果是____ 。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A. 可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C. 加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-=Mg Y2-
① 滴定前润洗滴定管的操作方法是___ 。
② 测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标 准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是______(以质量分数表示)。
相关文档
- 2011新课标吉林黑龙江宁夏海南等高2021-05-1315页
- 山东省潍坊市高三下学期月份高考模2021-05-1310页
- 2014年版高考历史第04讲古代中国的2021-05-139页
- 2013高考数学理一轮复习第八篇 立2021-05-1310页
- 高考数学必背公式与知识点过关检测2021-05-1314页
- 2017年度高考英语(完形填空、书面表2021-05-136页
- 课标人教版高考风向标生物电子稿 2021-05-1346页
- 历年高考07207广东生物高考试题分2021-05-134页
- 高考英语一轮复习自选训练 阅读理2021-05-135页
- 2017湖南高职对口高考常德市大联考2021-05-137页