- 557.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点:化学物质及其变化
(90分钟,100分)
一、选择题(本题包括18个小题,每小题3分,共54分)
1.(2012·黄冈高一检测)高一学生小强的化学笔记中有如下内容:
①物质按照组成可以分为单质和化合物
②单质又可分为金属和非金属
③化合物主要包括:酸、碱、盐和氧化物
④按照分散剂粒子直径大小可将分散系分为溶液、浊液和胶体
⑤只要在水溶液中能导电的化合物就是电解质
⑥按照树状分类法可将化学反应分为:氧化还原反应和离子反应
⑦氧化还原反应的本质是化合价升降
你认为他的笔记中有几处错误( )
A.三处 B.四处
C.五处 D.六处
【答案】 B
【点拨】 物质按元素组成分为单质(仅一种元素组成的纯净物)和化合物(由两种或两种以上元素组成的纯净物),①正确;单质分为金属单质和非金属单质,②正确;化合物主要包括酸、碱、盐和氧化物,③正确;按分散质粒子直径大小将分散系分为溶液、浊液和胶体,④错误;电解质是自身能发生电离的化合物。如SO2、NH3等水溶液虽然能导电,但不是自身发生电离,不属于电解质,⑤错误;氧化还原反应与离子反应是交叉关系,⑥错误;氧化还原反应的本质是电子转移,⑦错误。
2.(2013·试题调研)分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是( )
A.根据是否含氧元素,将物质分为氧化剂和还原剂
B.根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C.根据水溶液是否能够导电,将物质分为电解质和非电解质
D.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
【答案】 B
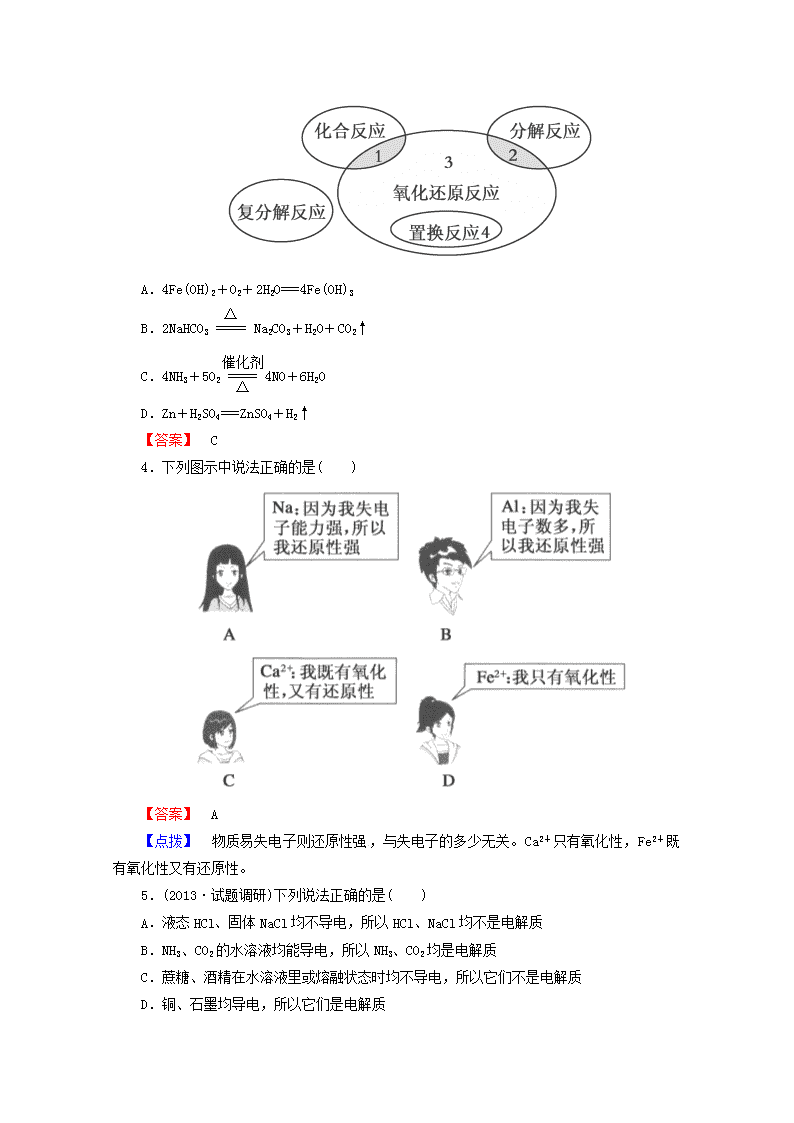
3.(2013·试题调研)氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( )
A.4Fe(OH)2+O2+2H2O===4Fe(OH)3
B.2NaHCO3Na2CO3+H2O+CO2↑
C.4NH3+5O24NO+6H2O
D.Zn+H2SO4===ZnSO4+H2↑
【答案】 C
4.下列图示中说法正确的是( )
【答案】 A
【点拨】 物质易失电子则还原性强,与失电子的多少无关。Ca2+只有氧化性,Fe2+既有氧化性又有还原性。
5.(2013·试题调研)下列说法正确的是( )
A.液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们不是电解质
D.铜、石墨均导电,所以它们是电解质
【答案】 C
【点拨】 NH3、CO2的水溶液能导电,并不是它们自身电离的结果,而是它们与水反应的产物NH3·H2O、H2CO3电离的结果。某物质是否为电解质的前提是此物质必须是化合物,故铜、石墨均不是电解质。故答案为C。
【特别提示】 ①判断给出的物质是不是电解质时,要先判断该物质是不是化合物,然后再对该化合物进行归类,看是哪一类物质,最后做出判断。
②要正确理解电解质导电的条件,而不能错误地认为只要能导电就是电解质以及电解质在任何条件下都能导电。
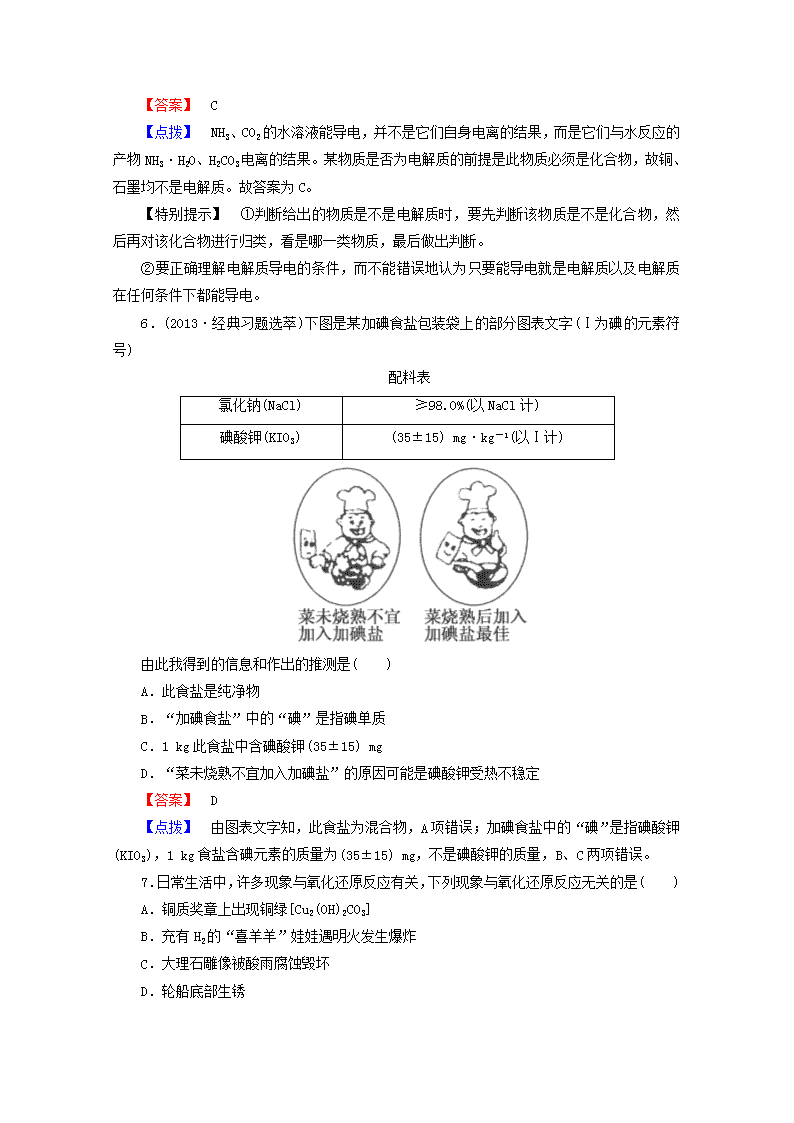
6.(2013·经典习题选萃)下图是某加碘食盐包装袋上的部分图表文字(Ⅰ为碘的元素符号)
配料表
氯化钠(NaCl)
≥98.0%(以NaCl计)
碘酸钾(KIO3)
(35±15) mg·kg-1(以Ⅰ计)
由此我得到的信息和作出的推测是( )
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指碘单质
C.1 kg此食盐中含碘酸钾(35±15) mg
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
【答案】 D
【点拨】 由图表文字知,此食盐为混合物,A项错误;加碘食盐中的“碘”是指碘酸钾(KIO3),1 kg食盐含碘元素的质量为(35±15) mg,不是碘酸钾的质量,B、C两项错误。
7.日常生活中,许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是( )
A.铜质奖章上出现铜绿[Cu2(OH)2CO3]
B.充有H2的“喜羊羊”娃娃遇明火发生爆炸
C.大理石雕像被酸雨腐蚀毁坏
D.轮船底部生锈
【答案】 C
【点拨】 有化合价变化的反应为氧化还原反应。
C中大理石雕像被酸雨腐蚀毁坏,发生的反应不是氧化还原反应:CaCO3+2H+===Ca2++H2O+CO2↑。
8.下表中评价合理的是( )
选项
化学反应及其离子方程式
评价
A
Fe3O4与稀硝酸反应:2Fe3O4+18H+===6Fe3++H2↑+8H2O
正确
B
向碳酸镁中加入稀盐酸:CO+2H+===CO2↑+H2O
错误,碳酸镁不应写成离子形式
C
向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO===BaSO4↓
正确
D
FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
错误,Fe2+与Br-的化学计量数之比应为1:2
【答案】 B
【点拨】 A项,Fe3O4中有二价铁离子,能被稀硝酸氧化为三价铁离子,硝酸本身被还原为NO气体;B项,由于碳酸镁为固体难溶物,在书写离子方程式时不能写为离子形式;C项,硫酸铵与氢氧化钡反应时,除了钡离子和碳酸根离子反应生成沉淀外,还有铵根离子和氢氧根离子生成氨气的反应;D项,由于该题给出了反应物的物质的量关系,并且Br-的还原性弱于Fe2+,故当二价铁离子完全被氧化后才有溴离子的反应,因为FeBr2与Cl2是等物质的量反应,故该离子方程式是正确的。
9.(2012·大同高一检测)下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与盐酸溶液;CaCO3与盐酸
D.石灰石与硝酸反应;石灰石与盐酸
【答案】 D
10.我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原理是( )
A.胶体的电泳
B.血液的氧化还原反应
C.血液中发生复分解反应
D.胶体的聚沉
【答案】 D
【点拨】 血液属于胶体,当加入电解质时,会发生聚沉,通常用FeCl3(盐溶液)作止血剂,就是利用该原理,故选D。
11.下列说法正确的是( )
A.金属单质在反应中只能作还原剂、非金属单质只能作氧化剂
B.某元素从化合态到游离态,该元素一定被还原
C.失电子多的金属还原性强
D.金属阳离子被还原不一定得到金属单质
【答案】 D
【点拨】 氧化还原反应的概念是通过化合价变化来表现的,描述氧化还原反应时一定要搞清化合价的变化情况。
解题流程:
12.下列反应属于氧化还原反应的是( )
A.CaCO3CaO+CO2↑
B.2KClO32KCl+2O2↑
C.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
D.NaCl(s)+H2SO4(浓)NaHSO4+HCl↑
【答案】 BC
【点拨】 该题主要考查氧化还原反应的判断,必须抓住它的特征,若元素化合价变化,则为氧化还原反应。反之,则为非氧化还原反应。
解题流程:
13.X原子转移2个电子给Y原子,形成化合物XY,下列说法中正确的是( )
A.X被氧化了
B.X是氧化剂
C.Y发生了氧化反应
D.Y在反应中表现出还原性
【答案】 A
【点拨】 X失去2个电子,化合价升高,作还原剂,被氧化,发生氧化反应;Y得到电子化合价降低,作氧化剂,被还原,发生还原反应。
14.在物质分类中,前者包括后者的是( )
A.氧化物、化合物 B.化合物、电解质
C.溶液、胶体 D.溶液、分散系
【答案】 B
【点拨】 A和D项均是后者包括前者,A项中氧化物都是化合物,但化合物不都是氧化物,D项中溶液属于分散系的一种;C项中溶液和胶体没有从属关系,是两种不同的分散系。
15.工业上冶炼锡的第一步反应原理为2SnO2+3C===2Sn+aM↑+CO2↑,则下列说法中错误的是( )
A.反应中SnO2被还原
B.a的值为3
C.反应后元素化合价升高生成的物质有两种
D.每生成1 mol CO2转移电子8 mol
【答案】 B
【点拨】 由原子守恒知a=2,M为CO。
16.(2012·宁波高一检测)已知某无色溶液中含有SO、Cl-、NO三种阴离子,则溶液中大量存在的阳离子是( )
A.Ba2+ B. Mg2+
C. Ag+ D. Fe3+
【答案】 B
【点拨】 “无色”排除Fe3+(棕黄色);有SO,则无Ba2+(生成BaSO4);有Cl-,则无Ag+(生成AgCl),故选B。
17.某溶液中只含有K+、Fe3+、NO,已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO的个数比为( )
A.1:2 B.1:4
C.3:4 D.3:2
【答案】 A
【点拨】 溶液中正电荷数为3a×1+a×3=6a,由正负电荷守恒知NO的个数为6a。
18.亚硝酸盐中毒,又名乌鸦病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法中,不正确的是( )
A.在中毒过程中血红蛋白被氧化
B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性
D.解毒时血红蛋白被还原
【答案】 B
【点拨】 本题考查氧化还原反应的应用。中毒过程中血红蛋白中的铁元素由二价变为三价,故血红蛋白被氧化,A项正确;中毒时血红蛋白发生氧化反应,则亚硝酸盐发生还原反应,B项错误;美蓝是亚硝酸盐中毒的有效解毒剂,因此美蓝能使高铁血红蛋白还原为正常的血红蛋白,即美蓝应具有还原性,C项正确;解毒时血红蛋白被还原,D项正确。
二、非选择题(本题包括6个小题,共46分)
19.(2013·试题调研)(8分)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
(1)请将分类依据代号填入相应的括号内:
( )两种物质都不是电解质
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为_____________________________________ ________________________________。
②证明有红褐色胶体生成的实验操作是________________________________________________________________________________________________________________________________________________。
【答案】 (1)A C B D
(2)①FeCl3
②用一束光照射烧杯中的物质,若能产生丁达尔效应,则证明生成了Fe(OH)3胶体
【点拨】 (1)根据物质的交叉分类法可知H2和CO2都不是电解质,Na2O和NaCl都是钠的化合物,CO2和Na2O都是氧化物,NaCl和FeCl3都是盐。
(2)由红褐色胶体可知该胶体是氢氧化铁胶体,可通过丁达尔效应证明胶体的存在或生成。
20.(6分)某研究性学习小组为了了解HCl、NaHSO4、NaHCO3在水溶液中的电离情况,进行了下列实验;
①分别测定了0.1 mol/L的HCl、NaHSO4、NaHCO3溶液中H+的物质的量浓度,HCl溶液中c(H+)=0.1 mol/L,NaHSO4溶液中c(H+)=0.1 mol/L,而NaHCO3溶液中H+的物质的量浓度远远小于0.1 mol/L。
②取少量NaHSO4溶液于试管中,滴入BaCl2溶液有不溶于硝酸的白色沉淀生成。
③取少量NaHCO3溶液于试管中,滴入几滴BaCl2无明显现象。
(1)请根据该小组同学的实验结果,分别写出HCl、NaHSO4、NaHCO3在水溶液中的电离方程式:
①HCl:_____________________________________________、
②NaHSO4:________________________________________、
③NaHCO3:_________________________________________。
(2)写出②中反应的离子方程式:
_____________________________________________________。
(3)写出HCl与NaHCO3反应的离子方程式:
_____________________________________________________。
【答案】 (1)①HCl===H++Cl-
②NaHSO4===Na++H++SO
③NaHCO3===Na++HCO
(2)Ba2++SO===BaSO4↓
(3)HCO+H+===CO2↑+H2O
【点拨】 根据实验①、②、③可知溶液中HCl完全电离生成H+和Cl-,NaHSO4
完全电离生成Na+、H+、SO,NaHCO3溶液中H+和CO很少,NaHCO3电离生成Na+和HCO。
21.(2013·经典习题选萃)(9分)铁在人体中的含量只有0.004%,微乎其微,但铁是组成血红蛋白的一个不可缺少的成员。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁,服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+Fe3+的转化时,①中的Fe2+作________剂,②中的Fe3+作________剂。
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作________剂,具有________性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为__________________________。
【答案】 (1)还原 氧化 (2)还原 还原
(3) Fe+2H+===Fe2++H2↑
【点拨】 (1)中Fe2+转化为Fe3+,化合价升高被氧化,所以Fe2+作还原剂;而Fe3+转化为Fe2+,化合价降低,所以Fe3+作氧化剂。
(2)维生素C能将Fe3+转化为Fe2+,使铁元素化合价降低,所以维生素C作还原剂,具有还原性。
(3)铁与盐酸反应化学方程式是Fe+2HCl===FeCl2+H2↑,离子方程式是Fe+2H+===Fe2++H2↑。
22.(7分)(1)从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子还原性最强。
①铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质。则在Cu、Fe、Ag中,________的还原性最强;在Cu2+、Fe2+、Ag+中,________的氧化性最强。
②铁钉在氯气中被锈蚀为棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2)。则在氯气分子(Cl2)、氯离子、氢离子中,________具有氧化性,________的氧化性最强。
(2)为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:
KIO3+5KI+3H2SO4===3I2+3K2SO4+3H2O
①该反应中,氧化剂是______________,氧化产物是______________。
②当有3 mol I2生成时,有________mol还原剂被氧化。
【答案】 (1)①Fe Ag+ ②Cl2、H+ Cl2
(2)①KIO3 I2 ②5
23.(8分)在稀硫酸、小苏打、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应。
(1)请推断出它们的化学式分别为:①________;②________;③________;④________;⑤________。
(2)写出下列序号之间反应的化学方程式:
①和②:_____________________________________________;
②和④:_____________________________________________;
②和⑤:_____________________________________________;
③和④:_____________________________________________。
【答案】 (1)①Fe ②稀H2SO4 ③CO2 ④CaO ⑤Na2CO3
(2)①和② Fe+H2SO4===FeSO4+H2↑
②和④ H2SO4+CaO===CaSO4+H2O
②和⑤ H2SO4+Na2CO3===Na2CO4+H2O+CO2↑
③和④ CO2+CaO===CaCO3
24.(2013·试题调研)(8分)有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤后溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是________,一定不含的物质是________,可能含有的物质是________。(以上各种物质均写化学式)
(2)写出下列步骤中发生反应的离子方程式:
①__________________________________________________;
②___________________________________________________;
③___________________________________________________。
【解析】 混合物溶于水后产生白色沉淀,形成的滤液呈无色,说明溶液中没有Cu2+,原粉末中肯定无CuSO4。根据题意,沉淀物一定是BaCO3,说明固体粉末中有Ba(NO3)2和Na2CO3;但依据滤液与AgNO3溶液作用产生白色沉淀,这种白色沉淀可能是AgCl沉淀,也可能是Ag2CO3沉淀,故无法判断原白色粉末中是否存在NaCl。
【答案】 (1)Ba(NO3)2、Na2CO3 CuSO4 NaCl
(2)Ba2++CO===BaCO3↓
BaCO3+2H+===Ba2++CO2↑+H2O
SO+Ba2+===BaSO4↓