- 1.52 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
(2) 化合物CH3COO[Cu(NH3)3(CO)]中配原子为________,(2)C、N(各1分)
(1)26
基态碳原子核外电子占有_________个轨道。4(1分)
(6)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键的物质的量为__________mol。(6)8(1分)
(7)铜晶体为面心立方最密堆积,配位数为___________,(7)12 (1分)
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
①Cu2+与乙二胺所形成的配离子中含有的化学键是________。
a.配位键 b.离子键 c.键 d.键
①ac( 2 分)
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为 ▲ ,[Cu(CN)4]2-中C的杂化方式为 ▲ ,则1个[Cu(CN)4]2-中含有的σ键的数目为 ▲ 个;
(2)CN-(1分) sp(2分) 8(2分)
(1)[Ar] 3d54s1(1分) d区(1分)
(2)Na2O·Al2O3·4SiO2(2分) Na<Al<Si<O(1分)
(3)Fe的核电荷数较大,核对电子的引力较大,故Fe的原子半径小于Ca,Fe的金属键强于Ca(2分)
(4)①ABCD(只要选E项不得分,未选全得1分,共2分)
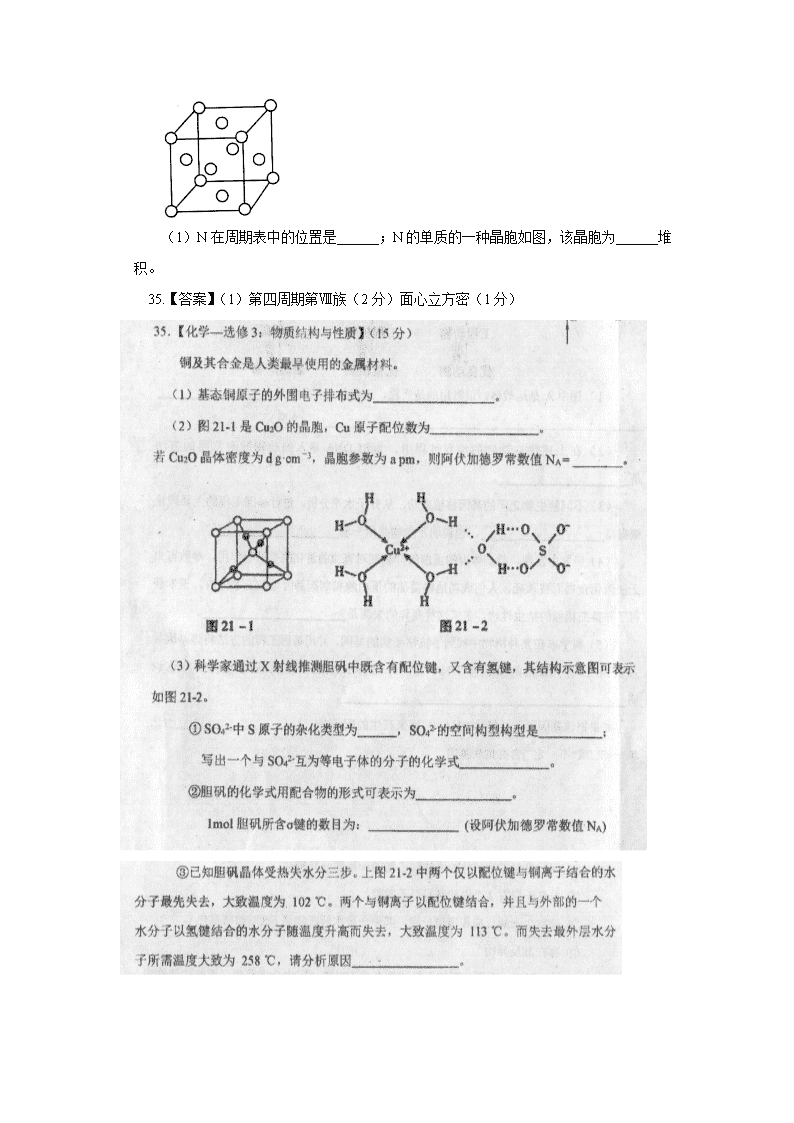
(1)N在周期表中的位置是______;N的单质的一种晶胞如图,该晶胞为______堆积。
35.【答案】(1)第四周期第Ⅷ族(2分)面心立方密(1分)
(1)Na+核外电子占据的最高能级的电子云轮廓图为_______________,(3)区分石英玻璃和水晶的最科学的方法是__________(填字母)。
A.观察自范性 B.观察各向异性 C.进行X-射线衍射实验 D.测定固定熔点
(2)联氨分子中氮原子的杂化方式为 ,氮原子采取该杂化方式后的价层电子排布图为 。[来源:学。科。网Z。X。X。K]
(1)空间运动状态(1分);9(1分);⑶ Fe(CO)5(1分) 1︰1(1分) 分子(1分)
(1)[Ar]3d6 (2分)
②磷原子中存在 种不同能量的电子,电子占据的最高能层符号为 。
②5(1分) M(1分)(4)磷化硼的晶体结构如图2所示。晶胞中P原子的堆积方式为 (填“简单立方”、
“体心立方”或“面心立方最密”)堆积。面心立方最密 (1分)
(3) 比较下列碳酸盐在一定温度下会发生分解的温度和对应的阳离子半径,分析其变化规律及原因_____________。
碳酸盐
MgCO3
CaCO3
SrCO3
BaCO3
热分解温度/℃
402
900
1172
1360
阳离了半径/pm
66
99
112
135
(3)因为碳酸盐的分解过程实际上是晶体中阳离子结合CO32﹣中的氧离子,使CO32﹣分解为CO2的过程,所以当阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力就越强,对应的碳酸盐就越容易分解(3分);
(3)镍与CO生成的配合物Ni(CO)4中,易提供孤电子对的成键原子是 (填元素名称);
1molNi(CO)4中含有的σ键数目为 ;写出与CO互为等电子体的一种离子的化学式 。
(3) 碳(1 分) 8NA(2分) CN-或C22-(1 分,合理即给分)
(1)原子光谱(1分)
(2)Ni(CO)n与Fe(CO)5同属金属羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。
①Ni、C、O的电负性由大到小的顺序为____________________。
② Ni(CO)n分子中n=__________。
③已知Ni2+和Fe2+的离子半径分别为69pm和78pm,根据岩浆晶出规则熔融的NiO和FeO岩浆在冷却过程中,NiO更容易先结晶,试解释其原因____________________。
(3)两种三角锥形气态氢化物PH3和NH3的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因 。
(3) N电负性强于P,且原子半径小于P, NH3中成键电子对离中心原子更近,成键电子对间距离更小,致使其成键电子对间斥力大,键角更大。(2分)(说明:能从“电负性”强弱角度或“原子半径”大小角度回答得1分 ,回答出“成键电子对”、“共用电子对”或“键合电子对”或“电子云密度”等距离近或大、斥力大得1分)
(1)bd(2分)
(4)NH4+中的氮原子上均为成键电子,而NH3分子中的氨原子上有一对孤对电子,孤对电子与成键电子之间的排斥力强于成键电子与成键电子之间的排斥力,导致NH4+中H-N-H的键角比NH3中大。(2分)
由于O原子半径小,电负性大,提供孤对电子能力比N原子弱,故水分子形成的配位键弱于
氨分子。(2分)
(3)电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的排斥力增大,键角变大。(2分)
(1)
(1分) 4(1分)
(2) ①>(1分) Na失去1个电子后,2p能级处于全充满的稳定状态,故第二电离能Na>Mg(2分)
②r(Ca2+)>r(Mg2+),CaO晶格能小于MgO晶格能,故MgCO3更易分解为MgO,稳定性CaCO3 > MgCO3(2分)
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成 mol AgCl沉淀。
H2O分子的键角比H2S分子的键角大,原因是 。
(3)0.2(2分) 氧的原子半径比硫小,电负性比硫大,水分子中成键电子对更靠近中心原子,相互排斥作用大,键角大 (2分)
(1)写出基态Cr的简化电子排布式__________,Cr中共有__________种不同能级的电子。
(1) [Ar]3d3(1分) ;6(1分)
(3)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的 ,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为 ,N的杂化方式为 ,写出NH3的一种等电子体。
(3)Cr(H2O)6Cl3(1分) 四面体形(1分) sp3(1分) PH3(1分)