- 614.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第4节 氮及其重要化合物
课时跟踪练
一、选择题
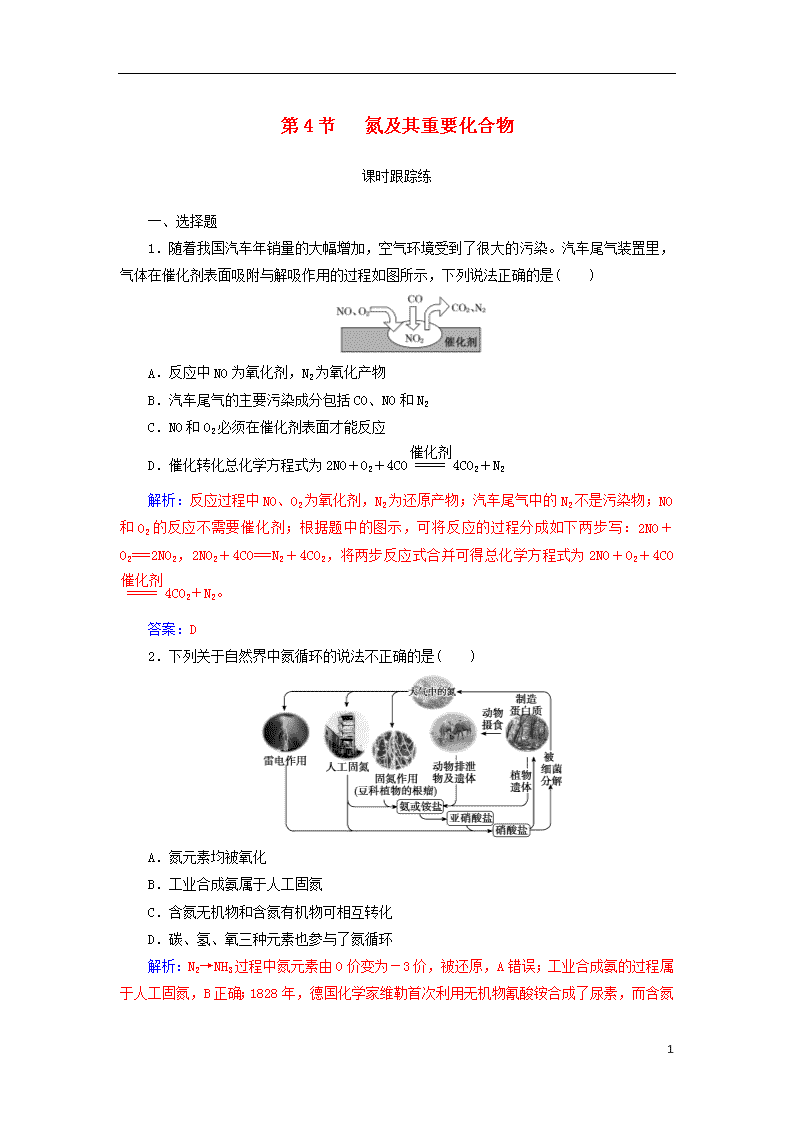
1.随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4CO4CO2+N2
解析:反应过程中NO、O2为氧化剂,N2为还原产物;汽车尾气中的N2不是污染物;NO和O2的反应不需要催化剂;根据题中的图示,可将反应的过程分成如下两步写:2NO+O2===2NO2,2NO2+4CO===N2+4CO2,将两步反应式合并可得总化学方程式为2NO+O2+4CO4CO2+N2。
答案:D
2.下列关于自然界中氮循环的说法不正确的是( )
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参与了氮循环
解析:N2→NH3过程中氮元素由0价变为-3价,被还原,A错误;工业合成氨的过程属于人工固氮,B正确;1828年,德国化学家维勒首次利用无机物氰酸铵合成了尿素,
7
而含氮的有机物也可以直接分解为无机物,C正确;豆科植物可以将N2合成氮肥,生物体内的蛋白质中含有C元素,所以碳、氢、氧三种元素都参加了氮循环,D正确。
答案:A
3.氮及其化合物的变化关系如下图所示。则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气可在足量的氧气中通过一步反应生成NO2
解析:氮气和氧气在放电条件下反应生成NO,NO与O2转化为NO2,即氮气与氧气不能一步转化为NO2。
答案:D
4.氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述正确的是( )
A.“两水”都是混合物,溶液中含有的粒子种类、数目相同
B.“两水”中都存在可逆反应的化学平衡和弱电解质的电离平衡
C.“两水”都有刺激性气味,都能漂白有机色素
D.“两水”放置时间较久后,都会因为相同的原理而变质
解析:A项,氨水中的微粒有NH3·H2O、H2O、NH3三种分子和NH、OH-、H+三种离子,氯水中有Cl2、HClO、H2O三种分子和Cl-、ClO-、H+、OH-四种离子,所以微粒的种类、数目均不相同;C项,氨水没有漂白性,不能漂白有机色素;D项,“两水”的变质原因不相同,氨水因挥发而“变质”,而氯水主要因HClO分解而变质。
答案:B
5.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。将3支试管均倒置于盛水的水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列的关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3>V1>V2
解析:设各种气体的体积都为1体积。①根据3NO2+H2O===2HNO3+NO,即剩余NO的体积V1=体积。②根据4NO2+O2+2H2O===4HNO3,即剩余O2的体积V2=体积。③剩余N2的体积V3=1体积。即B项符合题意。
答案:B
7
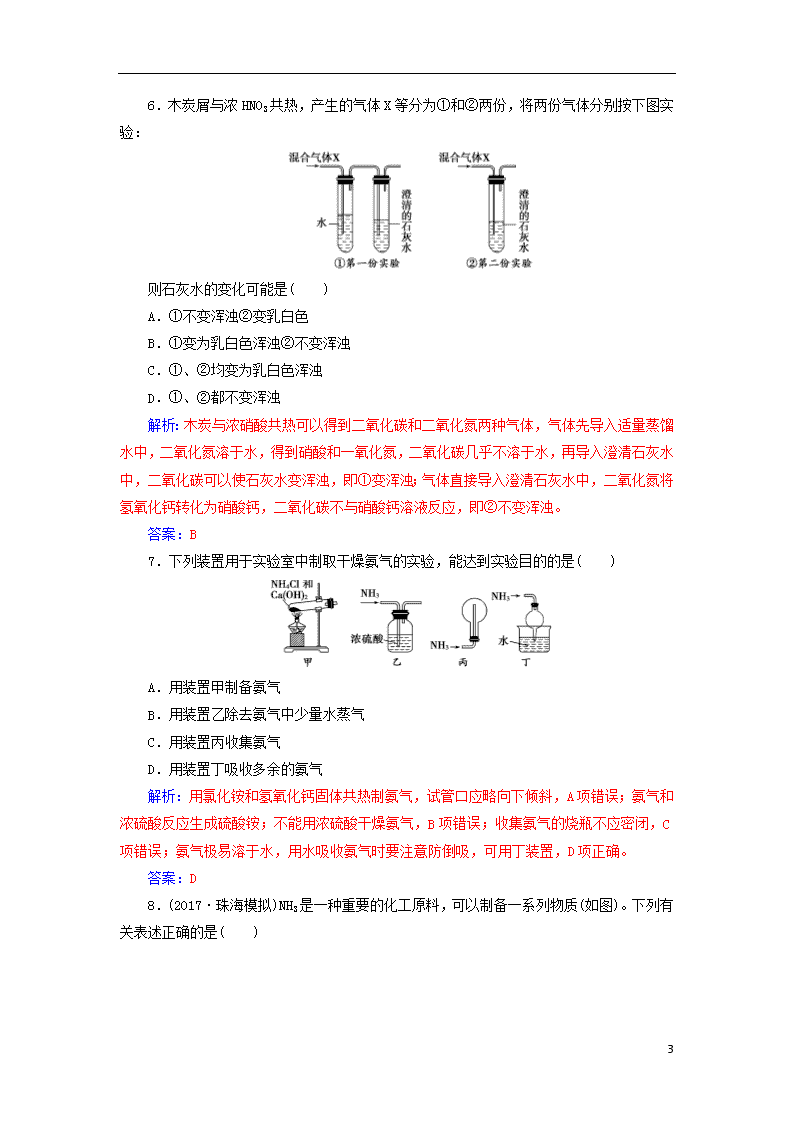
6.木炭屑与浓HNO3共热,产生的气体X等分为①和②两份,将两份气体分别按下图实验:
则石灰水的变化可能是( )
A.①不变浑浊②变乳白色
B.①变为乳白色浑浊②不变浑浊
C.①、②均变为乳白色浑浊
D.①、②都不变浑浊
解析:木炭与浓硝酸共热可以得到二氧化碳和二氧化氮两种气体,气体先导入适量蒸馏水中,二氧化氮溶于水,得到硝酸和一氧化氮,二氧化碳几乎不溶于水,再导入澄清石灰水中,二氧化碳可以使石灰水变浑浊,即①变浑浊;气体直接导入澄清石灰水中,二氧化氮将氢氧化钙转化为硝酸钙,二氧化碳不与硝酸钙溶液反应,即②不变浑浊。
答案:B
7.下列装置用于实验室中制取干燥氨气的实验,能达到实验目的的是( )
A.用装置甲制备氨气
B.用装置乙除去氨气中少量水蒸气
C.用装置丙收集氨气
D.用装置丁吸收多余的氨气
解析:用氯化铵和氢氧化钙固体共热制氨气,试管口应略向下倾斜,A项错误;氨气和浓硫酸反应生成硫酸铵;不能用浓硫酸干燥氨气,B项错误;收集氨气的烧瓶不应密闭,C项错误;氨气极易溶于水,用水吸收氨气时要注意防倒吸,可用丁装置,D项正确。
答案:D
8.(2017·珠海模拟)NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( )
7
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质均可以水解
解析:A项,NaHCO3不是化肥;B项,Na2CO3受热不易分解;D项,NaCl不水解。
答案:C
9.某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( )
A.原混合酸中NO物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
解析:铁粉既能与硝酸反应也能与硫酸反应,从题干图中看出(注意只是第二份100 mL)OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气,反应为Fe+2H+===Fe2++H2↑,可知NO反应完全,第二份中NO应为×3÷3=0.1 mol,溶液中最终溶质为FeSO4,此时反应的铁的质量是14 g,即0.25 mol,故原混合酸中H2SO4浓度为=2.5 mol·L-1,NO物质的量为0.2 mol。所以选A。
答案:A
二、非选择题
10.氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式:_____________;
②NH3的稳定性比PH3的稳定性________(填 “强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
7
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为
_____________________________________________________。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是________(写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH和_______
______________________________________________________。
(3)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因:_________________________________
_____________________________________________________。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为____________________,若反应中有0.3 mol电子发生转移,生成亚硝酸的质量为________g(小数点后保留两位有效数字)。
解析:(1)①氮气电子式中存在三键;②根据非金属性的判断依据“非金属性越强,气态氢化物越稳定”,很容易判断出NH3的稳定性强于PH3。(2)①根据现象写方程式;②氨气溶于浓硫酸,能生成(NH4)2SO4或NH4HSO4;③根据现象写方程式,氢氧化亚铁被氧气氧化为氢氧化铁:4Fe(OH)2+O2+2H2O===4Fe(OH)3。(3)氨在水中存在平衡:NH3+H2ONH3·H2ONH+OH-,加入NaOH后OH-浓度增大,平衡逆向移动,故有利于氨的逸出。(4)由方程式可看出,每当生成1 mol HNO2,转移电子数为6 mol,当有0.3 mol电子发生转移时,生成亚硝酸0.05 mol,即2.35 g。
答案:(1)①∶N⋮⋮N∶ ②强
(2)①NH3+HCl===NH4Cl
②NH4HSO4或(NH4)2SO4
③4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)氨在水中存在平衡:NH3+H2ONH3·H2ONH+OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除
(4)2NH3+3O22HNO2+2H2O 2.35
11.(1)在100 mL 0.8 mol·L-1硝酸溶液中加入足量铜粉,则被溶解的铜的质量为________g。
7
(2)在上述溶液中再加入足量稀硫酸,又有________g铜溶解。此过程中生成的气体在标准状况下的体积为________L。
(3)若向100 mL 0.8 mol·L-1硝酸溶液中加入铁粉,测得反应后的溶液中Fe2+与Fe3+的浓度之比为1∶1,则加入铁的质量为________g。
(4)向100 mL 0.8 mol·L-1硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出气体224 mL(标准状况下),且测得溶液中铁元素只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1 mol·L-1的NaOH溶液________mL。
解析:(1)在100 mL 0.8 mol·L-1硝酸溶液含有硝酸的物质的量为0.08 mol,根据3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,反应的铜的物质的量为0.03 mol,质量为0.03 mol×64 g/mol=1.92 g;
(2)根据3Cu+8H++2NO===3Cu2++2NO↑+4H2O,反应的铜的物质的量为×0.08 mol=0.12 mol,因此在上述溶液中再加入足量稀硫酸,又有(0.12 mol-0.03 mol)×64 g/mol=5.76 g铜溶解。此过程中生成的气体在标准状况下的体积为0.09 mol××22.4 L/mol=1.334 L,故答案为:5.76;1.344;
(3)设加入铁的物质的质量为x,100 mL 0.8 mol·L-1硝酸溶液含有的硝酸的物质的量为0.08 mol,被还原的硝酸的物质的量为0.08 mol-×2-×3,根据得失电子守恒,有×(5-2)=×2+×3,解得x=0.024 mol,铁的质量为0.024 mol×56 g/mol=1.344 g。
(4)HNO3的物质的量为0.1 L×0.8 mol·L-1=0.8 mol,生成NO的物质的量为=0.01 mol,所以与一定量Fe、FeO和Fe2O3的混合物反应后溶液中含有的NO的物质的量为0.08 mol-0.01 mol=0.07 mol,再向反应后的溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所得溶液的溶质为NaNO3,所以需要NaOH的物质的量为n(NaOH)=n(NO)=0.07 mol,则所加NaOH溶液的体积最少是=0.7 L,即700 mL。
答案:(1)1.92 (2)5.76 1.344 (3)1.344 (4)700
12.某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究。
7
回答下列问题:
(1)若用装置①制取NH3,其反应的化学方程式为____________
_____________________________________________________;
若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是
_____________________________________________________。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是________,分液漏斗中装的试剂是________,收集装置应选择________(填装置序号)。
答案:(1)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O
③⑦ 不与氨气反应、不能挥发、不与氨气互溶
(2)CaO(NaOH或碱石灰) 浓氨水(或浓NH4Cl溶液) ⑥
7