- 1.10 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012届高考化学第一轮复习必修部分讲义
第八单元第2讲原电池与化学电源
解读与阐释
考纲要求
权威解读
1.了解原电池的工作原理,能写出电极反应和电池反应方程式;
2.了解常见化学电源的种类及其工作原理。
常见的考查形式:①原电池的工作原理及电极反应式的书写(近几年考查的重点,预计今后几年还会加强此方面的考查);②设计原电池,并绘制装置图。
梳理与整合
一、原电池的工作原理
导学诱思
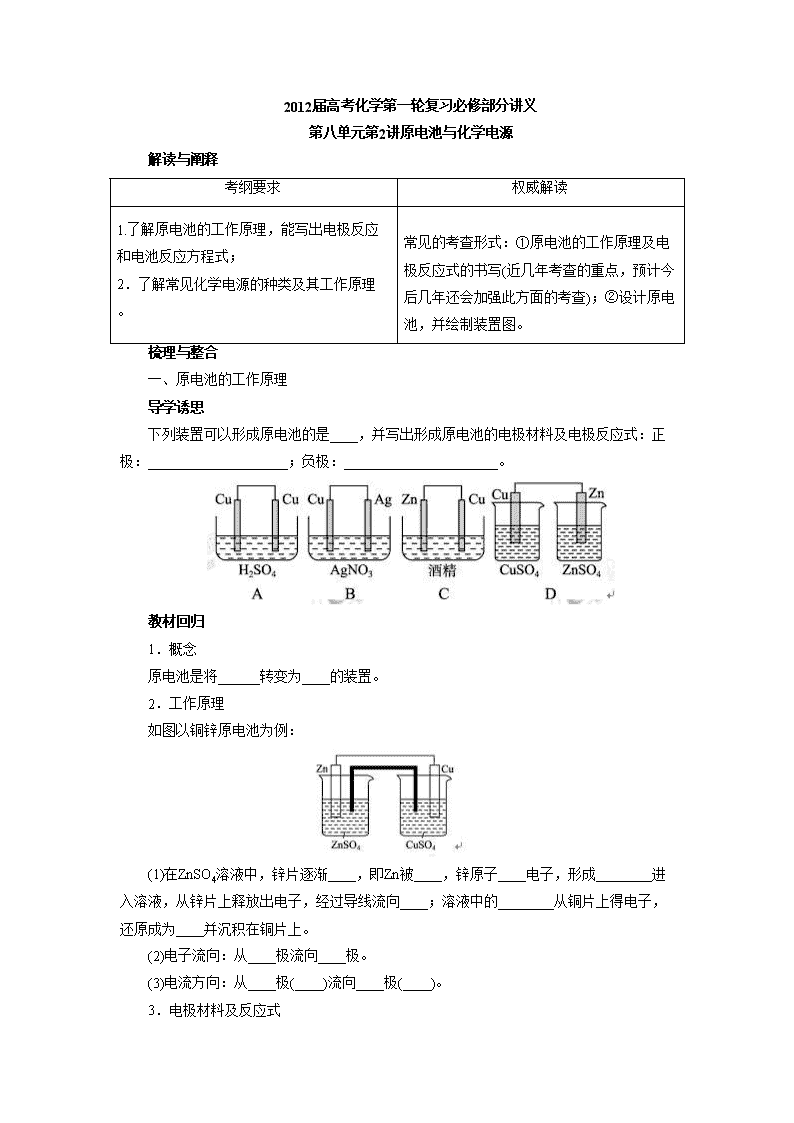
下列装置可以形成原电池的是____,并写出形成原电池的电极材料及电极反应式:正极:____________________;负极:______________________。
教材回归
1.概念
原电池是将______转变为____的装置。
2.工作原理
如图以铜锌原电池为例:
(1)在ZnSO4溶液中,锌片逐渐____,即Zn被____,锌原子____电子,形成________进入溶液,从锌片上释放出电子,经过导线流向____;溶液中的________从铜片上得电子,还原成为____并沉积在铜片上。
(2)电子流向:从____极流向____极。
(3)电流方向:从____极(____)流向____极(____)。
3.电极材料及反应式
电极名称
负极
正极
电极材料
电极反应
反应类型
____反应
____反应
电池反应式
4.原电池的构成条件
原电池的形成需要满足以下三个条件:
(1)有电解质溶液或熔融电解质
(2)一般是活泼性不同的两电极
(3)形成闭合回路
原电池装置的作用就是把一个完整的氧化还原反应分开——在负极只发生氧化反应,正极只发生还原反应。这样负极失去的电子就只能通过导线转移到正极上,从而产生电流。
二、化学电源
导学诱思
铜锌原电池中,负极发生氧化反应,电极失电子质量减小,是否所有的化学电源中负极电极材料均减小?
答:________________________________。
教材回归
1.一次电池
(1)锌锰干电池
碱性锌锰干电池比普通锌锰干电池性能优越,比能量大,储存时间长,能提供较大电流并连续放电。其中负极是____,正极是______,电解质是KOH,其电池反应方程式为Zn+2MnO2+2H2O===+Zn(OH)2。
(氢氧化氧锰)
(2)银锌纽扣电池
银锌纽扣电池的电极分别为Ag2O和Zn,电解质溶液为KOH溶液,发生氧化还原反应后生成Ag和Zn(OH)2。其中____为负极,______为正极,电池反应方程式为Zn+Ag2O+H2O===Zn(OH)2+2Ag。
2.二次电池
铅蓄电池是常见的二次电池,是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖______,负极板上覆盖____,电解质是硫酸。其放电反应是______反应,充电反应则是放电反应的逆反应。放电时,负极反应为__________________________________________,正极反应为__________________________________________________,因此其充放电反应可表示为____________________________________________________________________。
3.燃料电池
(1)燃料电池的工作原理
利用燃料和氧化剂之间发生的____________,将化学能直接转化为电能的化学电池。它工作时不断从外界输入反应物,同时将电极反应产物排出电池。因此,燃料电池能连续不断地提供电能。
(2)氢氧燃料电池
氢氧燃料电池是常见的燃料电池,它以____为燃料,____为氧化剂。除具有能量转化率高、可持续使用的优点外,还由于其燃烧产物为水,因此不会污染环境,其电池反应为H2+O2===H2O。在酸性电解质中电极反应式为:负极:______________,正极:____________________。
理解与深化
一、原电池的工作原理
1.原理图示
2.注意点
(1)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。
(2)无论在原电池还是在电解池中,电子均不能通过电解质溶液。
(3)原电池的负极失去电子的总数等于正极得到电子的总数。
【例1】 某燃料电池所用的原料为H2和空气(含一定量的CO2),电解质为熔融的K2CO3。电池的总反应为2H2+O2===2H2O,负极反应为H2+CO-2e-===H2O+CO2
。下列说法中正确的是( )。
A.正极反应为4OH-+4e-===2H2O+O2↑
B.电池工作时,电解质中CO的物质的量将减小
C.电池工作时,电解质中CO向负极移动
D.电池工作时,电子从正极经外电路流向负极
导线中的电流是从正极流向负极,而原电池内溶液中的电流(阳离子)正好相反,是从负极流向正极,阴离子从正极流向负极,这样才能形成闭合回路。
对点训练1(改编自2010·广东理综)铜锌原电池(如下图)工作时,下列叙述不正确的是( )。
A.撤掉盐桥不能形成闭合回路,所以不能形成原电池
B.电池反应为:Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
二、原电池电极正负的判断及书写
1.正、负极的判断
2.电极反应的书写步骤
3.电极反应的书写举例
(1)如果题目给定的是图示装置,没给总方程式,先分析正、负极,再根据正、负极反应规律去书写电极反应式。
例如:
写电极反应式分三步:
①分别找出氧化剂(H+)和还原剂(Zn)。燃料电池如氢氧燃料电池,一般而言,燃料作还原剂,O2作氧化剂。氧化剂在正极得电子,还原剂在负极失电子。
②结合介质判断氧化产物(Zn2+)和还原产物(H2)。
③写出电极反应式(注意两极得失电子数相等)。
负极:Zn-2e-===Zn2+;
正极:2H++2e-===H2↑。
(2)给出总方程式,首先分析此反应中电子的得失,即氧化反应或还原反应,化合价升高、失电子、发生氧化反应、为原电池的负极;化合价降低、得电子、发生还原反应、为原电池的正极。以铅蓄电池放电时的反应为例,总反应为Pb+PbO2+2H2SO42PbSO4+2H2O,电极反