- 5.11 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2010届高三化学一轮复习教学案:镁、铝及其重要化合物
考点1 Mg、Al的化学性质
1.与非金属反应
(1)与O2反应。常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。镁、铝都能在空气中燃烧: 。
(2)与卤素单质、硫等反应。Mg+ Cl2 2Al+ 3Cl2
2Al+ 3S (用于工业制备) Mg+ S
[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。镁在空气中燃烧时有三个反应发生:
2Mg+O22MgO 3Mg+N2Mg3N2 2Mg+CO22MgO+C
②燃烧时都放出大量的热,发出耀眼的白光。利用镁的这种性质来制造照明弹。
③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
2.与H2O反应
Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气
Mg+2H2O 2A1+6H2O
3.与酸反应置换出H2
Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。所以 用铝制容器贮存冷的浓硫酸或浓硝酸。
4.与某些氧化物反应
(1)镁与二氧化碳反应:2Mg+CO2
[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe2O3
铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3 、FeO、Fe3O4、Cr2O3、V2O5、MnO2等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
③要使用没有氧化的铝粉,氧化铁粉末要烘干。
④KClO3作为引燃剂,也可以用Na2O2代替。实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
5.与碱反应
镁不与碱反应,铝与碱液反应: 。
[例1]用铝箔包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为(标准状况) ( )
A.O2和H2的混合气体 B.1.12L H2 C.大于1.12LH2 D.小于1.12L H2
[解析]Na与水反应放出H2,并且生成NaOH,铝能与NaOH溶液反应,也生成H2,故最后收集到的气体是这两部分H2总和,显然比Na单独反应产生的H2多。
2Na+2H2O2NaOH +H2↑ 2A1+6H2O2A1(OH)3+3H2↑
0.1mol 0.1mol 0.05mol 0.1mol 0.15mol
若铝箔足量,共生成H2:0.05mol+0.15mol=0.2mol
V(H2)=0.2mol×22.4mol/L=4.48L。
[答案]C
[规律总结]铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
考点2 氢氧化铝
1.物理性质:Al(OH)3是几乎不溶于水的 ,具有 性。
2.化学性质
①与酸反应:Al(OH)3 +3HCl=AlCl3+3H2O(离子反应方程式: )
②与碱反应:Al(OH)3+NaOH=Na[Al(OH)4](离子反应方程式: )
3.Al(OH)3的制取
①铝盐与碱反应:实验室制取氢氧化铝时采用过量的氨水,而不用强碱与可溶性铝盐溶液反应是因为 。
②四羟基合铝酸盐与酸反应:一般用向偏铝酸盐溶液中通入CO2的方法制取Al(OH)3。
当CO2不足或适量时: ;(填离子反应方程式,下同)CO2过量时: 。
[特别提醒]:(1)制取Al(OH)3也可用铝盐与强碱作用,但应严格控制加入碱的量,因为强碱过量会使制得的Al(OH)3转化为四羟基合铝酸盐:Al(OH)3+OH-=[Al(OH)4]-。
(2)一般不用强酸,因为强酸的量控制不当会使制得的Al(OH)3溶解:[Al(OH)4] -+H+=Al(OH)3↓+H2O;Al(OH)3+3H+=Al3++3H2O。
4.Al(OH)3的用途:由于Al(OH)3具有吸附性,既能凝聚水中悬浮物,又能吸附色素,因此Al(OH)3可作净水剂和色素吸附剂。
[例2]使溶液中Ba2+、Mg2+、Al3+、Ag+、Cu2+分步逐一沉淀析出,加入下列试剂的顺序正确的是 ( )
A.NaCl→Na2S→Na2SO4→NaOH→HNO3 B.H2SO4→HCl→H2S→NaOH→CO2
C.HCl→H2SO4→H2S→NaOH→CO2 D.Na2S→Na2SO4→NaCl→NaOH→HCl
[解析]SO42-能同时除去Ba2+和Ag+,S2-能同时除去Ag+和Cu2+,所以不能放在第一位,排除BD;AC相比,在加入前四种试剂后,Al3+以AlO2-形式存在,加酸可使AlO2-以Al(OH)3形式沉淀。但HNO3量 不好控制,所以最好的选项为C。
[答案]C
[规律总结]解除杂题应注意①除杂试剂的选择。本题要求将离子分步逐一除去,所以试剂要一一对应:Ba2+~SO42-,Mg2+~OH-,Ag+~Cl-,Cu2+~S2-,②除杂的顺序。为了将杂质除干净,除杂试剂一般是过量的,这样势必引入新杂质。所以后续的除杂试剂在去除对应杂质的同时,还要有将前一过量除杂试剂清除的作用。
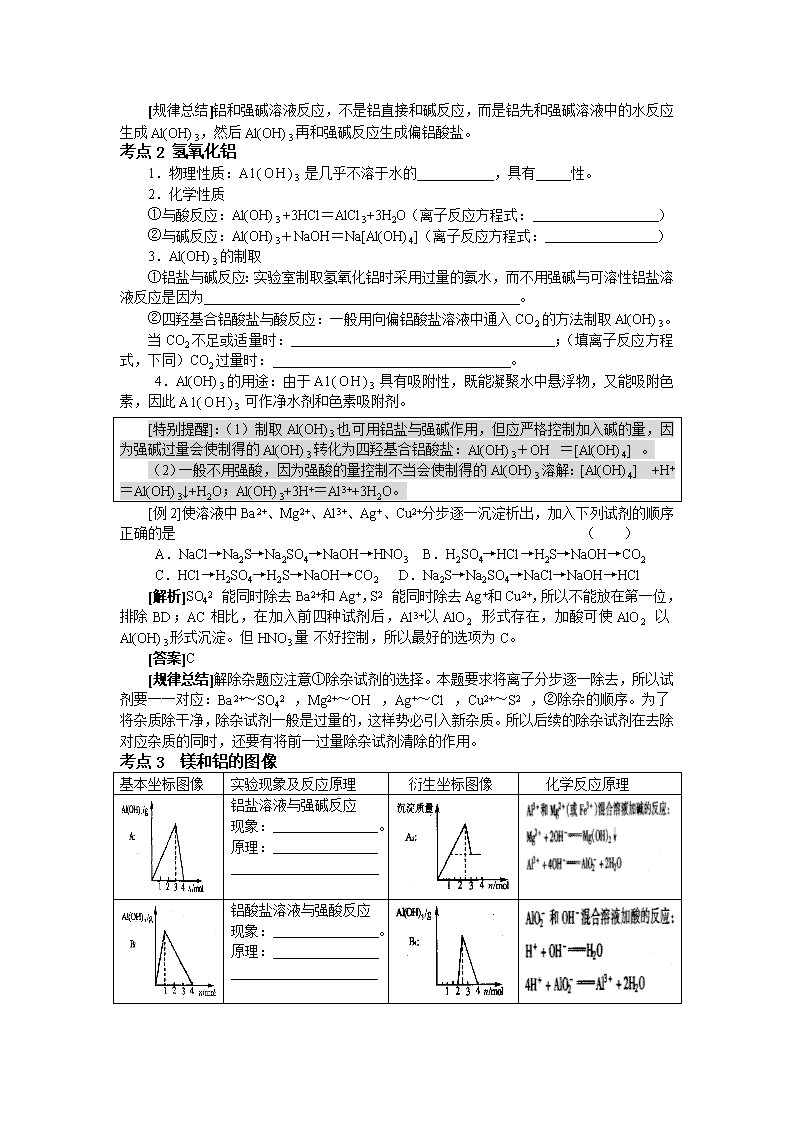
考点3 镁和铝的图像
基本坐标图像
实验现象及反应原理
衍生坐标图像
化学反应原理
铝盐溶液与强碱反应
现象: 。
原理:
铝酸盐溶液与强酸反应
现象: 。
原理:
铝盐溶液与弱碱反应
现象: 。
原理:
铝酸盐溶液与弱酸反应
现象: 。
原理:
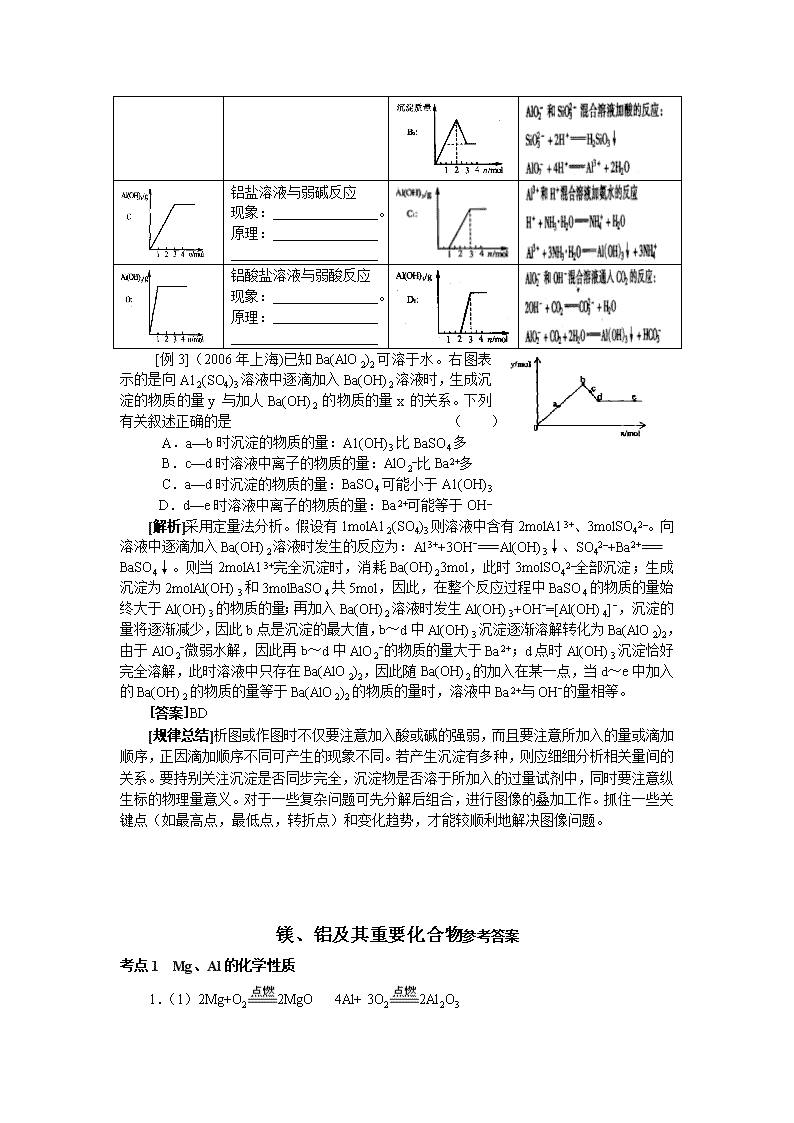
[例3](2006年上海)已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2–比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d—e时溶液中离子的物质的量:Ba2+可能等于OH–
[解析]采用定量法分析。假设有1molA12(SO4)3则溶液中含有2molA13+、3molSO42–。向溶液中逐滴加入Ba(OH)2溶液时发生的反应为:Al3++3OH-Al(OH)3↓、SO42–+Ba2+
BaSO4↓。则当2molA13+完全沉淀时,消耗Ba(OH)23mol,此时3molSO42–全部沉淀;生成沉淀为2molAl(OH)3和3molBaSO4共5mol,因此,在整个反应过程中BaSO4的物质的量始终大于Al(OH)3的物质的量;再加入Ba(OH)2溶液时发生Al(OH)3+OH-=[Al(OH)4] -,沉淀的量将逐渐减少,因此b点是沉淀的最大值,b~d中Al(OH)3沉淀逐渐溶解转化为Ba(AlO2)2,由于AlO2-微弱水解,因此再b~d中AlO2-的物质的量大于Ba2+;d点时Al(OH)3沉淀恰好完全溶解,此时溶液中只存在Ba(AlO2)2,因此随Ba(OH)2的加入在某一点,当d~e中加入的Ba(OH)2的物质的量等于Ba(AlO2)2的物质的量时,溶液中Ba2+与OH-的量相等。
[答案]BD
[规律总结]析图或作图时不仅要注意加入酸或碱的强弱,而且要注意所加入的量或滴加顺序,正因滴加顺序不同可产生的现象不同。若产生沉淀有多种,则应细细分析相关量间的关系。要持别关注沉淀是否同步完全,沉淀物是否溶于所加入的过量试剂中,同时要注意纵生标的物理量意义。对于一些复杂问题可先分解后组合,进行图像的叠加工作。抓住一些关键点(如最高点,最低点,转折点)和变化趋势,才能较顺利地解决图像问题。
镁、铝及其重要化合物参考答案
考点1 Mg、Al的化学性质
1.(1)2Mg+O22MgO 4Al+ 3O22Al2O3
(2)MgCl2 2AlCl3 Al2S3 MgS
2.Mg(OH)2+H2↑ 2A1(OH)3+3H2↑ 3.可
4.(1)2MgO+C (2)2Fe+ Al2O3
5.2Al+2NaOH+6H2O2NaAlO2+4H2O+3H2↑
考点2 氢氧化铝
1.白色胶状固体 吸附 2.①Al(OH)3+3H+=Al3++3H2O ②Al(OH)3+OH-=[Al(OH)4]-
3.①氢氧化铝是两性氢氧化物,能溶于强碱溶液,不溶于弱碱溶液
②2[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O [Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
考点3 镁和铝的图像
现象:先产生沉淀,后沉淀消失。
反应原理:Al3++3OH–Al(OH)3 ↓ Al(OH)3 +OH–[Al(OH)4]–
现象:沉淀不断增多,而后沉淀溶解。
反应原理:[Al(OH)4]–+H+=Al(OH)3↓+H2O Al(OH)3+3H+=Al3++3H2O
现象:产生沉淀 反应原理:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
现象:产生沉淀 反应原理:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
现象:产生沉淀 反应原理:[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-