- 4.27 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.甲醇是基本有机化工原料.甲醇及其可制得产品的沸点如下.
名称
甲醇
二甲胺
二甲基甲酰胺
甲醚
碳酸二甲酯
结构简式
CH3OH
(CH3)2NH
(CH3)2NCHO
CH3OCH3
(CH3O)2CO
沸点(℃)
64.7
7.4
153℃
﹣24.9
90℃
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为 .
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则△H 0 (填“>”、“<”或“=“).
(3)甲醇制甲醚的化学方程式为:2CH3OHCH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CH3OH
CH3OCH3
H2O
Ⅰ
387
0.20
x
Ⅱ
387
0.40
y
Ⅲ
207
0.20
0.090
0.090
①x/y= .
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则反应将向 (填“正”或“逆”)反应方向进行.
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为 .
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.
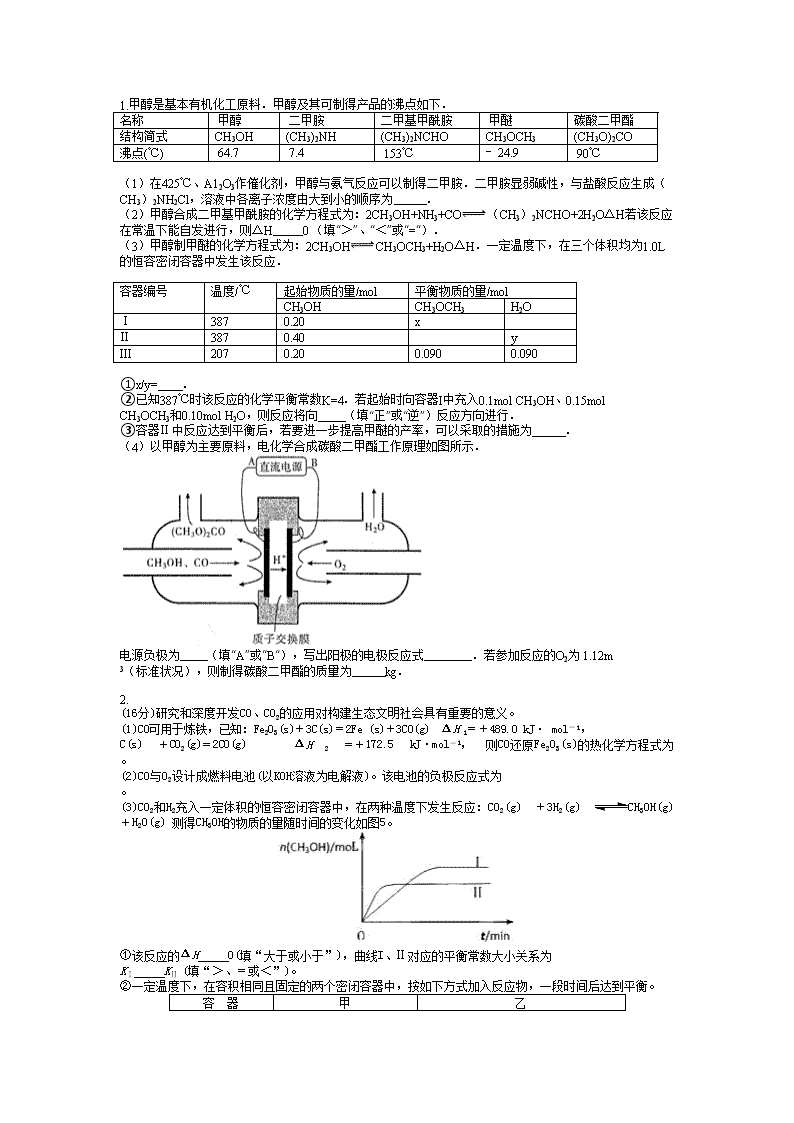
电源负极为 (填“A”或“B“),写出阳极的电极反应式 .若参加反应的O2为 1.12m 3(标准状况),则制得碳酸二甲酯的质量为 kg.
2.
(16分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe (s)+3CO(g) ΔH 1=+489.0 kJ· mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1, 则CO还原Fe2O3(s)的热化学方程式为 。
(2)CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为 。
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。
①该反应的ΔH 0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为
KⅠ KⅡ (填“>、=或<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器
甲
乙
反应物投入量
1 mol CO2、3 mol H2
a molCO2、3a molH2、
b molCH3OH(g)、b molH2O(g)
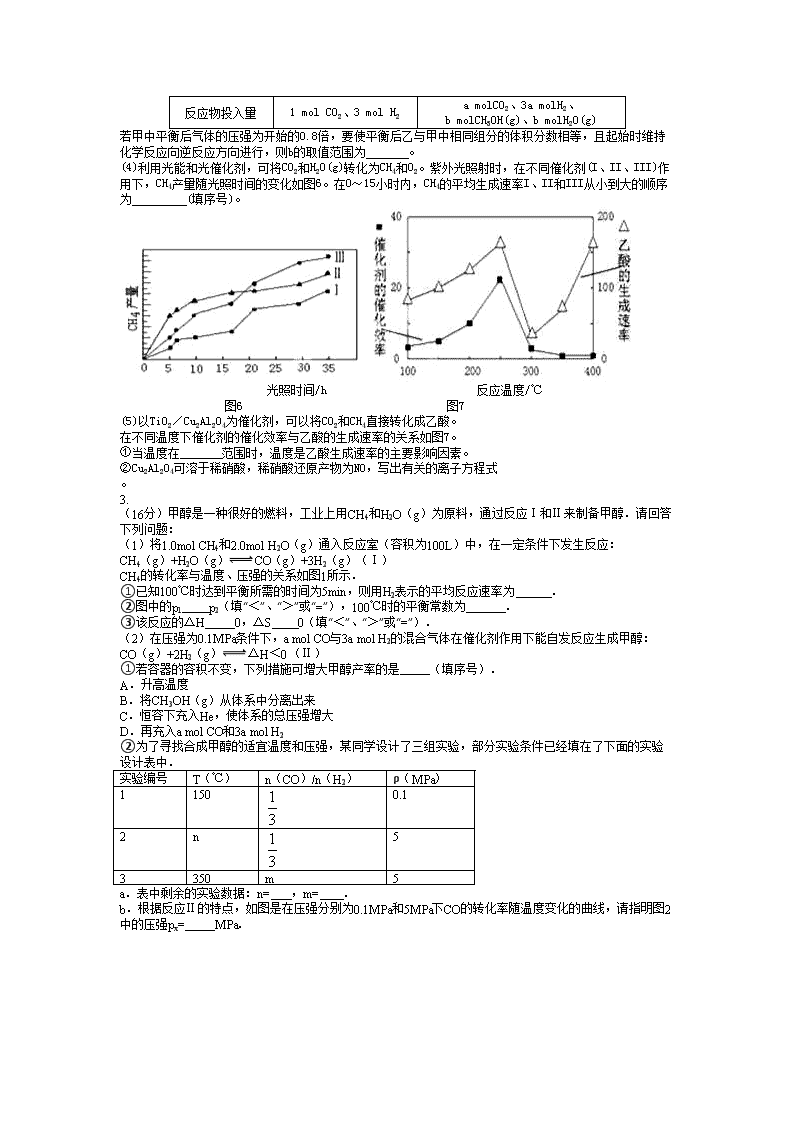
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图6。在0~15小时内,CH4的平均生成速率I、II和III从小到大的顺序为 (填序号)。
光照时间/h 反应温度/℃
图6 图7
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图7。
①当温度在 范围时,温度是乙酸生成速率的主要影响因素。
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式 。
3.
(16分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:
CH4(g)+H2O(g)CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 .
②图中的p1 p2(填“<”、“>”或“=”),100℃时的平衡常数为 .
③该反应的△H 0,△S 0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)△H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是 (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
实验编号
T(℃)
n(CO)/n(H2)
ρ(MPa)
1
150
0.1
2
n
5
3
350
m
5
a.表中剩余的实验数据:n= ,m= .
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px= MPa.
图1 图2
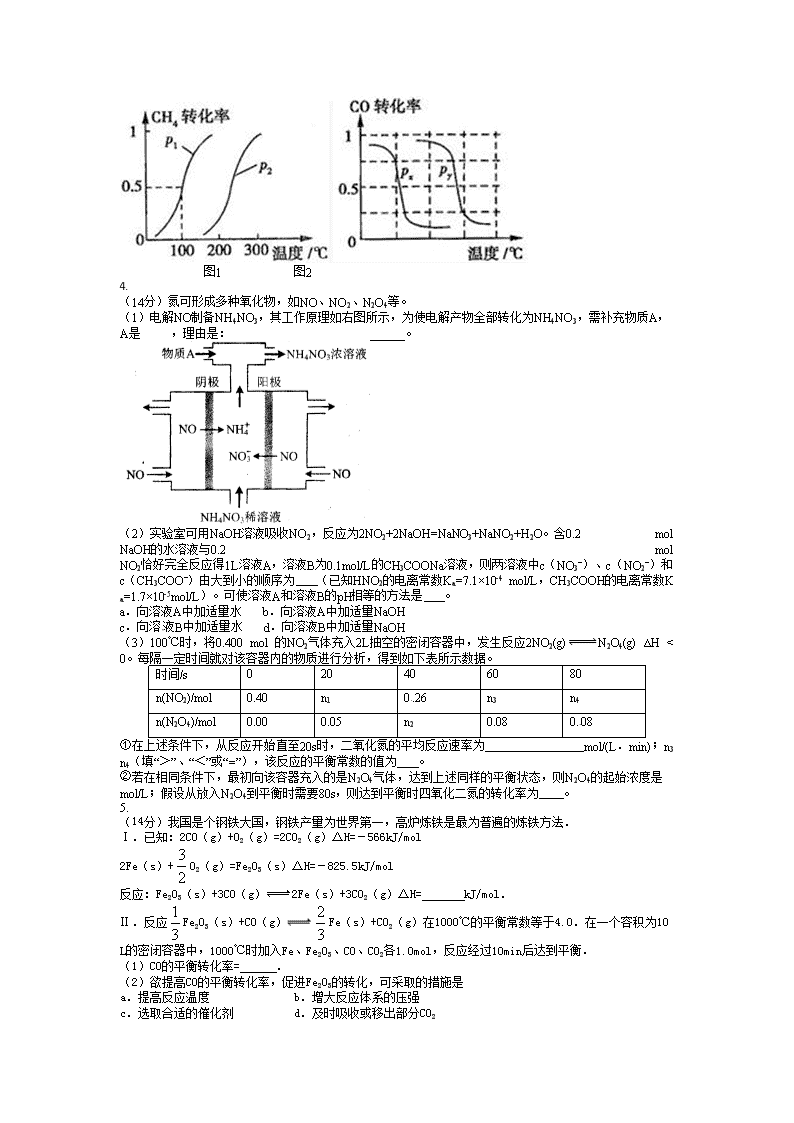
4.
(14分)氮可形成多种氧化物,如NO、NO2、N2O4等。
(1)电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____,理由是:_____________________________。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2‾)和c(CH3COO‾)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400 mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
时间/s
0
20
40
60
80
n(NO2)/mol
0.40
n1
0.26
n3
n4
n(N2O4)/mol
0.00
0.05
n2
0.08
0.08
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol/(L.min);n3 n4(填“>”、“<”或“=”),该反应的平衡常数的值为 。
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是 mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为 。
5.
(14分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
Ⅰ.已知:2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
2Fe(s)+O2(g)=Fe2O3(s)△H=﹣825.5kJ/mol
反应:Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H= kJ/mol.
Ⅱ.反应Fe2O3(s)+CO(g)Fe(s)+CO2(g)在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率= .
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)CH3OH(g).请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= .
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器
反应物投入的量
反应物的转化率
CH3OH的浓度
能量变化
(Q1,Q2,Q3均大于0)
甲
1mol CO和2mol H2
a1
c1
放出Q1kJ热量
乙
1mol CH3OH
a2
c2
吸收Q2kJ热量
丙
2mol CO和4mol H2
a3
c3
放出Q3kJ热量
则下列关系正确的是 .
A c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入1 molCO、2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式 CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O .
6.
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2( L )+2N2O4(L )=2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)该反应(Ⅰ)中还原剂是 .
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)2NO2(g) (Ⅱ)
一定温度下,反应(Ⅱ)的焓变为△H.现将2 molNO2充入一恒压密闭容器中,如图示意图正确且能说明反应达到平衡状态的是
A B C D
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”“不变”或“减小”),反应4s后N2O4的物质的量为0.9mol,则0~4s内的平均反应速率v(NO2)=
(3)25℃时,将1mol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示).向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将 (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为 mol•L﹣1.(NH3•H2O的电离平衡常数K=2×10﹣5 mol•L﹣1)
7.
(15分)我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化。回答下列问题:
(1)煤的主要成分为碳氢化合物,若用CH代表煤的“分子式”
,写出煤与水蒸气生成水煤气的化学方程式:_______________________________.
(2)已知:
煤炭在氧气氛围中气化 2CH(s)+O2(g)=2CO(g)+H2(g) ΔH1
气化后的气体合成甲醇 CO(g)+2H2(g)= CH3OH(g) ΔH2
甲醇制备丙烯的反应 3CH3OH(g)=C3H6(g)+3H2O(g) ΔH3
则煤在氧气氛围中反应直接生成丙烯、水蒸气和CO的热化学方程式为______________.
(3)科研小组利用某恒容密闭容器进行CO和H2合成甲醇的探究。若容器容积为VL,加入CO和H2的物质的量之比为1:2,在催化剂的作用下发生反应:
CO(g)+2H2(g) CH3OH(g)
下图为反应达到平衡时CO的转化率与温度、压强的关系:
①上述CO和H2合成甲醇的反应为____________________(填“放热”或“吸热”)反应,图像中压强( pl,p2,p3)的大小顺序为____________________.
②温度为100℃时,加入n mol CO与2n mo1 H2,达到平衡时压强为pl,则该反应的平衡常数K=_________________(用含n、V的式子表示);在温度不变的条件下,向该容器中再加人n mol CO与2n mo1 H2,再次达到平衡时,CO的转化率(填“增大”、“减小”或“不变”)。
③如果要提高CO的转化率,除改变温度、压强外,还可以采取的措施有_______、_________。
8.
(12分)低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃
400
500
850
平衡常数
9.94
9
1
请回答下列问题:
(1)该反应逆反应的化学平衡常数表达式为K= .
(2)上述正反应方向是 反应(填“放热”或“吸热”).
(3)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图,则0~4min的平均反应速率v(CO)= mol•L﹣1•min﹣1.
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于 状态;C1数值 0.08mol•L﹣1(填大于、小于或等于).
②反应在4min~5min,平衡向逆方向移动,可能的原因是 (单选),表中5min~6min之间数值发生变化,可能的原因是 (单选).
A.增加水蒸气B.降低温度 C.使用催化剂D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol•L﹣1,在该条件下,CO的最大转化率为: .
时间(min)
CO
H2O
CO2
H2
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
c1
c2
c3
c3[m]
4
c1
c2
c3
c3
5
0.116
0.216
0.084
6
0.096
0.266
0.104
9.甲醇是未来重要的绿色能源之一.以CH4和H2O为原料,通过下列反应来制备甲醇.
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g) △H=﹣129.0KJ/mol
(1)CH4(g)与 H2O(g)反应成CH3OH(g)和H2(g)的热化学方程式为 .
(2)将1.0mol CH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1.
①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,平衡将 移动(填“正向”、“逆向”或“不”).
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3mol H2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为a L.
①反应达到平衡后,A内压强为起始压强的,则平衡时A容器中H2的体积分数为 .
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6a L,则打开K2之前,B容器的体积为 L.
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将CO2+氧化成CO3+,然后以CO3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图3装置模拟上述过程:
①写出阳极电极反应式 ;
②写出除去甲醇的离子方程式 .
10.氮元素的化合物应用十分广泛.请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水.已知室温下,1g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 .
(2)298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)N2O4(g)△H=﹣a kJ/mol(a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为 (精确到0.01).
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变; B.混合气体的颜色不再变化; C.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)=0.6moln(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”).
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol·L﹣1NH4HSO4溶液中滴加0.1mol·L﹣1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d、e五个点.
①b点时,溶液中发生水解反应的离子是 ;
②在c点,溶液中各离子浓度由大到小的排列顺序 .
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”).
11.(1)在2L的密闭容器中,由CO2和H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,
实验结果如图1所示(注:T2>T1,均大于300℃).
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为 .
②通过分析图1,温度对反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的影响可以概括为 .
③下列情形能说明上述反应已达到平衡状态的是 (填字母).
A.体系压强保持不变
B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存
C.CH3OH与H2物质的量之比为1:3
D.每消耗1mol CO2的同时生成3mol H2
④已知H2(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJ·mol﹣1和﹣726.5kJ·mol﹣1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式: .
(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示.
①该反应的平衡常数表达式K=,250℃、0.5×104 kPa下的平衡常数 (填“>”、“<”或“=”)300℃、1.5×104 kPa下的平衡常数.
②实际生产中,该反应条件控制在250℃、1.3×104 kPa左右,选择此压强而不选择更高压强的理由是 .
12.
(I)在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)⇌2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol.回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; 熵变△S 0 ( 填:“<,>,=”).该反应在 (填高温或低温)条件下能自发进行.
该反应的v﹣t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v﹣t图象如图2中右图所示.以下说法正确的是
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是 .
A. A、C两点的反应速率:A>C B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C D. 由状态B到状态A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g)+nB(g)⇌pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa 2×105 5×105 1×106
c(A)/mol•L﹣1 0.08 0.20 0.44
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左,向右,不)
维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
(3)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强).
13.
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)═2SO3(g)△H<0
(1)如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示.根据图示回答下列问题:
该反应的平衡常数的表达式为 ,平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”).
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是 (填字母).
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、SO3的物质的量之比为2:1:2
D.接触室中压强不随时间变化而变化
(4)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
14.
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为 ________________ 。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(选填序号)
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如右图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“ <”或“=”)。纵坐标可以表示的物理量有哪些 。
a.H2的逆反应速率 b.CH4的的体积分数
c.混合气体的平均相对分子质量 d.CO的体积分数
(3) 工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H22NH3 ,该过程中还原反应的方程式为 。
(4) 若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如右图所示,下列有关说法正确的是
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③ HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO)>c(OH)> c(H+)
15.
I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H= -574 kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H= -1160 kJ·mol-l
③H2O(l)=H2O(g) △H=+44kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____ 。
II、开发新能源和三废处理都是可持续发展的重要方面。
CO在催化剂作用下可以与H2反应生成甲醇:
CO(g)+2H2(g) CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
(1)M、N两点平衡状态下,容器中物质的总物质的
量之比为:n(M)总:n(N)总= 。
(2)若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 ;
P1 P2 (填“>” 或“<” 或“=”)
III、用MnO2制KMnO4的工艺流程如下图:
电解池中两极材料均为碳棒,在中性或酸性溶液中K2MnO4发生歧化反应而变成MnO2和KMnO4。
(1)写出240℃熔融时发生反应的化学方程式 ;
投料时必须满足n(KOH):n(MnO2) 。
(2)阳极的电极反应式为 。
(3)B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
16.
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
氢氧化物
Cu(OH)2
Fe(OH)3
Fe(OH)2
Mg(OH)2
Ksp
2.2×10-20
4.0×10-38
8.0×10-16
1.8×10-11
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示)。
(2)实验室制备氨气的化学方程式为 。工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为 。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
温度(K)
平衡时NH3的物质的量(mol)
T1
2.4
T2
2.0
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。若再增加氢气浓度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量()、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
17.
煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣)
91:9
1:1
9:91
pH
8.2
7.2
6.2
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
b.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H﹣)=c(OH﹣)
c.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4 (s)+ CO (g) CaO(s) + SO2 (g) + CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) △H2= -175.6kJ·mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s) 的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。
A、向该反应体系中投入生石灰 B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数 D、提高反应体系的温度
18.化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)2NH3(g) 。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间的变化如下图所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①
相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
a.增大压强 b.减小压强 C.升高温度d.降低温度 e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g)N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol·L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol·L的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3H2O的电离平衡常数=___________。
19.甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ•mol﹣1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) △H=﹣129.0kJ•mol﹣1
(1)将1.0mol CH4和1.0mol H2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图.
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
(2)在压强为0.1MPa、温度为300℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的,其他条件不变,对平衡体系产生的影响是 (填字母序号)
A.平衡常数K增大
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡c减小
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.
若图2装置中的电源为甲醇一空气﹣KOH溶液的燃料电池,则电池正极的电极反应式: ,该电池工作时,溶液中的OH﹣向 极移动.净化合1mol甲醇的水,燃料电池转移电子 mol.写出净化甲醇的离子方程式 .
20.
目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2
,引起全世界的关注:(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平: ;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
实验组
温度/℃
起始量/mol
平衡量/mol
达到平衡所
需时间/min
H2O
CO
H2
CO
1
650
2
4
1.6
2.4
5
2
900
1
2
0.4
1.6
3
①实验2条件下的H2O 体积分数为 ;
②下列方法中可以证明上述已达平衡状态的是 ;
a .单位时间内生成n mol H2的同时生成n mol CO b. 容器内压强不再变化
c.混合气体密度不再变化 d.混合气体的平均相对分子质量不再变化
e. CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表
则反应CO(g)+H2O(g)CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _.
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是________。
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH—)相等
B.①点时pH=6,此时溶液中,c(CH3COO—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO—)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO—)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
21.甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ•mol﹣1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) △H=﹣129.0kJ•mol﹣1
(1)将1.0mol CH4和1.0mol H2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图.
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
(2)在压强为0.1MPa、温度为300℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的,其他条件不变,对平衡体系产生的影响是 (填字母序号)
A.平衡常数K增大
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡c减小
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.
若图2装置中的电源为甲醇一空气﹣KOH溶液的燃料电池,则电池正极的电极反应式: ,该电池工作时,溶液中的OH﹣向 极移动.净化合1mol甲醇的水,燃料电池转移电子 mol.写出净化甲醇的离子方程式 .
22.碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:
Ni (s)+4CO(g)Ni(CO)4(g),ΔH<0。
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,ΔH减小
C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低
D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:CO (g)+O2(g)=CO2(g) ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
则SO2(g)+2CO (g)=S(s)+2CO2(g) ΔH= 。
(3)对于反应:2NO(g)+O22NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
①比较P1、P2的大小关系:________________。
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为_____(最简分数形式)
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
23.
在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)═2NO2(g)
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如图1所示.
图1
①A点的逆反应速率v逆 (O2) B点的正反应速率v正(O2)(填“大于”、“小于”或“等于”).
②NO的平衡转化率为 ;当达到B点后往容器中再以4:1加入些NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于”).
③到达B点后,下列关系正确的是
A.容器内气体颜色不再变化 B.v正(NO)=2v正(O2)
C.气体平均摩尔质量在此条件下达到最大 D.容器内气体密度不再变化
(2)在图2中出现的所有物质都为气体,分析图2,可推测:4NO(g)+3O2(g)═2N2O5(g)△H=
图2
(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如图3所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: .
图3
24.
(16分)(1)氨催化氧化法是工业制硝酸的主要方法,可进行连续生产.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式: .
(2)恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
t/K
298
398
498
…
K
4.1×106
K1
K2
…
①写出合成氨反应N2(g)+3H2(g)2NH3(g)的平衡常数表达式:
②上表中K1 K2(填“>”、“=”或“<”).
(3)如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图.
①下列说法正确的是 (填序号).
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2)=3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为 .
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式 .
(5)25℃时,Ksp[Mg(OH)2]=5.61×10﹣12,Ksp[MgF2]=7.42×10﹣11.下列说法正确的是 .
A.25℃时,饱和Mg(OH)2溶液中c(OH﹣)大于饱和MgF2溶液中c(F﹣)
B.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol•L﹣1,则溶液的pH=9
C. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2.
25.
(14分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
Ⅰ.已知:2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
2Fe(s)+O2(g)=Fe2O3(s)△H=﹣825.5kJ/mol
反应:Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H= kJ/mol.
Ⅱ.反应 Fe2O3(s)+CO(g)Fe(s)+CO2(g)在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率= .
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)CH3OH(g).请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= .
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器
反应物投入的量
反应物的转化率
CH3OH的浓度
能量变化
(Q1,Q2,Q3均大于0)
甲
1mol CO和2mol H2
a1
c1
放出Q1kJ热量
乙
1mol CH3OH
a2
c2
吸收Q2kJ热量
丙
2mol CO和4mol H2
a3
c3
放出Q3kJ热量
则下列关系正确的是 .
A c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入1 molCO、2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式 .
26.
(14分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体.甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡.甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等.
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)CH3OH(l)+H2O (g)△H=Q1kJ•mol﹣1
又查资料得知:①CH3OH(l)+1/2O2(g)CO2(g)+2H2(g)△H=Q2kJ•mol﹣1
②H2O(g)=H2O(l)△H=Q3kJ•mol﹣1,则表示甲醇的燃烧热的热化学方程式为 .
(2)工业上可用CO和H2O(g)来合成CO2 和H2,再利用(1)中反应原理合成甲醇.某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g)CO2(g)+H2(g)△H>0,当反应进行到10min时达到平衡,此时测得H2为0.6mol.回答下列问题:
①0~10min内H2O(g)的平均反应速率为 .
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 .
a.升高温度
b.缩小容器的体积
c.增大H2O (g)的浓度
d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 .
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置.已知:A、B、C、D、E、F都是惰性电极,丙中为0.1mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色.回答下列问题:
①a物质是 ,A电极的电极反应式为 .
②乙装置中的总化学反应方程式为 .
③当乙装置中C电极收集到224mL(标况下)气体时,丙中溶液的pH= .
27.
(13分)硫、碳、氮等元素及其化合物与人类的生产生活密切相关,其中.硫酸、氨气、硝酸都是重要的化工原料.而SO2、NO、NO2、CO等相应氧化物又是主要的环境污染物:
(1)过度排放CO2会造成“温室效应”,而煤的气化是高效、清洁利用煤炭的重要途径.煤综合利用的一种途径如图1所示.
已知:C(s)+H2O(g)=CO(g)+H2(g) AH1=+131.3kJ•mol﹣
C(s)十2H20(g)=C02(g)+2H2(g) AH2=+90kJ•mol﹣
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
(2)298K时.将氨气放入体积固定的密闭容器中使其发生分解反应.当反应达到平衡状态后.改变其中一个条件X.Y随X的变化符合图2中曲线的是 (填字号):
a.当X表示温度时,Y表示氨气的物质的量
b.当X表示压强时.Y表示氨气的转化率
c.当X表示反应时间时.Y表示混合气体的密度
d.当x表示氨气的物质的量时.Y表示某一生成物的物质的量
(3)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染.必须经脱除达标后才能排放:
能作脱除剂的物质很多.下列说法正确的是 (填序号):
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
d.用尿素[CO(NH2)2]作脱除剂.在一定条件下能有效将NOx氧化为N2
(4)在压强为O.1MPa条件下,容积为V L的密闭容器中,amol CO与2amol H2在催化剂作用下
反应生成甲醇.反应的化学方程式为CO(g)+2H2(g)CH3OH(g),CO的平衡转比率与温度、压强的关系如图3所示,则:
①P1 P2(填“>”“<”或“=”).
②在其他条件不变的情况下,向容器中增加a molCO与2amol H2.达到新平衡时.CO的转化率 (填“增大””减小”或“不变”.下同),平衡常数 .
③在P1下、100℃时,CH3OH(g)CO(g)十2H2(g)的平衡常数为 (用含a、V的代数式表示).
(5)①常温下.若将2mol NH3(g)和l mol CO2(g)通入1L水中.可得pH=10的溶液,则该溶液中浓度最大的阴离子是 ;
②常温下,将O.01mol•L﹣ NaOH溶液和0.01mol•L﹣(NH4)2SO4溶液等体积混合.所得溶液pH为10,那么该混合液中c(Na+)+c(NH4+)= mol•L﹣1(填准确代数式.不能估算).
28.
(16分)二氧化碳是一种宝贵的碳氧资源.以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例.在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)NH2CO2NH4(s)△H1=a kJ•mol﹣1
反应Ⅱ:NH2CO2NH4(s)CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol﹣1
总反应Ⅲ:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H3=﹣86.98kJ•mol﹣1
请回答下列问题:
(1)反应Ⅰ的△H1= kJ•mol﹣1(用具体数据表示).
(2)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比和温度影响CO2平衡转化率变化的趋势曲线.
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是 (填提高或降低)水碳比.
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是 .
(3)反应Ⅰ的平衡常数表达式K1= .
(4)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图2所示.若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡).
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O(NH4)2CO3.下列物质中与尿素有类似性质的是 .
A.NH2COONH4 B.H2NOCCH2CH2CONH2 C.HOCH2CH2OH D.HOCH2CH2NH2
(6)某研究小组为探究反应III中氨碳比的影响,图3为某特定条件下,当氨碳比=4,CO2的转化率随时间的变化关系.
①A点的逆反应速率v逆(CO2) B点的正反应速率为v正(CO2)(填“大于”、“小于”或“等于”)
②NH3的平衡转化率为 .
(7)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图4.阳极室中发生的反应为 、 .
29.
(11分)雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)2NO(g) △H1= a kJ·mol-1
②CO(g)+1/2 O2(g)CO2(g) △H2= c kJ·mol-1
③2CO(g)+2NO(g)N2(g)+2CO2(g) △H3
请回答下列问题:
(1)△H3=_________kJ·mol-1(用含a、b的代数式表示)。
(2)对于有气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的平衡常数表达式Kp=___________。
(3)能说明反应③已达平衡状态的标志是________(填字母)。
A.单位时间内生成1mol CO2的同时消耗了lmol CO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)在一定温度下,向体积为VL的恒容密闭容器中充入一定量的NO和CO,发生反应③。在t1时刻达到平衡,此时n(CO)=xmol,n(NO)=2xmol,n(N2)=ymol,则NO的平衡转化率为_____(用含x、y的代数式表示);再向容器中充入ymolCO2和xmolNO,则此时v(正)____(填“>”、“<”或“=”)v(逆)。
(5)烟气中也含有氮氧化物,C2H4可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度约为___,Cu2+负载量为_________。
30.
(12分)甲醇是重要的化工原料,又可做为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
Ⅰ CO(g)+2H2(g)CH3OH(g) ∆H1
Ⅱ CO2(g)+3H2(g)CH3OH(g)+H2O(g) ∆H2=-58kJ/mol
Ⅲ CO2(g)+H2(g)CO(g)+H2O(g) ∆H3
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热。即化学反应热:∆H=生成物标准生成热总和-反应物标准生成热总和。
已知四种物质的标准生成热如下表:
物质
CO
CO2
H2
CH3OH(g)
标准生成热(kJ/mol)
-110.52
-393.51
0
-201.25
A.计算∆H1=_______kJ/mol B.∆H3______0(填=、<、>)
(2)由甲醇在一定条件下制备甲醚。一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)。实验数据见下表:
容器编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
CH3OCH3(g)
H2O(g)
a
387
0.20
0
0
0.080
0.080
b
387
0.40
0
0
c
207
0.20
0
0
0.090
0.090
下列说法正确的是__________
A.该反应的正反应为放热反应
B.达到平衡时,容器a中的CH3OH体积分数比容器b中的小
C.容器a中反应到达平衡所需时间比容器c中的长
D.若起始时向容器a中充入CH3OH 0.15mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示。
①α(CO)值随温度升高而____(填“增大”或“减小”),其原因是_________。
②图中P1、P2、P3的大小关系为______,其判断理由是______。
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是:_____;若以硫酸作为电解质其负极反应为:_________。
31.
(16分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为_____________;
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为_____________;
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1。
①该反应的△H_____________0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____________KⅡ(填“>、=或<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
容器
甲
乙
反应物投入量
1mol CO2、3mol H2
a mol CO2、3a mol H2、
b mol CH3OH(g)、b mol H2O(g)
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为_____________;
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在_____________范围时,温度是乙酸生成速率的主要影响因素;
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式_____________。
32.
(15分)化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________________________。
(2)已知反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃)
500
700
900
K
1.00
1.47
2.40
①该反应的化学平衡常数K的表达式为 ,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有 。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
33.
(15分)
氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化。
(l)从N2O5可通过电解或臭氧氧化N2O4的方法制备。电解装置如图所示(隔膜用于阻止水分子通过),其阳极反应式为 。
己知:2NO(g)+O2(g)=2NO2(g) △H1
NO(g)+O3(g)=NO2(g)+O2(g) △H2
2NO2(g)N2O4(g) △H3
2N2O5(g)=4NO2(g)+O2(g) △H4
则反应N2O4(g)+O3(g)=N2O5(g)+O2(g)的△H= 。
(2)从N2O5在一定条件下发生分解:2N2O5(g)=4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min
0.00
1.00
2.00
3.00
4.00
5.00
c(N2O5)/(mol·L-1)
1.00
0.71
0.50
0.35
0.25
0.17
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p:p0= ;1.00一3.00min内,O2的平均反应速率为 。
(3)从N2O4与NO2之间存在反应N2O4(g)2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由 ,
若要提高试N2O4,除改变反应温度外,其他措施有 (要求写出两条)。
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:u(N2O4)=k1·p(N2O4),u(NO2)=k2·[p(NO2)]2。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示:
一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在上图标出的点中,指出能表示反应达到平衡状态的点并说明理由 。
34.
(14分)雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式
NO/N≡O
CO/C≡O
CO2/O=C=O
N2/N≡N
化学键
N≡O
C≡O
C=O
N≡N
键能(KJ/mol)
632
1072
750
946
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH= kJ/mol
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是 (填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s
0
1
2
3
4
5
n(NO)/×l0-2mol
10.0
4.50
2.50
1.50
1.00
1.00
n(CO)/×l0-1mol
3.60
3.05
2.85
2.75
2.70
2.70
t1℃时该反应的平衡常数K= ,既能增大反应速率又能使平衡正向移动的措施是 。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式 。
图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响 ,给出合理的解释: 。
35.
CO2 加氢合成甲醇可有效利用CO2.由CO2制备甲醇过程涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
反应Ⅱ:CO2(g)+H2(g)CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=﹣90.77kJ•mol﹣1
回答下列问题:
(1)△H2= kJ/mol;升高温度会使反应Ⅱ向 (填“正”、“逆”)方向移动.
(2)一定条件下在3L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如图1所示:
①H2和CO2的起始的投入量以A和B两种方式投入:
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线Ⅱ代表 (填“A”或“B”)投入方式.
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3molH2和0.9mol
CO2、0.6molCH3OH、xmolH2O,若使反应在开始时能正向进行,则x应满足的条件是 .
b.在此条件下,系统中CH3OH的浓度随时间的变化如图2所示,当反应时间达到3min时,迅速升温至600K,请在图2中画出3~10min内容器中CH3OH浓度变化曲线.
(3)新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子(O2﹣)在其间通过.如图3所示,其中多孔电极不参与电极反应.
①该电池的负极反应式为 .
②如果用该电池作为电解装置,当有16g甲醇发生反应时,则理论上提供的电量表达式为 C(1个电子的电量为1.6×10﹣19C).
图3
36.
近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
活性炭
NO
E
F
T1
2.000
0.040
0.030
0.030
T2
2.005
0.050
0.025
0.025
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应的平衡常数表达式K= ,根据上述信息判断,T1和T2的关系是 .
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示:
图1
图2
①用离子方程式表示反应器中发生的反应: .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是
.
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.通过a气体的电极是原电池的 极(填“正”或“负”),b电极反应式为 .
37.
(15分)自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展。
(1)下表列举了不同温度下大气固氮的部分平衡常数K值。
①分析数据可知:大气固氮反应属于____(填“吸热”或“放热”)反应。
②2260℃时,向2 L密闭容器中充入0.3mol N2和0.3mol O2,20 s时反应达平衡。则此
时得到NO mol,用N2表示的平均反应速率为 。
(2)已知工业固氮反应:N2 (g)+3H2 (g) 2NH3 (g) △H<0,在其他条件相同时,分
别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中
正确的是____(填“A”或“B”),T1 T2(填“>”或“<”)。
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它
内外表面上的金属钯多晶薄膜做电极,通过电解实现高温常压下的电化学合成氨。其示
意图如C所示,阴极的电极反应式为
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:
2N2 (g) +6H2 0(l) 4NH3 (aq) +3O2 (g) △H
已知:N2 (g)+3H2 (g) 2NH3 (g) △H1
2H2 (g) +O2 (g) 2H2O(1) △H2
NH3 (g)NH3 (aq) △H3
则△H= (用含△H1、△H2、△H3的式子表示)。
38.
(14分)氮的固定对工农业及人类生存具有重大意义。
Ⅰ.合成氨是最重要的人工固氮: N2(g)+3H2(g) 2NH3(g)。
(1)下列关于该反应的说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定温度下,在容积为1L的密闭容器中,加入ImolN2和3molH2,反应达到平衡时H2的转化率为60%,则此条件下反应的平衡常数K= (此处不要求写单位);保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,氢气的转化率将 (填“增大”、“减小”或“不变”)
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中.则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学方程式为 。
II.随着研究的不断深入,科学家发明了越來越多有关氮的固定方法。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如下,阴极的电极反应式为 。
(6)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(I) 4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g) 2H2O(I) △H=-571.6kJ·mol-1)
39.
(14分)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH− FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH−)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c( Na2FeO4)低于最高值的原因:_____________。
40.
煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中.
(1)已知:
①C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol﹣1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.3kJ•mol﹣1
则炭与水蒸气反应生成二氧化碳和氢气的热化学方程式为 .该反应在 (填“高温”“低温”或“任何温度”)下有利于正向自发进行.
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)N2(g)+CO2(g).某研究小组向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如表所示:
时间(min)
浓度(mol•L﹣1)
0
10
20
30
40
50
NO
1.00
0.68
0.50
0.50
0.60
0.60
N2
0
0.16
0.25
0.25
0.30
0.30
CO2
0
0.16
0.25
0.25
0.30
0.30
①10~20min内,N2的平均反应速率v(N2)= .
②30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是 (填选项字母).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g)H2(g)+CO2(g)平衡常数随温度的变化如表所示:
温度/℃
400
500
800
平衡常数K
9.94
9
1
若反应在500℃时进行,设起始的CO和H2O的浓度均为0.020mol•L﹣1,在该条件下CO的平衡转化率为 .
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
①乙中A极析出的气体在标准状况下的体积为 .
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是 (填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0mol•L﹣1NaOH溶液.36.(化学)
三、计算题(本题共1道小题,第1题0分,共0分)
四、实验题(本题共11道小题,第1题0分,第2题0分,第3题0分,第4题0分,第5题0分,第6题0分,第7题0分,第8题0分,第9题0分,第10题0分,第11题0分,共0分)
五、问答题(本题共1道小题,第1题0分,共0分)
六、判断题(题型注释)
七、未审核(本题共4道小题,第1题0分,第2题0分,第3题0分,第4题0分,共0分)
试卷答案
1.
(1)c(Cl﹣)>c[(CH3)2NH2+]>c(H+)>c(OH﹣);
(2)<;
(3)①;
②正;
③降温;
(4)B;2CH3OH+CO﹣2e﹣=(CH3O)2CO+2H+;9.00.
考点:化学平衡的计算;原电池和电解池的工作原理;化学平衡的影响因素.
分析:(1)二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,[(CH3)2NH22+]离子水解溶液显酸性,据此判断溶液中各离子浓度大小;
(2)反应自发进行的判断依据为:△H﹣T△S<0分析;
(3)①2CH3OHCH3OCH3+H2O,反应前后物质的量不变,容器Ⅰ,Ⅱ在相同条件下进行,反应前后物质的量不变,起始量Ⅱ为Ⅰ的2倍,生成物质物质的量也为二倍;
②计算此时浓度商,和平衡常数比较方向判断反应进行方向;
③依据图表 和平衡常数计算容器Ⅰ中甲醚物质的量,和容器Ⅲ比较方向温度变化,甲醚物质的量的变化分析;
(4)图分析可知氢离子移向阴极,则与此电极连接的为负极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应,依据电子守恒计算.
解答:解:(1)二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,[(CH3)2NH22+]离子水解溶液显酸性,据此判断溶液中各离子浓度大小为:c(Cl﹣)>c[(CH3)2NH2+]>c(H+)>c(OH﹣);
故答案为:c(Cl﹣)>c[(CH3)2NH2+]>c(H+)>c(OH﹣);
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO(CH3)2NCHO+2H2O,该反应在常温下能自发进行,△S<0,△H﹣T△S<0则△H<0,
故答案为:<;
(3)①2CH3OHCH3OCH3+H2O,反应前后物质的量不变,容器Ⅰ,Ⅱ在相同条件下进行,反应前后物质的量不变,起始量Ⅱ为Ⅰ的2倍,生成物质物质的量也为二倍,所以x:y=1:2,
故答案为:;
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,浓度商Qc==1.5<K=4,则反应将向正反应进行,
故答案为:正;
③Ⅰ中 设生成甲醚为物质的量x
2CH3OHCH3OCH3+H2O
起始量(mol) 0.2 0 0
变化量(mol) 2x x x
平衡量(mol)0.2﹣2x x x
K==4
x=0.08mol,
和Ⅲ比较,起始量相同,温度降低平衡正向进行,正反应为放热反应,降低温度提高甲醚的产率,
故答案为:降温;
(4)图分析可知氢离子移向阴极,则与此电极连接的B电极为负极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:2CH3OH+CO﹣2e﹣=(CH3O)2CO+2H+,若参加反应的O2为 1.12m 3(标准状况),物质的量==50mol,电子转移50mol×4=200mol,则制得碳酸二甲酯的质量=100mol×90g/mol=900g=0.900kg,
故答案为:B;2CH3OH+CO﹣2e﹣=(CH3O)2CO+2H+;9.00.
点评:本题考查了盐类水解分析,电解原理的分析计算,化学平衡的平衡常数计算应用,掌握甲醇是关键,题目难度中等.
2.
(1) Fe2O3 (s)+ 3CO(g)=2Fe(s)+ 3CO2 (g) △H =-28.5 kJ·mol-1
(2)CO + 4OH-― 2e-= CO32-+ 2H2O(3)①> < ②0.4<c≤1(4)II>III>I
(5)①300℃~400℃ ②3Cu2Al2O4+32H++2NO3-= 6Cu2++ 6Al3++2NO↑+16H2O
解析:(1) 根据盖斯定律,热化学方程式①-②×3,得出Fe2O3 (s)+ 3CO(g)=2Fe(s)+ 3CO2 (g) △H =-28.5 kJ·mol-1
(2)负极失去电子,CO为负极产生CO32-,氧气为正极,负极为CO + 4OH-― 2e-= CO32-+ 2H2O
(3)①由图像判断Ⅱ温度高于I,但I甲醇物质的量多,温度高平衡正向移动,平衡常数大,正反应吸热;该反应的ΔH>0,KⅠ0.4,C最高为1,所以C的取值范围为0.4<c≤1
(4) 由图Ⅱ可知,CH4的平均生成速率顺序为II>III>I
(5)①从300℃开始,催化剂对反应基本没有影响,温度升高,生成乙酸速率增大,所以①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素;②Cu2Al2O4中铜为+1价,与硝酸反应被氧化为+2价,硝酸被还原为NO。反应的离子方程式为3Cu2Al2O4+32H++2NO3-= 6Cu2++ 6Al3++2NO↑+16H2O。
3.
(1)①0.0030mol•L﹣1•min﹣1;
②<;2.25×10﹣4;
③>,>;
(2)①BD
②n=150,;
③0.1.
考点:化学平衡建立的过程;化学平衡的影响因素;化学平衡的调控作用.
专题:化学平衡专题.
分析:(1)①根据v=计算氢气的平均反应速率;
②该反应是反应前后气体体积增大的反应,相同温度下,增大压强,平衡向气体体积减小的方向移动,根据甲烷的转化率确定压强大小;平衡常数等于生成物浓度幂之积与反应物浓度幂之积之比;
③一定压强下,升高温度平衡向吸热反应方向移动,根据转化率判断反应热;反应前后,气体的物质的量越大,其熵变越大;
(2)①容器容积不变,增加甲醇产率,平衡向正反应移动,根据外界条件对平衡的影响分析.
②采取控制变量法,探究合成甲醇的温度和压强的适宜条件,据此判断n、m的值.
③根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断.
解答:解:(1)①根据v(H2)=3v(CH4)=3×=0.0030mol•L﹣1•min﹣1,故答案为:0.0030mol•L﹣1•min﹣1;
②根据化学方程式可以得出,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以去200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.01 0.02 0 0
变化浓度:0.005 0.005 0.005 0.015
平衡浓度:0.005 0.015 0.005 0.015
100℃时平衡常数=(mol/L)2=2.25×10﹣4 (mol/L)2,
故答案为:<;2.25×10﹣4;
③一定压强下,升高温度平衡向正反应方向移动,则正反应是吸热反应,所以△H>0;正反应是气体物质的量增大的反应,气体的物质的量越多,其熵越大,所以△S>0,故答案为:>,>;
(2)①A、该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B、将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B正确;
C、充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D、再充入amol CO和3amol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确.
故选:BD
②A、采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,应保持不变,所以m=,比较使用1、2,压强不同,所以温度应相同,故n=150,故答案为:n=150,;
③温度相同时,作垂直x轴的辅助线,发现压强为Py的CO的转化率高,反应为前后体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应移动,所以Px<Py,所以压强Px=0.1MPa.
故答案为:0.1.
点评:本题考查化学反应速率、平衡常数、化学平衡计算、化学平衡的影响因素及读图能力等,综合性较大,难度中等,知识面广,应加强平时知识的积累.注意控制变量法与定一议二原则应用.
4.
(1)NH3,根据反应:8NO + 7H2O =3NH4NO3 + 2HNO3,电解产生的硝酸多,需补充NH3;(2)c(NO3‾) > c(NO2‾) > c(CH3COO‾),b、c;(3)①0. 0025 ,=,2.8;②0.10,60%。
试题分析:(1)阴极:6H++NO+5e-=NH4++H2O,阳极:2H2O+NO-3e-=NO3-+4H+,总电极反应式:8NO+7H2O=3NH4NO3+2HNO3,因此电解产物全部转化成NH4NO3,需要补充NH3;(2)溶液A为NaNO3、NaNO2,NO2-要水解,NO2-+H2OHNO2+OH-,根据Ka×Kh=Kw,推出Kh=Kw/Ka=1×10-11,溶液B中CH3COO-+H2OCH3COOH+OH-,Kh=Kw/Ka=6×10-10,Kh越大,说明水解程度越大,离子浓度大小比较:c(NO3‾) > c(NO2‾) > c(CH3COO‾),可知溶液A的碱性小于溶液B的碱性,要想使pH相等,b、c正确;(3)①v(N2O4)=0.05/(20×2)mol/(L·s)=0.00125mol/(L·s),v(NO2)=2v(N2O4)=2×0.00125mol/(L·s)=0.0025mol/(L·s),在60sn(N2O4)不变,说明达到平衡,即n3=n4,达到平衡时,c(N2O4)=0.08/2mol·L-1=0.04mol·L-1,c(NO2)=(0.4-0.08×2)/2mol·L-1=0.12mol·L-1,化学平衡常数K=c(N2O4)/c2(NO2)=2.8;②达到相同平衡状态,则为等效平衡,通入N2O4的物质的量为0.2mol,则c(N2O4)=0.2/2mol·L-1=0.1mol·L-1,①中NO2的转化率为0.08×2/0.4×100%=40%,因为属于等效平衡,则NO2的转化率与N2O4的转化率之和为1,则N2O4的转化率为60%。
5.
I.﹣23.5;
II (1)60%;
(2)d;
III(1)0.15mol/(L•min)
(2)ADE;
(3)正;
(4)CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O.
考点:热化学方程式;化学电源新型电池;化学平衡的调控作用;物质的量或浓度随时间的变化曲线
专题:基本概念与基本理论.
分析:I.依据热化学方程式和盖斯定律计算得到需要的热化学方程式;
II.(1)令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,再利用转化率定义计算CO的转化率;
(2)提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析;
III(1)根据图象中生成甲醇的量求出消耗的氢气的量,再求出氢气的反应速率;
(2)甲容器反应物投入1molCO 2molH2与乙容器反应物投入1mol CH3OH在保持恒温、恒容情况下是等效平衡,平衡时CH3OH的浓度c1=c2、α1+α2=1、Q1+Q2能量总变化相当于1molCO.2molH2完全转化成1mol CH3OH的能量,即吸放热Q1+Q2数值上就等于90.8kJ;甲容器反应物投入量1molCO、2molH2与丙容器反应物投入量2molCO、4molH2
,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向正向移动,也就是说,丙容器的转化率比甲容器还要大一些.因此2c1<c3、α2<α3;
(3)平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的倍,据此判断反应的方向;
(4)负极上的电极反应式等于电池的总反应式﹣正极发生的电极方程式;
解答:解:I.①2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
②2Fe(s)+O2(g)=Fe2O3(s)△H=﹣825.5kJ/mol
由盖斯定律①×﹣②得到Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
则△H=﹣566×+825.5=﹣23.5kJ/mol,
故答案为:﹣23.5;
II (1)令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+CO(g)Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1﹣n n+1
所以=4,解得n=0.6,则CO的平衡转化率为×100%=60%,故答案为:60%;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错误;
b.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故b错误;
c.加入合适的催化剂,平衡不移动,故c错误;
d.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
e.粉碎矿石,使其与平衡混合气体充分接触,平衡不移动,故e错误;
故选d;
III(1)达到平衡时生成甲醇为:0.75mol/L,则消耗的c(H2)=2×0.75mol/L=1.5mol/L,v(H2)===0.15mol/(L•min)
(2)A、甲、乙相比较,把乙等效为开始加入1mol CO和2mol H2,和甲是等效的,甲乙是等效平衡,所以平衡时甲醇的浓度c1=c2,故A正确;
B、甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)CH3OH(g),平衡向生成甲醇的方向移动,故2Q1<Q3,故B错误;
C、甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)CH3OH(g),平衡向生成甲醇的方向移动,故a1<a3 ,故C错误;
D、甲、乙处于相同的平衡状态,而且反应方向相反,则α1+α2=1,故D正确;
E、甲、乙处于相同的平衡状态,而且反应方向相反,两个方向转化的和恰好为1mol,所以该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量,故E正确;
故答案为:ADE;
(3)反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小;平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的倍,总物质的量=4×=2.5mol,反应前后减少了1.5mol,即化学反应向着正反应方向进行,故答案为:正;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,正极反应为:3O2+12H2O+12e﹣=12OH﹣,总反应式为:2CH3OH+3O2+4OH﹣=2CO32﹣+6H2O,两式相减,负极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,
故答案为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O.
点评:本题综合考查了盖斯定律的应用、化学平衡、电化学等知识,题目侧重于等效平衡的计算,为该题的难点,也是易错点,注意理解等效平衡问题.
6.
(1)(CH3)2NNH2;
(2)BD;不变;0.45mol/L•s;
(3)NH4++H2ONH3•H2O+H+;逆向;0.1.
考点:反应热和焓变;化学平衡建立的过程;化学平衡的影响因素;盐类水解的应用.
分析:(1)依据化学方程式中 因素化合价的变化分析,因素化合价降低的做氧化剂被还原;
(2)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;化学平衡常数只与温度有关,与物质的浓度无关;根据v(N2O4)=计算N2O4的化学反应速率,再根据同一反应中、同一时间段内反应速率之比等于计量数之比计算v(NO2);
(3)依据铵根离子水解分析回答;依据同粒子效应,一水合氨对铵根离子水解起到抑制作用;依据一水合氨的电离平衡常数计算得到氨水浓度.
解答:解:(1)反应(Ⅰ)中,N2O4(l)中N元素得电子化合价降低,N2O4(l)是氧化剂,(CH3)2NNH2(l)中C元素和N元素化合价升高,是还原剂;
故答案为:(CH3)2NNH2;
(2)A、起始量二氧化氮物质的量不是0,故A错误;
B、恒压容器中混合气体的质量不变,体积不变,密度不变,平衡状态下密度不变,密度改变,说明体积变化,平衡发生移动,能说明反应达到了平衡状态,故B正确;
C、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故C错误;
D、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故D正确;
化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变;
v(N2O4)═==0.225mol/L•s,则2v(N2O4)=v(NO2)=0.45mol/(L•s);
故答案为:BD;不变;0.45mol/L•s;
(3)NO2可用氨水吸收生成NH4NO3.25℃时,将1 mol NH4NO3溶于水,溶液显酸性,是因为铵根离子水解;反应的离子方程式为:NH4++H2ONH3•H2O+H+;加入氨水溶液抑制铵根离子水解,平衡逆向进行;将1 mol NH4NO3溶于水,向该溶液滴加b L 氨水后溶液呈中性,依据电荷守恒计算可知,溶液中氢氧根离子浓度=10﹣7mol/L,c(NH4+)=c(NO3﹣);NH3•H2O的电离平衡常数取Kb=2×10﹣5 mol•L﹣1,设混合后溶液体积为1L,(NH4+)=c(NO3﹣)=amol/L;根据一水合氨电离平衡得到:NH3•H2ONH4++OH﹣,平衡常数K===2×10﹣5 mol•L﹣1,计算得到c(NH3•H2O)=0.1mol/L,
故答案为:NH4++H2ONH3•H2O+H+;逆向;0.1.
点评:本题考查了氧化还原反应的概念判断,化学平衡的影响因素分析,平衡标志的判断理解,平衡常数的影响因素和计算应用,化学反应速率的计算分析,弱电解质溶液中的电离平衡的计算应用,综合性较大.
7.
(1)2CH+2H2O(g) 2CO+3H2(2分)
(2)12CH(s)+6O2(g)C3H6(g)+3H2O(g)+9CO(g) ΔH =6ΔH1+3ΔH2+ΔH3(3分)
(3)①放热(1分) pl<p2<p3(2分)
②V2/n2(3分) 增大(2分)
③加入氢气(1分) 将产物甲醇分离出(1分)
【解析】
解析:(1)根据原子守恒法即可得到反应的化学方程式为:
(2)把上面三个反应分别表示为①、②、③、煤与氧气反应直接生成丙烯、水蒸气和CO的化学方程式为④12CH(s)+6O2(g)=== C3H6(g)+3H2O(g)+9CO(g) ΔH
根据盖斯定律即可得到:④=①×6+②×3+③
故ΔH = 6ΔH1+3ΔH2+ΔH3
(3)①从图中可以分析得到温度越高,CO的转化率降低,平衡逆向移动,故正反应方向是放热的;在相同的温度时,CO的转化率不同,压强越大转化率越大,故pl<p2<p3
②容器容积为VL,反应压强为pl时CO的转化率为0.5,
CO(g) + 2H2(g) CH3OH(g)
起始时 n mol 2n mo1
转化(或生成) 0.5n mol n mo1 0.5n mol
平衡时 0.5n mol n mo1 0.5n mol
c(CH3OH)= 0.5n/V mol/L c (H2)= n/V mol/L c(CO) = 0.5n/V mol/L
带入平衡常数K= c(CH3OH)/c2(H2)c(CO) = V2/n2。在温度不变的条件下,向该容器中再加人n mol CO与2n mo1 H2,相当于在原有的基础上把容器的体积缩小为原来的一半,压强增大,平衡向气体分子数减小的方向移动,反应物CO的转化率增大。
【思路点拨】本题综合地考查了化学反应方程式的书写,盖斯定律的应用,化学平衡原理的应用,化学平衡常数的计算,综合性较强。
8.
(1);
(2)放热;
(3)0.03mol/(L•min);
(4)①平衡;大于;
②D;A;
(5)75%
考点:化学平衡的计算;化学平衡的影响因素..
分析:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积解答;
(2)根据平衡常数随温度的变化进行判断;
(3)根据v=计算反应速率;
(4)根据浓度、压强、温度对平衡移动的影响分析;
(5)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算.
解答:解:(1)CO(g)+H2O(g)H2(g)+CO2(g)逆反应为:H2(g)+CO2(g)CO(g)+H2O(g),平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,故K=,故答案为:;
(2)升高温度,平衡常数减小,平衡逆向移动,故正反应为放热反应,故答案为:放热;
(3)v(CO)==(0.2﹣0.08)÷4=0.03mol/(L•min),故答案为:0.03mol/(L•min);
(4)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡,另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min﹣4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L,
故答案为:平衡;大于;
②反应在4min﹣5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故选D.
表中5min﹣6min之间CO浓度减少,H2O浓度增大,CO2浓度增大,只有增加水蒸气,使化学平衡向正反应方向移动,故选A,
故答案为:D;A;
(5)设CO的浓度变化量为c,则
CO(g)+H2O(g)H2(g)+CO2(g),
起始:0.02 0.02 0 0
转化:c c c c
平衡:0.02﹣c 0.02﹣c c c
代入500℃时反应平衡常数有k===9,解得c=0.015,
CO的最大所以转化率为×100%=75%,
故答案为:75%.
点评:本题主要考查化学平衡常数、反应速率的计算、平衡移动的影响因素、转化率等知识,题目难度中等,注意平衡常数只受温度的影响,注意(5)中利用平衡常数进行转化率的计算.
9.(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g) △H=+77.0kJ·mol﹣1;
(2)① 0.12 mol·L﹣1·min﹣1;
② 0.18mol2·L﹣2;逆向;
(3)①;
② 0.8aL;
(4)① Co2+﹣e﹣=Co3+;
② 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
解:(1)I:CH4 (g)+H2O (g)=CO (g)+3H2 (g) △H=+206.0kJ·mol﹣1
II:CO (g)+2H2 (g)=CH3OH (g) △H=﹣129.0kJ·mol﹣1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g) △H=+77.0kJ·mol﹣1
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g) △H=+77.0kJ·mol﹣1;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为2L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为40%,故参加反应的甲烷为1mol×40%=0.4mol,则:
CH4 (g)+H2O (g)CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.4 0.4 0.4 1.2
平衡量(mol):0.6 1.6 0.4 1.2
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率==0.12 mol·L﹣1·min﹣1,
故答案为:0.12 mol·L﹣1·min﹣1;
②100℃时反应I的平衡浓度为c(CH4)=0.30mol/L,c(H2O)=0.8mol/L,c(CO)=0.2mol/L,c(H2)=0.6mol/L,
平衡常数K==0.18mol2·L﹣2,
平衡后再向容器中充入H2O(g)和CO各0.2mol,则c(CH4)=0.30mol/L,c(H2O)=0.9mol/L,c(CO)=0.3mol/L,c(H2)=0.6mol/L,Qc= =0.24(mol/L)2>K=0.18mol2·L﹣2,平衡逆向移动,
故答案为:0.18mol2·L﹣2;逆向;
(3)①A中 CO(g)+2H2(g)CH3OH(g)
反应前(mol)2 3 0
反应了(mol)x 2x x
平衡后(mol)2﹣x 3﹣2x x
体积不变时,气体的压强之比等于气体的物质的量之比,则有(2﹣x+3﹣2x+x):(2+3)=3:5
解得:x=1,平衡时氢气的体积分数为:=,故答案为:;
②打开K2,AB都是恒压环境,AB的体积共缩小了0.4aL,A与B体积相等,则A与B各缩小了0.2aL,则打开K2之前,B容器的体积为0.8aL,故答案为:0.8aL;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+;
故答案为:Co2+﹣e﹣=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
10.(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l)△H=﹣2550 kJ·mol﹣1;
(2)① 6.67;
② A;
③ <;
(3)① NH4+;
② c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+);
③ >.
解:(1)1g燃料完全燃烧释放出的能量为42.5kJ,则1mol偏二甲肼完全燃烧释放出的能量为42.5kJ×60=2550kJ,其热化学方程式为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l) △H=﹣2550 kJ/mol,
故答案为:C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l)△H=﹣2550 kJ·mol﹣1;
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,则K===6.67,
故答案为:6.67;
②A.反应物和生成物全是气态物质,气体的质量不变,容积为2L保持恒定,由ρ=可知气体的密度为一定值,因此气体的密度保持不变不一定处于平衡状态,故A正确;
B.混合气体的颜色不变说明NO2的浓度不变,说明反应处于化学平衡状态,故B错误;
C.反应2NO2(g)N2O4(g)是一个气体体积减小的反应,气压恒定时,正、逆反应速率相等,说明反应处于化学平衡状态,故C错误;
故答案为:A;
③反应为放热反应,升高温度,K值减小,密闭容器的体积为2L,因此的N2O4的浓度为0.6mol/L,NO2的浓度为0.3mol/L,浓度商Q===6.67=K(298K)>K(398K),反应向逆反应方向移动,故:V(正)<V(逆),故答案为:<;
(3)①a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,溶液中发生水解反应的离子是NH4+,故答案为:NH4+;
②c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3·H2O三种成分,b点时c(Na+)=c(SO42﹣),c点时c(Na+)>c(SO42﹣),根据N元素与S元素的关系,可以得出c(SO42﹣)>c(NH4+),溶液中离子浓度大小为:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+),
故答案为:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+);
③d、e溶液都为碱性溶液,溶液中的氢氧根离子抑制了水的电离,则氢氧化钠溶液体积越大,水的电离沉淀越小,故d点水的电离程度大于e点水的电离,
故答案为:>.
11.(1)① mol/(L·min);
② 当其他条件一定时,升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动;
③ AD;
④ CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=﹣130.9 kJ·mol﹣1;
(2)① ;>;
② 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
解:(1)①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率v===mol/(L·min),故答案为:mol/(L·min);
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行,T2>T1,根据图一,温度升高,甲醇的物质的量减小,所以平衡逆向移动,即所以当其他条件一定时,对于该化学反应:CO2(g)+3H2(g)=CH3OH(l)+H2O(l),升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动,
故答案为:当其他条件一定时,升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动;
③A.该反应是一个反应前后气体系数和不同的反应,当体系压强保持不变,证明达到平衡,故A正确;
B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存,只能证明是一个可逆反应,不能证明是平衡状态,故B错误;
C.CH3OH与H2物质的量之比为1:3,不能证明达平衡状态,故C错误;
D.每消耗1mol CO2的同时生成3molH2,能证明正逆反应速率相等,故D正确;
故答案为:AD;
④由H2(g)的燃烧热△H为﹣285.8kJ·mol﹣1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即①H2(g)+O2(g)=H2O(l)△H=﹣285.8kJ·mol﹣1
②CH3OH(l)+O2(g)=CO2(g)+2 H2O(l)△H=﹣726.5kJ·mol﹣1,由盖斯定律可知,3×①﹣②得CO2(g)+3H2(g)CH3OH(l)+H2O(l)△H=﹣130.9 kJ·mol﹣1,故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=﹣130.9 kJ·mol﹣1;
(2)①反应CO(g)+2H2(g)═CH3OH(g)的平衡常数K=,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道该反应是一个放热反应,所以升高温度,平衡常数减小,压强大小和平衡常数之间无关,即250℃、0.5×104kPa下的平衡常数大于300℃、1.5×104kPa下的平衡常数,
故答案为:;>;
②根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
12.
(I)< < 低温 ②③⑤ BD
(II)不 (a+b)
考点:化学平衡的计算;化学平衡的影响因素.
专题:化学平衡专题.
分析:(Ⅰ)(1)正反应为气体物质的量减小的反应,容器的容积不变,由图可知,状态Ⅱ的压强大于状态Ⅰ压强的2倍,反应在绝热条件下进行,说明正反应为放热反应;正反应后气体的物质的量减少,所以混乱度减小,△H﹣T△S<0反应自发进行;
加入催化剂,反应速率加快,到达平衡的时间缩短,平衡不移动,阴影部分为反应物浓度变化量,则两图中阴影部分面积相等;
(3)A.A、C两点都在等温线上,压强越大,反应速率越快;
B.A、C两点都在等温线上,反应前后气体物质的量不变,压强越大,容器的容积越小,而混合气体总质量不变;
C.B、C两点X的体积分数相同,则相同组分的体积分数相同;
D.压强相同,升高温度,化学平衡向吸热反应移动;
(Ⅱ)(1)由表格数据可知,当压强从2×105Pa增大为5×105Pa时,压强增大2.5倍,体积变为 倍,浓度由0.08增大为0.20mol•L﹣1,也增大2.5倍,所以增大压强平衡不移动;
由(1)可知,增大压强平衡不移动,所以反应前后气体的物质的量不变;
(3)2×105与5×105 Pa时A的转化率不变,但5×105 Pa时反应速率快,到达平衡时间缩短.当压强从5×105Pa增大为1×106Pa时,压强增大2倍,体积变为 倍,浓度应该由0.20增大为0.40mol•L﹣1,但是实际上A的浓度为0.44,说明平衡逆向移动,此时B不是气体,A的转化率减小,反应速率增大,时间缩短.
解答:解:(Ⅰ)(1)正反应为气体物质的量减小的反应,容器的容积不变,由图可知,状态Ⅱ的压强大于状态Ⅰ压强的2倍,反应在绝热条件下进行,说明正反应为放热反应,则△H<0;正反应后气体的物质的量减少,所以混乱度减小,则△S<0,△H﹣T△S<0反应自发进行,该反应在低温条件下能自发进行,
故答案为:<;<;低温;
加入催化剂,反应速率加快,所以b1<b2,到达平衡的时间缩短,所以t1>t2,平衡不移动,阴影部分为反应物浓度变化量,则两图中阴影部分面积相等,
故答案为:②③⑤;
(3)A. A、C两点都在等温线上,压强A点小于C点,压强越大速率越快,所以反应速率A<C,故A错误;
B. A、C两点都在等温线上,反应前后气体物质的量不变,压强越大,容器的容积越小,而混合气体总质量不变,所以气体密度:A<C,故B正确;
C. B、C两点X的体积分数相同,则相同组分的体积分数相同,所以气体的平均相对分子质量相同,故C错误;
D. 由状态B到状态A,压强相同,温度不同,正反应为放热反应,升高温度化学平衡向吸热反应移动,X的体积分数增大,所以可以通过升温使状态B到状态A,故D正确;
故答案为:BD;
(Ⅱ)(1)由表格数据可知,当压强从2×105Pa增大为5×105Pa时,压强增大2.5倍,体积变为 倍,浓度由0.08增大为0.20mol•L﹣1,也增大2.5倍,所以增大压强平衡不移动,
故答案为:不;
由(1)可知,增大压强平衡不移动,所以反应前后气体的物质的量不变,所以当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+b,
故答案为:a+b;
(3)2×105与5×105 Pa时A的转化率不变,但5×105 Pa时反应速率快,到达平衡时间缩短.当压强从5×105Pa增大为1×106Pa时,压强增大2倍,体积变为 倍,浓度应该由0.20增大为0.40mol•L﹣1,但是实际上A的浓度为0.44,说明平衡逆向移动,此时B不是气体,A的转化率减小,反应速率增大,时间缩短,A的转化率随时间的变化曲线为:,
故答案为:.
点评:本题考查化学平衡影响因素、平衡图象等,综合性较强,侧重考查了学生分析数据、图象获取信息的能力,难度中等
13.
1.1mol•L﹣1•min﹣1
2. K=;=
3. AD
4. 升温; 减小SO3浓度;
考点:化学反应速率变化曲线及其应用;化学平衡的影响因素;化学平衡状态的判断.
分析:(1)根据和化学反应速率之比等化学计量数之比进行计算,得出正确结论;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,温度不变,则平衡常数K不变;
(3)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(4)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点.
解答:解:(1)v(SO2)==2 mol•L﹣1•min﹣1;v(O2):v(SO2)=1:2,v(O2)=v(SO2)=1mol•L﹣1•min﹣1,故答案为:1mol•L﹣1•min﹣1;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故:
可逆反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g) 的平衡常数K=,平衡常数只受温度的影响,温度不变,则压强不变,平衡状态由A变到B时,则k(A)=k(B),
故答案为:K=;=;
(3)A.气体的总质量不变,随反应进行,气体的物质的量减小,平均相对分子质量增大,平均相对分子质量不变,说明到达平衡状态,故A正确;
B.平衡时接触室中SO2、O2的浓度一定不相同,开始物质的量为2:1,按2:1反应,平衡时二者的物质的量之比为2:1,浓度之比为2:1,故B错误;
C.平衡时接触室中SO2、O2、SO3物质的量之比可能为2:1:2,可能不是2:1:2,与二氧化硫的转化率有关,故C错误;
D.随反应进行,气体的物质的量减小,接触室中压强减小,压强不随时间变化而变化,说明到达平衡状态,故D正确;
故答案为:AD;
(4)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为,
故答案为:升温; 减小SO3浓度;.
点评:本题考查化学反应速率与化学平衡的图象问题、平衡常数的计算、平衡状态的判断等,难度中等,注意把握曲线的变化趋势以及外界条件对化学平衡的影响.
14.(1) ①-1160kJ/mol(2分)
(2) ①0.012mol•L-1•min-1(2分,单位没写扣一分) ②b d(2分)
③<(2分) b c(2分)
N2+6H+ +6e- = 2NH3(2分) (4) ②③(2分)
(1) ①若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,热化学方程式为:2CH4(g) + 4NO2(g) =2 N2(g)+2CO2(g) + 4H2O(g) ΔH3=-1734 kJ·mol-1
利用盖斯定律ΔH2=ΔH3-ΔH1=-1160kJ/mol;
①Fe2O3在反应中质量减少3.2g即0.02mol,根据反应方程式则CO增加0.06mol,浓度增大0.06mol/L,该段时间内CO的平均反应速率v=(0.06mol/L)/5min=0.012mol•L-1•min-1; ②a.CH4的转化率和CO的产率说的都是正方向反应,不能说明V正=V逆 ,不能表明该反应达到平衡状态;
b.若平衡正向移动混合气体的平均相对分子质量减小,混合气体的平均相对分子质量不变能表明该反应达到平衡状态;
c.v(CO)与v(H2)的比值不变 ,不能说明V正=V逆 ,不能表明该反应达到平衡状态;
d.平衡移动时固体的总质量会发生变化,固体的总质量不变能表明该反应达到平衡状态;所以选b d;
③该反应的ΔH>0,说明升温平衡正向移动,平衡常数增大,KA a点正确;从b点到c点,混合溶液中还可能会出现存在:c(Na+)>c(OH)>c(NO)> c(H+),所以正确的说法是②③。
15.
Ⅰ.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ•mol-1.
Ⅱ.(1)5:4 (2) KM=KN>KQ P1b。
反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据电荷守恒溶液中c(NH4+)=c(Cl-
)=b/2mol/L,反应前c(NH3•H2O)=a/2mol/L,
则反应后一水合氨的浓度为:c(NH3•H2O)=(a/2—b/2)mol/L,
则氨水的电离平衡常数为:K=[ c(NH4+)×c(OH-)] c(NH3•H2O)== 。
19.(1)0.003 mol•L﹣1•min﹣1;
(2)CD;
(3)O2+2H2O+4e﹣=4OH﹣,负,6,6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
解:(1)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
则v(H2)==0.003 mol•L﹣1•min﹣1,
故答案为:0.003 mol•L﹣1•min﹣1;
(2)A.平衡常数只受温度影响,温度不变,平衡常数不变,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡c减小,故D正确;
故答案为:CD;
(3)正极发生还原反应,氧气在正极得到电子,电极反应式为:O2+2H2O+4e﹣=4OH﹣,负极发生氧化反应,故负极带正电,故OH﹣向负极移动;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;由CH3OH~6e﹣可知:净化含1mol甲醇的水,燃料电池转移6mol电子,
故答案为:O2+2H2O+4e﹣=4OH﹣,负,6,6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
20.
(1)C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O
(2) 20﹪ ae 0.36
(3)2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ·mol-1
(4)BC
(5)CO-2e-+CO32-=2CO2 D
解析:(1)硫酸酸化的锰酸钾氧化杂质碳为无污染气体而除去,即碳被氧化成二氧化碳,Mn元素转变为Mn2+,氧化还原反应根据得失电子守恒配平:C+2H2SO4+K2MnO4=CO2↑+MnSO4+K2SO4+2H2O ;
(2)①实验2条件下 CO(g)+H2O(g) CO2(g)+H2(g)
起始量(mol)2 1
变化量(mol)0.4 0.4 0.4 0.4
平衡量(mol)1.6 0.6 0.4 0.4
则H2O 体积分数为0.6÷(1.6+0.6+0.4+0.4)×100%=20%;
②a .单位时间内生成n mol H2(V正)的同时生成n mol CO(V逆),V正=V逆,达平衡,正确;
b. 本反应是等体反应,故容器内压强不再变化无法判断是否平衡,错误;
c.恒容密闭容器中混合气体密度一直不变,故无法判断是否平衡,错误;
d.本反应是等体反应,气体的总物质的量一直不变,混合气体的平均相对分子质量一直不变,故无法判断是否平衡,错误;
e. 达平衡时,的物质的百分含量不再变化,故CO2的质量分数不再变化,说明已达平衡,正确;故选ae;
③900K时:第一个方程式:C(S)+H2O(g)=CO(g)+H2(g) K1=C(CO)·C(H2)/C(H2O)=10-0.39
第二个方程式:C(S)+2H2O(g)=CO2(g)+2H2(g) K2=C(CO2)·C2(H2)/C2(H2O)=10-0.03
2式-1式得:CO(g)+H2O(g)CO2(g)+H2(g)
K=[C(CO2)·C(H2)]/[C(H2O)·C(CO)]=K2/K1=100.36 则(lgK)=0.36
根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ•mol-1,故答案为:
2CO(g)+SO2(g)=S(s)+2CO2(g) △H3=-270 kJ•mol-1;
(4) A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,CH3COOH抑制水的电离,CH3COONa促进水的电离,故由水电离出的c(OH—)不相等,故A错误;
B.①点时电荷守恒有:c(CH3COO—)+c(OH—)=c(Na+)+c(H+),pH=6,c(H+)=10-6,c(OH—)=10-8;
则c(CH3COO—)-c(Na+)=c(H+)-c(OH—)=10-6-10-8=9.9×10-7mol/L ,故B正确;
C.②点时pH=7,c(OH—)=c(H+),电荷守恒有:c(CH3COO—)+c(OH—)=c(Na+)+c(H+),故c(CH3COO—)=c(Na+),故C正确;
D.③点时V=20mL,此时溶液中恰好生成CH3COONa,强碱弱酸盐,溶液呈碱性,c(OH—)>c(H+),根据 电荷守恒有:c(CH3COO—)< c(Na+)=0.05mol/L,故D错误;
故答案选BC;
①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2;
故答案为:CO-2e-+CO32-=2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D
21.(1)0.003 mol•L﹣1•min﹣1;
(2)CD;
(3)O2+2H2O+4e﹣=4OH﹣,负,6,6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
解:(1)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
则v(H2)==0.003 mol•L﹣1•min﹣1,
故答案为:0.003 mol•L﹣1•min﹣1;
(2)A.平衡常数只受温度影响,温度不变,平衡常数不变,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡c减小,故D正确;
故答案为:CD;
(3)正极发生还原反应,氧气在正极得到电子,电极反应式为:O2+2H2O+4e﹣=4OH﹣,负极发生氧化反应,故负极带正电,故OH﹣向负极移动;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;由CH3OH~6e﹣可知:净化含1mol甲醇的水,燃料电池转移6mol电子,
故答案为:O2+2H2O+4e﹣=4OH﹣,负,6,6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
22.(1)C
(2)(Q2-2Q1) kJ·mol-1
(3)P2>P1 ;1/144
(4)NO2+NO3--e-=N2O5 ; 224
解析:(1)A、Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,错误;B、一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写有关,错误;C、因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,正确;D、速率关系未说明正、逆,不能判断是否已达平衡,错误。
(2)已知的两个反应分别用①②表示,运用盖斯定律可得,SO2(g)+2CO(g)═S(s)+2CO2(g)可由①×2-②得到,则△H=(Q2-2Q1) kJ•mol-1
①由图像知相同温度压强为P2时NO的平衡转化率大于P1时的,而根据反应特点加压平衡正向移动,所以P2>P1 ;②700℃时,在压强为P2时NO的平衡转化率为20%,则NO减小了2mol/L
2NO(g)+O22NO2(g),
起始浓度(mol/L) 10 10 0
转化浓度(mol/L) 2 1 2
平衡浓度(mol/L) 8 9 2
在该条件平衡常数的数值为:;
(4)石墨I电极上通入NO2,为负极,发生的电极反应为:NO2+NO3--e-=N2O5;根据电池总反应4NO2+O2=2N2O5,收集到20molN2O5需消耗O2为10mol,标准状况下体积为224L。
23.
(1)①小于;
②30%,小于;
③ABCD;
(2)﹣787kJ/mol;
(3)N2O5,N2O4+2NO3﹣﹣2e﹣=2N2O5.
【考点】化学平衡的影响因素;原电池和电解池的工作原理.
【专题】化学平衡专题;电化学专题.
【分析】(1)①A到B点氧气的转化率增大,说明反应正向进行;
②平衡时压强转化率为60%,当n(NO):n(O2)=4:1时设NO为4,O2为1,结合化学平衡三行计算得到;当达到B点后往容器中再以4:1加入些NO和 O2,相当于中等容器中气体压强,平衡正向进行;
③到达B点即达到平衡状态,正逆反应速率相同,各组分含量保持不变;
(2)依据图象分别写出对应反应的热化学方程式,结合盖斯定律计算4NO(g)+3O2(g)═2N2O5(g)反应的焓变;
(3)燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成氧化物N2O5的电极,再根据离子的放电顺序写出电极反应式.
【解答】解:(1)①A到B点氧气的转化率增大,说明反应正向进行,A点的逆反应速率v逆 (O2)小于B点的正反应速率v正(O2),
故答案为:小于;
②平衡时压强转化率为60%,当n(NO):n(O2)=4:1时设NO为4,O2为1,则转化的氧气为0.6,结合化学平衡三行计算,
2NO(g)+O2(g)═2NO2(g)
起始量 4 1 0
变化量 1.2 0.6 1.2
平衡量 2.8 0.4 1.2
NO的平衡转化率×100%=30%,
当达到B点后往容器中再以4:1加入些NO和 O2,相当于中等容器中气体压强,平衡正向进行,一氧化氮百分含量减小,NO的百分含量小于B点NO的百分含量,
故答案为:30%,小于;
③2NO(g)+O2(g)═2NO2(g)反应是气体体积进行的放热反应,
A.容器内气体颜色不再变化,说明二氧化氮浓度不变,反应达到平衡状态,故A正确;
B.速率之比等于化学方程式计量数之比为正反应速率之比,反应达到平衡状态v正(NO)=2v正(O2),故B正确;
C.达到平衡状态气体质量不变,物质的量不变,气体平均摩尔质量在此条件下达到最大,故C正确;
D.达到平衡状态,容器内气体密度不再变化,故D正确;
故答案为:ABCD;
(2)热化学方程式为①NO(g)+O2(g)=NO2(g)△H=143kJ/mol﹣287kJ/mol=﹣144kJ/mol,
②4NO2(g)+O2(g)=2N2O5(g)△H=(372﹣583)kJ/mol=﹣211kJ/mol,
依据盖斯定律计算①×4+②得到4NO(g)+3O2(g)═2N2O5(g)△H=﹣787kJ/mol,
故答案为:﹣787kJ/mol;
(3)以N2O4、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,N2O4在负极失电子发生氧化反应,元素化合价升高为+5价,氧化物为N2O5,反应的电极反应为:N2O4+2NO3﹣﹣2e﹣=2 N2O5,
故答案为:N2O5,N2O4+2NO3﹣﹣2e﹣=2 N2O5.
【点评】本题考查了图象分析、化学平衡影响因素、平衡标志的判断、平衡计算、热化学方程式书写、原电池原理等知识点,掌握基础是解题关键,题目难度中等.
24.
(1)4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=﹣905.0kJ/mol;
(2)①;
②>;
(3)①ABD;
②32.61%;
(4)N2+6e﹣+6H+=2NH3;
(5)BD.
考点:化学平衡的计算;用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理;化学平衡常数的含义;体积百分含量随温度、压强变化曲线;难溶电解质的溶解平衡及沉淀转化的本质.版权所有
分析:(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(2)①化学平衡常数,是一定温度下,可逆反应到达平衡,生成物浓度化学计量次数幂之积与反应物浓度化学计量次数幂之积所得的比值;
②合成氨是放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小;
(3)①A.由图可知,温度一定时,压强增大氨气的体积分数增大;
B.合成氨是放热反应,压强一定时,降低温度平衡向正反应方向移动,平衡时氨气的体积分数增大;
C.500℃温度时反应速率加快及催化剂活性最好,正反应为放热反应,温度越低,氮气的转化率越高;
D.不同物质表示的正逆速率之比等于化学计量数之比,说明可逆反应到达平衡;
E.容器内混合气体密度始终保持不变;
②设参加反应的氮气为n mol,则:
N2(g)+3H2(g)2NH3(g)
开始(mol):10 40 0
转化(mol):n 3n 2n
平衡(mol):10﹣n 40﹣3n 2n
根据平衡时氨气的体积分数方程式计算n,进而计算氮气的转化率;
(4)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气;
(5)A.氢氧化镁与氟化镁的化学式相似,氢氧化镁的溶度积小,溶液中氢氧化镁的浓度小于氟化镁;
B.根据镁离子浓度、氢氧化镁溶度积计算溶液中c(OH﹣),再根据水的离子积计算溶液中c(H+),再根据pH=﹣lgc(H+)计算;
C.溶度积Ksp不随浓度变化,只与温度有关;
D.不管氢氧化镁的ksp有多小,只要加入的氟化钠溶液的浓度适合的话,使c(Mg2+)×c(F﹣)2>7.42×10﹣11,可以使氢氧化镁转化为氟化镁沉淀.
解答:解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
由盖斯定律可知,①×2﹣②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=(+180.5kJ/mol)×2﹣(﹣92.4kJ/mol)×2+(﹣483.6kJ/mol)×3=﹣905.2kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=﹣905.0kJ/mol;
(2)①N2(g)+3H2(g)2NH3(g)的平衡常数表达式K=,
故答案为:;
②合成氨反应N2(g)+3H2(g)2NH3(g)△H<0,对于放热反应,温度越高,越有利于向逆反应进行,所以K1>K2,
故答案为:>;
(3)①A.由图可知,温度一定时,压强增大氨气的体积分数增大,故A正确;
B.图B中T=500℃,合成氨是放热反应,压强一定时,降低温度平衡向正反应方向移动,平衡时氨气的体积分数增大,则温度为450℃时对应的曲线是b,故B正确;
C.500℃温度时反应速率加快及催化剂活性最好,正反应为放热反应,温度越低氮气的转化率越高,高温不利于氮气的转化,故C错误;
D.当 2v正(H2)=3v逆(NH3),不同物质表示的正逆速率之比等于化学计量数之比,说明可逆反应到达平衡,故D正确;
E.容器内混合气体密度始终保持不变,不能说明到达平衡,故E错误,
故选:ABD;
②设参加反应的氮气为n mol,则:
N2(g)+3H2(g)2NH3(g)
开始(mol):10 40 0
转化(mol):n 3n 2n
平衡(mol):10﹣n 40﹣3n 2n
则×100%=15%,解得n≈3.261,所以氮气的转化率为×100%=32.61%,
故答案为:32.61%;
(4)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e﹣+6H+=2NH3.
故答案为:N2+6e﹣+6H+=2NH3;
(5)A.氢氧化镁与氟化镁的化学式相似,氢氧化镁的溶度积小,溶液中氢氧化镁的浓度小于氟化镁,饱和Mg(OH)2溶液中c(OH﹣)小于饱和MgF2溶液中c(F﹣),故A错误;
B.饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol•L﹣1,Ksp[Mg(OH)2]=5.61×10﹣12,则溶液中c(OH﹣)=1×10﹣5mol/L,故溶液中溶液中c(H+)=1×10﹣9mol/L,溶液pH=﹣lgc(H+)=9,故B正确;
C.溶度积Ksp不随浓度变化,只与温度有关,故C错误;
D.只要加入的氟化钠溶液的浓度适合的话,使c(Mg2+)×c(F﹣)2>7.42×10﹣11,可以使氢氧化镁转化为氟化镁沉淀,故D正确,
故选:BD.
点评:本题考查热化学方程式书写、平衡常数及有关计算、化学平衡计算、化学平衡图象及影响因素、原电池、溶度积等,属于拼合型题目,需要学生具备扎实的基础,难度中等.
25.
I.﹣23.5;
II (1)60%;
(2)d;
III(1)0.15mol/(L•min)
(2)ADE;
(3)正;
(4)CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O.
考点:热化学方程式;化学电源新型电池;化学平衡的调控作用;物质的量或浓度随时间的变化曲线.
专题:基本概念与基本理论.
分析:I.依据热化学方程式和盖斯定律计算得到需要的热化学方程式;
II.(1)令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,再利用转化率定义计算CO的转化率;
(2)提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析;
III(1)根据图象中生成甲醇的量求出消耗的氢气的量,再求出氢气的反应速率;
(2)甲容器反应物投入1molCO 2molH2与乙容器反应物投入1mol CH3OH在保持恒温、恒容情况下是等效平衡,平衡时CH3OH的浓度c1=c2、α1+α2=1、Q1+Q2能量总变化相当于1molCO.2molH2完全转化成1mol CH3OH的能量,即吸放热Q1+Q2数值上就等于90.8kJ;甲容器反应物投入量1molCO、2molH2与丙容器反应物投入量2molCO、4molH2,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向正向移动,也就是说,丙容器的转化率比甲容器还要大一些.因此2c1<c3、α2<α3;
(3)平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的倍,据此判断反应的方向;
(4)负极上的电极反应式等于电池的总反应式﹣正极发生的电极方程式;
解答:解:I.①2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
②2Fe(s)+O2(g)=Fe2O3(s)△H=﹣825.5kJ/mol
由盖斯定律①×﹣②得到Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
则△H=﹣566×+825.5=﹣23.5kJ/mol,
故答案为:﹣23.5;
II (1)令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+CO(g)Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1﹣n n+1
所以=4,解得n=0.6,则CO的平衡转化率为×100%=60%,故答案为:60%;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错误;
b.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故b错误;
c.加入合适的催化剂,平衡不移动,故c错误;
d.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
e.粉碎矿石,使其与平衡混合气体充分接触,平衡不移动,故e错误;
故选d;
III(1)达到平衡时生成甲醇为:0.75mol/L,则消耗的c(H2)=2×0.75mol/L=1.5mol/L,v(H2)===0.15mol/(L•min)
(2)A、甲、乙相比较,把乙等效为开始加入1mol CO和2mol H2,和甲是等效的,甲乙是等效平衡,所以平衡时甲醇的浓度c1=c2,故A正确;
B、甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)CH3OH(g),平衡向生成甲醇的方向移动,故2Q1<Q3,故B错误;
C、甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)CH3OH(g),平衡向生成甲醇的方向移动,故a1<a3 ,故C错误;
D、甲、乙处于相同的平衡状态,而且反应方向相反,则α1+α2=1,故D正确;
E、甲、乙处于相同的平衡状态,而且反应方向相反,两个方向转化的和恰好为1mol,所以该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量,故E正确;
故答案为:ADE;
(3)反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小;平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的倍,总物质的量=4×=2.5mol,反应前后减少了1.5mol,即化学反应向着正反应方向进行,故答案为:正;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,正极反应为:3O2+12H2O+12e﹣=12OH﹣,总反应式为:2CH3OH+3O2+4OH﹣=2CO32﹣+6H2O,两式相减,负极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,
故答案为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O.
点评:本题综合考查了盖斯定律的应用、化学平衡、电化学等知识,题目侧重于等效平衡的计算,为该题的难点,也是易错点,注意理解等效平衡问题.
26.
(1)CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=(2Q1+3Q2+2Q3) kJ•mol﹣1;
(2)
①0.006mol/L•min;
②ac;
③25%;
(3)①CH3OH;CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;
②2NaCl+2H2O 2NaOH+Cl2↑+H2↑;
③1;
考点:化学平衡的计算;用盖斯定律进行有关反应热的计算;电解原理.
分析:(1)依据热化学方程式和盖斯定律计算分析得到所需热化学方程式;
(2)①平均反应速率=计算得到;
②若想加快正反应速率的同时提高CO的转化率,依据化学反应影响因素和平衡移动原理分析选择的条件;
③结合平衡常数概念,依据化学平衡三段式列式计算得到;
(3)甲为原电池,乙、丙为电解池,当向甲池通入气体a和b时,D极附近呈红色,说明D为电解池的阴极,C为电解池的阳极,b为正极,a为负极,E为阳极,F为阴极;
①a为甲醇电极商十点钟发生氧化反生成碳酸盐;
②乙中是电极饱和食盐水;
③依据电极反应和电子守恒计算所得溶液的PH.
解答:解:(1)①CO2(g)+3H2(g)CH3OH(l)+H2O (g)△H=Q1kJ•mol﹣1
②CH3OH(l)+O2(g)CO2(g)+2H2(g)△H=Q2kJ•mol﹣1
③H2O(g)=H2O(l)△H=Q3kJ•mol﹣1,依据盖斯定律①×2+②×3+③×2得到:
表示甲醇的燃烧热的热化学方程式为CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=(2Q1+3Q2+2Q3) kJ•mol﹣1;
故答案为:CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=(2Q1+3Q2+2Q3) kJ•mol﹣1;
(2)业上可用CO和H2O(g)来合成CO2 和H2,再利用(1)中反应原理合成甲醇.某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g)CO2(g)+H2(g)△H>0,当反应进行到10min时达到平衡,此时测得H2为0.6mol,依据化学平衡三段式列式
CO(g)+H2O(g)CO2(g)+H2(g)
起始量(mol) 1 1.5 0 0
变化量(mol) 0.6 0.6 0.6 0.6
平衡量(mol) 0.4 0.9 0.6 0.6
故答案为:6×10﹣3 mol•L﹣1•min﹣1;
①0~10min内H2O(g)的平均反应速率==0.006mol/L•min;
故答案为:0.006mol/L•min;
②CO(g)+H2O(g)CO2(g)+H2(g)△H>0,反应是气体体积不变的吸热反应,若想加快正反应速率的同时提高CO的转化率,可以采用的方法是;
a.升高温度,反应速率增大,平衡正向进行,故a符合;
b.缩小容器的体积,压强增大,平衡不变,速率增大,不能提高一氧化碳转化率,故B不符合;
c.增大H2O(g)的浓度,反应速率增大,一氧化碳转化率增大,故c符合;
d.加入适当的催化剂,改变反应速率,不改变化学平衡,一氧化碳转化率不变,故d不符合;
故答案为:ac;
③计算平衡常数,K==1
若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),设生成氢气物质的量为x
CO(g)+H2O(g)CO2(g)+H2(g)
起始量(mol) 1+0.4 0.9+0.4 0.6 0.6
.6变化量(mol) x x x x
平衡量(mol) 1.4﹣x 1.4﹣x 0.6+x 0.6+x
=1
x=0.4mol
此时平衡混合气体中H2的体积分数=×100%=25%
故答案为:25%;
(3)甲为原电池,乙、丙为电解池,当向甲池通入气体a和b时,D极附近呈红色,说明D为电解池的阴极,C为电解池的阳极,b为正极,a为负极,E为阳极,F为阴极;
①上述分析可知a物质为甲醇,电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;
故答案为:CH3OH;CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;
②乙中是电极饱和食盐水,生成氯气和氢气、氢氧化钠溶液,反应的化学方程式为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑;
故答案为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑;
③当乙装置中C电极收集到224mL(标况下)气体时,生成氯气物质的量= =0.01mol,2Cl﹣﹣2e﹣=Cl2↑,电子转移0.02mol,丙中电解硫酸铜的反应为:2CuSO4+2H2O2Cu+O2↑+2H2SO4,电子转移4mol,反应2mol硫酸铜,生成硫酸2mol,电子转移0.02mol,生成硫酸0.01mol,氢离子浓度=0.02mol,c(H+)==0.1mol/L,溶液的pH=1
故答案为:1;
点评:本题考查了化学平衡、反应速率的影响因素分析判断,平衡常数、反应速率的计算应用,原电池原理的理解应用和电解池中溶液PH的计算应用,掌握基础是关键,题目难度中等.
27.
(1)CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.3kJ•mol﹣1;
(2)ab;
(3)abd;
(4)①<;
②增大;不变;
③;
(5)①CO32﹣;
②10﹣2+10﹣4﹣10﹣10.
考点:转化率随温度、压强的变化曲线;用盖斯定律进行有关反应热的计算;化学平衡的影响因素;离子浓度大小的比较..
分析:(1)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol﹣1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol﹣1 ②
由盖斯定律②﹣①得CO(g)+H2O(g)=CO2(g)+H2(g),以此计算△H;
(2)a.随温度升高,平衡向吸热即正反应方向移动,氨气的物质的量逐渐减小;
b.随压强增大,平衡向气体体积减小即逆反应反应移动,氨气的转化率逐渐减小;
c.随反应进行,密闭体积中混合气体的密度自始至终不变;
d.随氨气的物质的量增加,某一生成物的物质的量逐渐增加;
(3)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO;
b.亚硫酸钠不稳定,易被氧气氧化;
c.用CO作脱除剂,则氮氧化物得电子发生还原反应;
d.尿素[CO(NH2)2]中N元素化合价为﹣3价,具有还原性,在一定条件下能有效将NOx转化为氮气;
(4)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
②温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变;
③该温度下,平衡时n(CO)=amol×(1﹣0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol﹣2×amol×0.5=amol,则c(CO)=mol/L、c(CH3OH)=mol/L、c(H2)=mol/L,化学平衡常数K=计算;
(5)①将2mol NH3(g)和l mol CO2(g)通入1L水中,恰好生成碳酸铵,据此分析即可;
②依据电中性原则列出式子,代入数据计算即可.
解答:解:(1)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol﹣1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol﹣1 ②
由盖斯定律②﹣①得:
CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.3kJ•mol﹣1
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.3kJ•mol﹣1;
(2)a.当X表示温度时,平衡向吸热即正反应方向移动,氨气的物质的量逐渐减小,故a正确;
b.当X表示压强时,平衡向气体体积减小即逆反应反应移动,氨气的转化率逐渐减小,故b正确;
c.当X表示反应时间时,密闭体积中混合气体的密度自始至终不变,故c错误;
d.当x表示氨气的物质的量时,某一生成物的物质的量逐渐增加,故d错误;
故答案为:ab;
(3)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,故a正确;
b.亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,故b正确;
c.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不会生成NO2,烟气中NO2的浓度不增加,故c错误;
d.尿素[CO(NH2)2]中N元素化合价为﹣3价,具有还原性,在一定条件下能有效将NOx转化为N2.故d正确.
故答案为:abd;
(4)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,故答案为:<;
②温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变;
③该温度下,平衡时n(CO)=amol×(1﹣0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol﹣2×amol×0.5=amol,则c(CO)=mol/L、c(CH3OH)=mol/L、c(H2)=mol/L,化学平衡常数K===,故答案为:;
(5)①将2mol NH3(g)和l mol CO2(g)通入1L水中,恰好生成碳酸铵,化学反应方程式为:2NH3+CO2+H2O=(NH4)2CO3,故溶液中存在浓度最大的阴离子是碳酸根,故答案为:CO32﹣;
②设两种溶液体积均为V,混合后,该溶液中的阳离子是:Na+、NH4+和H+,阴离子是:OH﹣和SO42﹣,依据电中性原则有:c(Na+)+c(NH4+)+c(H+)=2c(SO42﹣)+c(OH﹣),故c(Na+)+c(NH4+)=2c(SO42﹣)+c(OH﹣)﹣c(H+)=2×+﹣10﹣10=0.01+10﹣4﹣10﹣10=10﹣2+10﹣4﹣10﹣10,故答案为:10﹣2+10﹣4﹣10﹣10.
点评:本题主要考查的是反应的焓变判断,热化学方程式的书写,化学平衡的影响因素,氧化还原法除有毒气体,可逆反应转化率随温度和压强变化的曲线,要求学生具备依据图象所给的信息获取分析问题的能力,还涉及平衡常数的计算、溶液中离子浓度大小比较以及电中性原则的应用,有一定难度.
28.
(1)﹣159.47;
(2)①降低;
②温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(3);
(4)
;
(5)A、B;
(6)①小于;
②30%;
(7)6Cl﹣﹣6e﹣═3Cl2↑;CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl.
考点:化学平衡的影响因素;用盖斯定律进行有关反应热的计算;电解原理.
分析:(1)依据反应Ⅰ:2NH3(g)+CO2(g)NH2CO2NH4(s)△H1=a kJ•mol﹣1
反应Ⅱ:NH2CO2NH4(s)CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol﹣1
总反应Ⅲ:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H3=﹣86.98kJ•mol﹣1
由盖斯定律总反应Ⅲ﹣反应Ⅱ得到反应Ⅰ进行计算;
(2)①不同水碳比和温度影响CO2平衡转化率变化的趋势曲线分析可知,
②反应Ⅲ是放热反应,升温平衡逆向进行;
(3)依据热化学方程式2NH3(g)+CO2(g)NH2CO2NH4(s)△H1=a kJ•mol﹣1 ,结合平衡常数的概念书写;
(4)图象分析二氧化碳的平衡浓度为0.025mol/L,体积缩小一半浓度增大一倍应为0.05mol/L,随反应进行达到平衡状态,因为生成物为固体,最后达到相同平衡状态,二氧化碳浓度不变,据此画出变化曲线;
(5)分析尿素结构可知,和羰基连接的氨基据此性质分析推断.
(6)①由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为0.6a,根据方程式计算转化的NH3的物质的量,再根据转化率定义计算;
(7)由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl.
解答:解:(1)反应Ⅰ:2NH3(g)+CO2(g)NH2CO2NH4(s)△H1=a kJ•mol﹣1
反应Ⅱ:NH2CO2NH4(s)CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol﹣1
总反应Ⅲ:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H3=﹣86.98kJ•mol﹣1
由盖斯定律总反应Ⅲ﹣反应Ⅱ,得到2NH3(g)+CO2(g)NH2CO2NH4(s)△H1=a=﹣159.47kJ•mol﹣1,
故答案为:﹣159.47;
(2)①反应Ⅲ:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H3=﹣86.98kJ•mol﹣1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;
②反应Ⅲ:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H3=﹣86.98kJ•mol﹣1,是放热反应,升温高于190°C,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(3)反应Ⅰ:2NH3(g)+CO2(g)NH2CO2NH4(s)△H1=﹣159.47kJ•mol﹣1,平衡常数K=,故答案为:;
(4)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g)NH2CO2NH4(s)
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.15 0.075
平衡量(mol/L) 0.05 0.025
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示.若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol/L,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为:
,故答案为:;
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O(NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:
A.NH2COONH4 ,结构中含有与羰基连接的氨基,故A符合;
B.H2NOCCH2CH2CONH2 结构中含有与羰基连接的氨基,故B符合;
C.HOCH2CH2OH,结构中不含有氨基,故C不符合;
D.HOCH2CH2NH2,分子中的氨基不是和羰基连接,不具备次性质,故D不符合;
故答案为:A、B;
(6)①由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,故答案为:小于;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为a×60%=0.6a,根据方程式可知,转化的NH3的物质的量为0.6a×2=1.2a,故平衡时氨气的转化率定为×100%=30%,
故答案为:30%;
(7)由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,
故答案为:6Cl﹣﹣6e﹣═3Cl2↑;CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl.
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素分析判断,平衡常数,图象绘制与分析,掌握基础知识,推断物质结构是关键,题目难度中等.
29.
(1)2b-a(2分);(2) (1分) (3)CD (2分);(4) (2分);=(2分);(5)350℃(300~400℃之间)(1分);3%(1分)。
试题分析:(1)②×2-①,可得2CO(g)+2NO(g)N2(g)+2CO2(g) △H3=(2b-a) kJ·mol-1;(2)对于有气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①N2(g)+O2(g)2NO(g)的平衡常数表达式Kp=;(3)A.在任何时刻内,单位时间内生成1mol CO2的同时必消耗了lmol CO,反应正向进行,不能判断反应处于平衡状态,错误; B.由于该反应混合物都是气体,气体的质量不变,容器的容积不变,所以在任何时刻在恒温恒容的容器中,混合气体的密度保持不变,故不能据此判断反应处于平衡状态,错误;C.在绝热恒容的容器中,反应的平衡常数不再变化,说明反应的温度不变,反应处于平衡状态,错误;D.在恒温恒压的容器中,NO的体积分数保持不变,则NO的物质的量不变,反应处于平衡状态,正确。(4)在一定温度下,向体积为VL的恒容密闭容器中充入一定量的NO和CO,发生反应③。在t1时刻达到平衡,此时n(CO)=xmol,n(NO)=2xmol,n(N2)=ymol,反应消耗NO的物质的量是2y,则NO的平衡转化率为2y ÷(2x+2y)×100%=;该反应的化学平衡常数K=[c2(CO2)·c(N2)]÷[c2(CO)·c2 (NO)]=y3/x4V;再向容器中充入ymolCO2和xmolNO,则Qc=[c2(CO2)·c(N2)]÷[c2(CO)·c2 (NO)]=y3/x4V=K,所以此时v(正) =v(逆)。(5)烟气中也含有氮氧化物,C2H4可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图1所示。根据图示可知在350℃时达到最高的NO去除率,Cu2+负载量为3%。
30.
(1)A. -90.73 kJ/mol; B. > (2)AD;
(3)① 减小;升高温度时,反应Ⅰ为放热反应,平衡向左移动,使得体系中CO的量增大;反应Ⅲ为吸热反应,平衡向右移动,CO产生的量也增大;总结果,随温度升高,使CO的转化率降低;
② P3>P2>P1;(1分)相同温度下,由于反应Ⅰ为气体分子数减小的反应,加压有利于提升CO的转化率;而反应Ⅲ为气体分子数不变的反应,产生CO的量不受压强影响;故增大压强,CO的转化率升高。
(4)装置简单,减小了电池的体积。
CH3OH-6e-+H2O=CO2+6H+
试题分析:(1)∆H1=-201.25-(-110.52+0)= -90.73 kJ/mol;根据盖斯定律,∆H3=∆H2-∆H1>0;(2)根据反应a、c可知,升高温度平衡逆向移动,所以该反应的正反应为放热反应;反应a与b比,b相当于加压,加压2CH3OH(g)CH3OCH3(g)+H2O(g)平衡不移动,容器a中的CH3OH体积分数与容器b中的相同;容器a中的温度高,反应速率大,反应到达平衡所需时间比容器c中的短;根据Q、K的关系,容器a中充入CH3OH 0.15mol、CH3OCH30.15mol和H2O 0.10mol,Q (1分) 50% 0.2mol/(L·min)
②增加CO2 的量、升高温度(填一种即可)
(3)CH3OH-6e-+H2O=CO2+6H+ 、1
33.
(1) (1分)
(2分)
(2)1.75 0.090 mol·L-1·min-1 (每空1分,共2分)
(3)① (2分)
② 吸热反应。温度升高,a(N2O4)增加,说明平衡右移 (2分)
减小体系压强、移出NO2 (2分)
③ (2分)
B点与D点,满足平衡条件u(NO2) = 2u(N2O4) (2分)
(2) 2N2O5(g)=4NO2(g)+O2(g)
开始时浓度(mol/L) 1 0 0
变化浓度(mol/L) 0.5 1 0.25
2min时的浓度(mol/L)0.5 1 0.25
则p:p0=1.75;
1.00一3.00 min内,N2O5的浓度变化量为0.36mol/L,则O2浓度变化量为0.18mol/L,平均反应速率为0.18/2=0.09mol·L-1·min-1;
(3)①平衡常数Kp=;
②由图可知,温度升高,a(N2O4)增加,说明平衡右移,则正反应为吸热反应;若要提高试N2O4,除改变反应温度外,还可以减小体系压强或移出NO2;
③由题意知u(N2O4)=k1·p(N2O4),u(NO2)=k2·[p(NO2)]2,
Kp=p2(NO2)/ p(N2O4)=[ u (NO2)/k2]/[ u (N2O4)/k1]=2k1/k2,所以kl=k2Kp/2;图中B点与D点,满足平衡条件u (NO2) = 2u (N2O4)。
34.
(1)①-538 ②ABC
(2)500 加压
(3)N2O4+2HNO3-2e-=2N2O5+2H+
(4)300℃之前,温度升高脱氮率逐渐增大;300℃之后,温度升高脱氮率逐渐减小(2分)
300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小。
试题分析:(1)①化学反应的焓变等于反应物旧键断裂吸收的能量与生成物新键形成放出的能量只差,因此
;②A. t1时刻以后,正反应速率依然在变化,证明没有达到平衡状态,不符合题意,故A错误;B.平衡常数K只与温度有关,由于该反应是在恒温条件下进行的,因此平衡常数K始终不变,B错误;C. t1时刻以后,NO和CO2的量依然在变化,证明没有达到平衡状态,C错误;D.该反应是气体分子数减小的反应,由于该反应在恒温、恒容条件下进行,随着反应的进行,容器内压强不断减小,当反应达到平衡状态时,压强不再发生变化,因此D正确。故答案ABC。(2)CO和NO发生反应,方程式为:
2NO(g)+2CO(g)N2(g)+2CO2(g)
起始浓度(l0-2mol/L) 1 3.6 0 0
转化浓度(l0-2mol/L) 0.9 0.9 0.45 0.9
平衡浓度(l0-2mol/L) 0.1 2.7 0.45 0.9
。加压既能增大反应速率,又能使平衡向气体分子数减少的正向移动。
35.
(1)+41.19 kJ•mol﹣1;正向;
(2)①B;
②
a. 450,0<x<2.025;
b.
;
(3)①CH3OH﹣6e﹣+3O2﹣=CO2↑+2H2O;
②2.895×105 C.
【分析】(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;正反应如果是吸热反应升高温度平衡正向移动;
(2)①图象分析相同温度下,两种反应物,增大一种物质的量会提高另一种物质的转化率;
②a.结合三行式进行计算,化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
b.将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2﹣)在其间通过,分析该电池的工作原理如图3所示可知负极是甲烷失电子发生氧化反应,结合导电离子和电荷守恒分析书写;
②依据电极反应计算转移电子数,结合法拉第常数为9.65×104C•mol﹣1计算电量.
【解答】解:(1)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
反应Ⅱ:CO2(g)+H2(g)CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=﹣90.77kJ•mol﹣1
根据盖斯定律,反应Ⅱ可以是Ⅰ﹣Ⅲ得到,所以反应Ⅱ的焓变△H2=(﹣49.58kJ•mol﹣1)﹣(﹣90.77kJ•mol﹣1)=+41.19 kJ•mol﹣1;根正反应是吸热反应升高温度平衡正向移动,
故答案为:+41.19 kJ•mol﹣1;正向;
(2)①A:n(H2)=3mol,n(CO2)=1.5mol,B:n(H2)=3mol,n(CO2)=2mol,二者比较B相当于增大二氧化碳的量,转化率小于A,所以曲线Ⅱ代表B的投料,
故答案为:B;
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
初始浓度:0.5 1 0 0
变化浓度:0.3 0.9 0.3 0.3
平衡浓度:0.2 0.1 0.3 0.3
a.该温度下,反应I的平衡常数K==450,
500K时,若在此容器中开始充入0.3molH2和0.9mol CO2、0.6molCH3OH、xmolH2O,浓度分别为0.1mol/L,0.3mol/L,0.2mol/L, mol/L
若使反应在开始时正向进行,浓度商Qc=<K=450
x=2.025
则x应满足的条件是0<x<2.025
故答案为:450,0<x<2.025;
b.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为,
故答案为:
;
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2﹣)在其间通过,分析该电池的工作原理如图3所示可知负极是甲烷失电子发生氧化反应,结合导电离子和电荷守恒分析书写电极反应为:CH3OH﹣6e﹣+3O2﹣=CO2↑+2H2O,
故答案为:CH3OH﹣6e﹣+3O2﹣=CO2↑+2H2O;
②16g甲醇物质的量==0.5mol,发生反应时电子转移0.5mol×6=3mol,则理论上提供的电量最多为3mol×9.65×104C•mol﹣1=2.895×105 C,
故答案为:2.895×105 C.
36.
(1)①C+2NON2+CO2;②;C;③cd;(2)①SO2+I2+2H2O=SO42﹣+2I﹣+4H+;②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;(3)负;O2+4e﹣+4H+=2H2O
37.
(1)①吸热 (1分) ②0.2 (2分) 0.0025 mol·L—1·s—1 (2分)
(2)B > (每空2分)
(3)N2+6H++6e-=2NH3 (3分)
(4)2△H1—3△H2+4△H3 (3分)
考查化学反应速率、化学平衡和化学反应与能量。以氮的固定为载体,要求根据平衡常数的变化判断N2、O2反应生成NO的焓变;并根据平衡常数进行计算求平衡时相关物质的量和反应速率:
N2(g) + O2(g) 2NO(g)
平衡时(mol) 0.3—x/2 0.3—x/2 x
因为反应前后气体气体物质的量相等,此时平衡常数值与体系的体积无关,故直接用平衡时各气体的物质的量代入平衡常数式中计算:x2/(0.3—x/2)2=1 解得x=0.2,v(N2)=0.1 mol/(2 L×20 s)=0.0025 mol·L—1·s—1。
根据氮氢合成氨的化学方程式和温度压强对平衡的影响判断坐标图的正误,和温度的高低。
要求根据电解装置图和电解原理分析电解法合成氨的电极反应:
阳极:H2—2e-=2H+ ×3
阴极:N2+6e-+6H+=2NH3
要求根据合成氨、氢气燃烧和氨溶于水的三个过程的焓变,求2N2(g)+6H2O(l) 4NH3(aq)+3O2(g)的△H。
38.
(1)D (2分) (2))25/12 (或2.08) (2分);增大(2分)
(3) c(Cl-)>c(NH4+)>c(H+)>c(OH-) (2分)
(4) CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 (2 分) (未写沉淀符号不扣分)
(5) N2+6e-+6H+ = 2NH3 (2 分) (6)+1530.0kJ·mol-1 (2分) (不写“+”、没写单位均不计分)
试题分析:(1)B.此反应为放热反应,且向体积减小的方向进行,△H>0,且是熵境故D正确;A.△S>0,故A正确;(2)1molNH3和10-3molHCl反应生成NH4Cl,溶液中氯化铵物质的量为10-3mol,一水合氨物质的量1-0.001=0.999mol;所以溶液中离子浓度大小为:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
(2)K==25/12;
保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,平衡向正方向进行,氢气的转化率将增大;
(3)1molNH3和10-3molHCl反应生成NH4Cl,溶液中氯化铵物质的量为10-3mol,一水合氨物质的量
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入足量的CO2,过滤后即可得到(NH4)2SO4.沉淀为CaCO3,说明CaCO3更难溶,CaSO4与CaCO3的构成类型相同为AB型,相同类型溶解度越小,溶度积越小,故Ksp(CaSO4)>Ksp(CaCO3),该过程的化学方程式为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4;
(5)电解池中氮气在阴极得电子生成氨气,其电极方程式为:N2+6e-+6H+=2NH3;
(6)已知:①N2(g)+3H2(g)2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1。
39.
(1)污染小;可再生;来源广;资源丰富;燃烧热值高;H2+2OH--2e-=2H2O
(2)<
(3)ac
(4)光能转化为化学能
(5)①阳极室
②防止Na2FeO4与H2反应使产率降低
③M点:c(OH-)低,Na2FeO4稳定性差,且反应慢
N点:c(OH-)过高,铁电极上有Fe(OH)3(Fe2O3)生成,使Na2FeO4产率降低。
试题分析:(1)与汽油相比,氢气作为燃料的优点有污染小;可再生;来源广;资源丰富;燃烧热值高等,碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O,故答案为:污染小;可再生;来源广;资源丰富;燃烧热值高;H2+2OH--2e-=2H2O
(2)①H2(g)+A(l)=B(l) ΔH1,②O2(g)+B(l)=A(l)+H2O2(l) ΔH2,两反应的ΔS<0,根据ΔG=ΔH-TΔS,因为均为两反应自发反应,因此ΔH均小于0,将①+②得:H2(g)+ O2(g)= H2O2(l)的ΔH=ΔH1+ΔH1<0,故答案为:<;
(3)MHx(s)+yH2(g)MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。a.平衡时气体的物质的量不变,压强不变,正确;b.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;c.降低温度,平衡向正反应分析移动,平衡常数增大,正确;d.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误。
(4)利用天阳能直接分解水制氢,是将光能转化为化学能,故答案为:光能转化为化学能。
(5)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH−)降低的区域在阳极室,故答案为:阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,故答案为:防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,故答案为:M点:c(OH-)低,Na2FeO4稳定性差,且反应慢,或N点:c(OH-)过高,铁电极上有Fe(OH)3(Fe2O3)生成,使Na2FeO4产率降低。
【名师点晴】本题考查的知识点较多,以氢气利用为线索考查了化学反应中的能量变化、电解原理及其应用、化学平衡的移动及其影响因素等相关知识。在书写燃料电池电极反应时,要注意掌握一般的书写方法:①电极反应是一种离子反应,遵循书写离子反应的所有规则;②将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;③负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);④溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。本题的易错点和难点是c(Na2FeO4)低于最高值的原因分析。分析时,要注意从题目中寻找线索并结合反应的特征分析。
40.
(1)C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90.0 kJ•mol﹣1;高温;
(2)①0.009 mol/(L•min);
②AD;
(3)75%;
(4)①2.24L;
②Cu2+;280.
【考点】化学平衡的影响因素;用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理;化学平衡的计算.
【专题】化学平衡专题;电化学专题.
【分析】(1)根据盖斯定律来写出碳与水蒸气反应生成一氧化碳和氢气的热化学方程式;根据反应能否自发进行的判据来回答;
(2)反应前后是气体体积不变的反应,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度,或加入一氧化氮达到新平衡后个物质浓度增大;
(3)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算;
(4)①工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气;A电极为阳极,溶液中的氢氧根离子失电子生成氧气;阳极电极反应和电子守恒计算得到;
②C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.
【解答】解:(1)已知①C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol﹣1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.3kJ•mol﹣1
根据盖斯定律,将①﹣②可得:C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90kJ•mol﹣1,反应的焓变△H>0,△S>0,根据反应自发进行的判据
△H﹣TS<0,所以需要高温下发生,
故答案为:C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90.0 kJ•mol﹣1;高温;
(2)①10~20min内,N2的平均反应速率v(N2)=mol/(L•min)=0.009 mol/(L•min),
故答案为:0.009 mol/(L•min);
②30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大;
A.通入一定量的NO,反应正向进行,达到平衡后一氧化氮、氮气、二氧化碳浓度增大,故符合;
B.加入一定量的活性炭是固体,对平衡无影响,故不符合;
C.加入合适的催化剂,只能改变化学反应速率,不能改变平衡,浓度不变,故不符合;
D.适当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但个物质浓度增大,符合要求,故符合;
故答案为:AD;
(3)设CO的浓度变化量为c,三段式法用c表示出平衡时各组分个浓度,
CO(g)+H2O(g)H2(g)+CO2(g),
起始(mol/L):0.02 0.020 0 0
转化(mol/L):c c c c
平衡(mol/L):0.02﹣c 0.02﹣c c c
代入500℃时反应平衡常数有k===9,解得c=0.015,
CO的最大所以转化率为×100%=75%,
故答案为:75%;
(4)①工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e﹣=Cu,
0.1mol 0.2mol
2H++2e﹣=H2↑,
2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH﹣﹣4e﹣=2H2O+O2↑,
4x x
得到0.2+2x=4x,
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L,
故答案为:2.24L;
②根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(2)计算得到电子转移应为0.4mol,对比图象,可知此时溶液中为Fe2+ 0.5mol,和Cu2+离子0.2mol.需要加入NaOH溶液1.4mol,体积为280ml,
故答案为:Cu2+;280.
【点评】本题综合性较大,涉及化学反应自发性判断、化学平衡常数、化学平衡影响因素、等效平衡计算以及电化学知识等,难度较大.