- 264.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2009届新课标高考化学试题创新设计(2008年9月第2期)
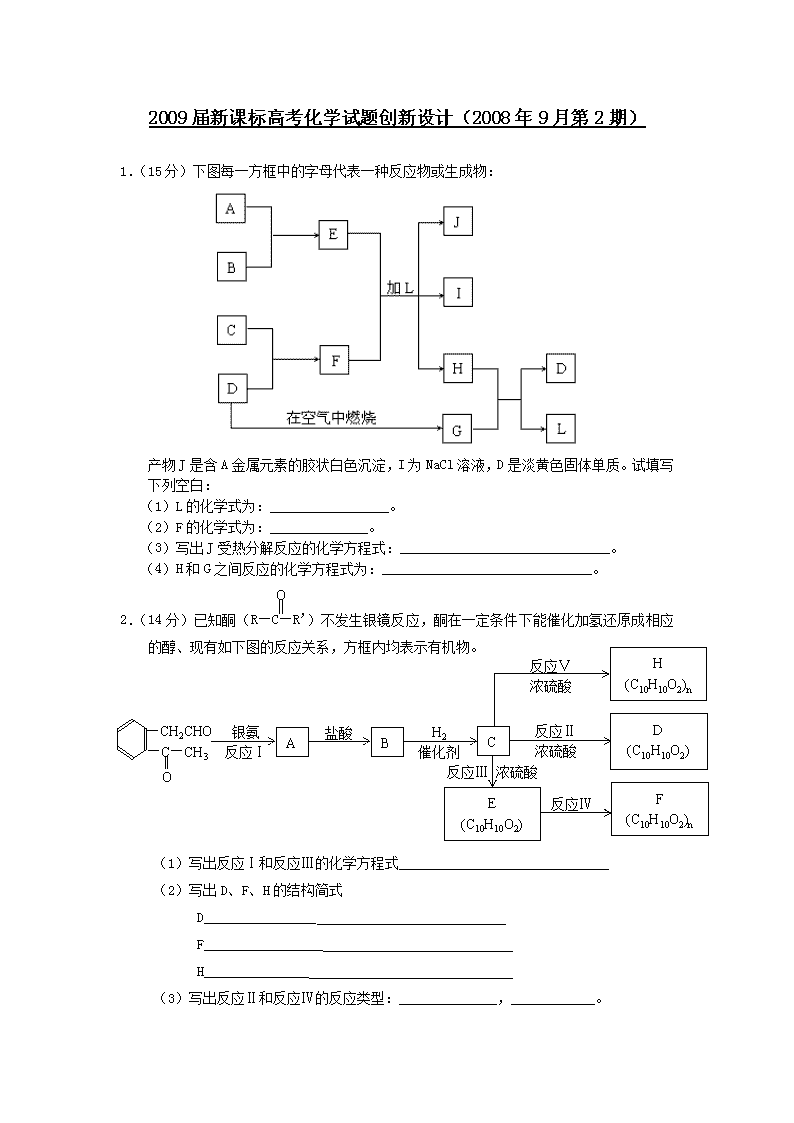
1.(15分)下图每一方框中的字母代表一种反应物或生成物:
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为:_________________。
(2)F的化学式为:______________。
(3)写出J受热分解反应的化学方程式:______________________________。
(4)H和G之间反应的化学方程式为:______________________________。
O
H
(C10H10O2)n
D
(C10H10O2)
F
(C10H10O2)n
C
反应Ⅱ
浓硫酸
反应Ⅴ
浓硫酸
反应Ⅳ
E
(C10H10O2)
反应Ⅲ 浓硫酸
B
H2
催化剂
A
盐酸
银氨
反应Ⅰ
—CH2CHO
—C—CH3
O
2.(14分)已知酮(R—C—R’)不发生银镜反应,酮在一定条件下能催化加氢还原成相应的醇、现有如下图的反应关系,方框内均表示有机物。
(1)写出反应Ⅰ和反应Ⅲ的化学方程式______________________________
(2)写出D、F、H的结构简式
D________________
F_________________
H_______________
(3)写出反应Ⅱ和反应Ⅳ的反应类型:______________,____________。
3.(13分)将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol·L-1的NaOH溶液。当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加。当NaOH的体积V2=650mL时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小。当V3≥750mL时,沉淀量不再改变。
(1)最初加入的50mL NaOH溶液的作用是什么?
答: 。
(2)计算所用硫酸的浓度。
(3)若二种氧化物均为高中常见的氧化物,试判断两种氧化物各是什么,并计算其物质的量。
4.(10分)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
已知:有机物A的相对分子质量为134;经分析得知,其中氢和氧的质量分数之和为19.4%,其余为碳。有机物A、E中均含有苯环结构,且苯环上的一溴代物只有两种,它们都能与FeCl3溶液发生显色反应;有机物C能发生眼镜反应。下图表示有机物A~H的转化关系。
请回答下列问题:
(1)化合物A中含有的碳原子数为_________,该化合物的分子式是_________________。
(2)写出下列化合物的结构简式:
A___________________________________________,
C___________________________________________,
E___________________________________________。
(3)写出由F发生臭氧化还原水解反应生成G的化学反应式(有机物写结构简式):
______________________________________________________________________。
(4)化合物H(C7H6O2)的含有苯环且侧链无其它环的所有同分异构体共有________种。
5.(15分) 甲、乙、丙、戊的空间结构都是正四面体,单质甲和化合物乙在高温下可以发生置换反应,丙、丁、戊三种粒子含有相同的电子数,丁在常温下呈液态,它能电离生成2种等电子的微粒,戊是一种阳离子。
(1)写出单质甲和化合物乙发生的化学方程式
(2)丙是天然气的主要成分,丙和丁在催化、加热的条件下,能得到2种可燃性的气体,写出该化学方程式 ,丙和空气可作燃料电池,写出在碱性介质中该电池的正极反应式 。
(3)写出丁电离生成2种等电子微粒的电离方程式
(4)室温下,含有戊的盐溶液的PH 7(填“大于”、“小于”或“不能确定”)。
参考答案
20080924
1.(10分)(1)H2O (2分) (2)Na2S (2分)
(3)2Al(OH)3Al2O3+3H2O (3分)
(4)2 H2S+SO2==3S+2H2O (3分)
—CH2—CHO
—C—CH3
O
+2Ag(NH3)2OH
—CH2—C—ONH4
—C—CH3
O
+2Ag↓+3NH3+H2O
O
2.(14分)
(1)
O
O
—CH2—C—OH
—CH—CH3
OH
浓H2SO4
△
—CH2—C—OH
—CH=CH2
+H2O
—CH2—C—OH
O
[ C—C ]
H
H
H
[ O—CH
CH3
CH2CO ]
n
—CH2—C
O
—CH—O
CH3
(2)
(3)酯化反应(取代反应) 加聚反应
3.(1)中和过量的硫酸
(2)解:沉淀量最大时所用OH-的物质的量与100mL强酸中H+的物质的量相等,
n(OH-)=1.00mol·L-1×0.650L=0.650mol,故n(H+)也为0.650mol,硫酸的浓度为3.25mol·L-1
(3)解:在“考试说明”规定的内容范围内,由题意知,其中一种氧化物为Al2O3,
根据Al(OH)3+OH-=AlO2-+2H2O
该反应用去的n(NaOH)=1.00mol·L-1×(0.750-0.650)L=0.100mol
故Al(OH)3为0.100mol,而Al2O3为0.0500mol
根据Al3++3OH-=Al(OH)3
生成Al(OH)3用去0.300mol NaOH。而生成另一种氢氧化物也用去0.300mol NaOH,且已知两种氧化物的物质的量相等,故另一种氧化物也是三价金属的氧化物,且不溶于过量碱溶液中,可知其为Fe2O3。
Fe2O3的物质的量为0.0500mol。
4.(10分)
(1)9(2分) C9H10O(2分)
(2)(1分)//(1分)
//(1分)。
(3)(2分)
(4)5(1分)
5.(15分)分析:常见为正四面体的结构的物质有:由原子构成的有金刚石、硅、二氧化硅,由分子构成的有白磷、甲烷、四氯化碳等,由阳离子构成的有铵根离子,其中“单质甲和化合物乙”可以发生置换反应,故甲是金刚石,乙是SiO2,生成正四面体结构的Si。丙是“天然气的成分”,即是CH4、戊是NH4+,丁是 H2O,它电离生成10电子的OH- 和H3O+ 。
高温
(1)2C+SiO2 == Si +2CO
高温
(2) C+H2O == CO+H2 O2+4e-+4OH-=2H2O
20080924
(3) 2 H2O OH- +H3O+
(4) 不能确定 (每空3分,共15分)