- 78.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
经典高考原电池电解池离子交换膜问题
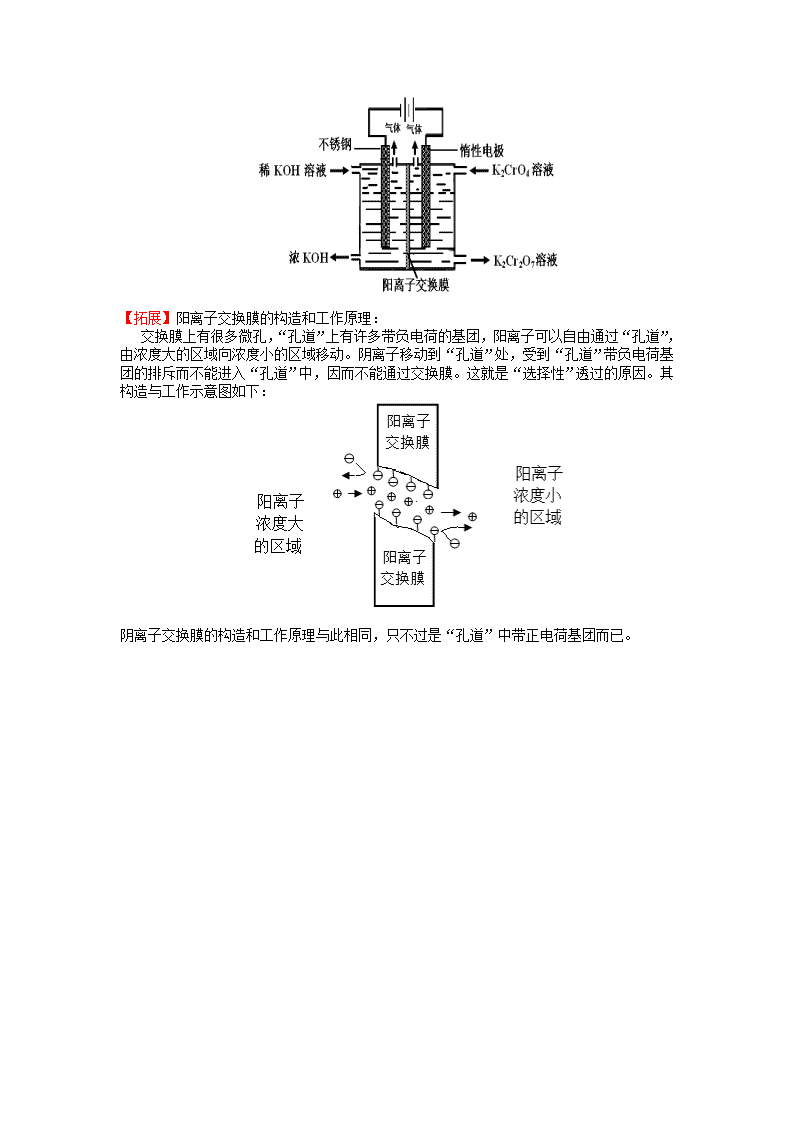
【试题】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是
A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2+2H+ +H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量。若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-
【答案】D
【解析】根据实验装置图可知:阴极(不锈钢)发生的反应为2H2O+2e-=2OH-+H2↑;因为是最高价含氧酸根,不可能在阳极 (惰性电极)失去电子,阳极发生的反应为2H2O—4e-=4H++O2↑,产生的H+使平衡2+2H+ +H2O向右移动,即生成K2Cr2O7,溶液逐渐由黄色变为橙色。阳极室中多余的K+通过阳离子交换膜移向阴极室,平衡两室中的电荷。电解过程中实质是电解水,一段时间以后,阴极室KOH溶液浓度增大。
D选项:在阳极室中,电解前是K2CrO4溶液,其K与Cr的物质的量之比值为2,电解后若K2CrO4完全转化为K2Cr2O7,其K与Cr的物质的量之比值为1,则1≤d≤2。在1≤d≤2时,铬酸钾的转化率α为100%≤α≤0。
[巧解]将d的取值范围1≤d≤2代入题设的“式子: 1-”,铬酸钾的转化率α为50%≤α≤100%,与事实相悖。
n(K) 2(1 mol—x mol) + x mol
n(Cr) (1 mol—x mol) + x mol
=
= d
[推导]设1 mol K2CrO4有x mol转化为K2Cr2O7,即生成x/2 mol K2Cr2O7,还余 (1 mol—x mol) K2CrO4,故有:
解得 x =2—d mol 即铬酸钾的转化率α= 100(2—d)%
【点评】本题以电解法制备重铬酸钾工业生产实际为背景材料,考查电化学知识、平衡移动和转化率的简单计算。要求掌握离子在电极上的放电次序、正确书写电极反应和电池反应或正确判断电极反应和电池反应的正误、阳离子交换膜的作用、平衡移动的原因、转化率的概念及其计算或转化率公式的推导。思维跨度大,思考容量大。工业生产的最大亮点是:用阳极水放电产生的H+促进转化为,同时得到副产物KOH。命题的最大亮点是利用教材中在不同pH中与互相转化及其溶液的颜色变化,与电解知识联系起来,考查综合运用知识的能力。
【商榷】(1)“比”与“比值”是两个不同的概念。题设的“K与Cr的物质的量之比为d”,准确地说这里的d不是比而是K与Cr的物质的量之比值。
(2)题给的实验装置图如果改用教材中工业上电解饱和食盐水的装置图岂不更好!
【拓展】阳离子交换膜的构造和工作原理:
交换膜上有很多微孔,“孔道”上有许多带负电荷的基团,阳离子可以自由通过“孔道”,由浓度大的区域向浓度小的区域移动。阴离子移动到“孔道”处,受到“孔道”带负电荷基团的排斥而不能进入“孔道”中,因而不能通过交换膜。这就是“选择性”透过的原因。其构造与工作示意图如下:
阴离子交换膜的构造和工作原理与此相同,只不过是“孔道”中带正电荷基团而已。