- 464.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高中化学学业水平测试复习纲要——必修1
1. 托盘天平精确到0.1g,量筒精确到0.1mL。
2. 可直接加热的仪器:试管﹑蒸发皿、坩埚。
3. 点燃可燃气体(氢气、甲烷等)前要验纯。
4. 酒精着火应迅速用湿抹布盖灭,钠、钾着火用细沙盖灭。
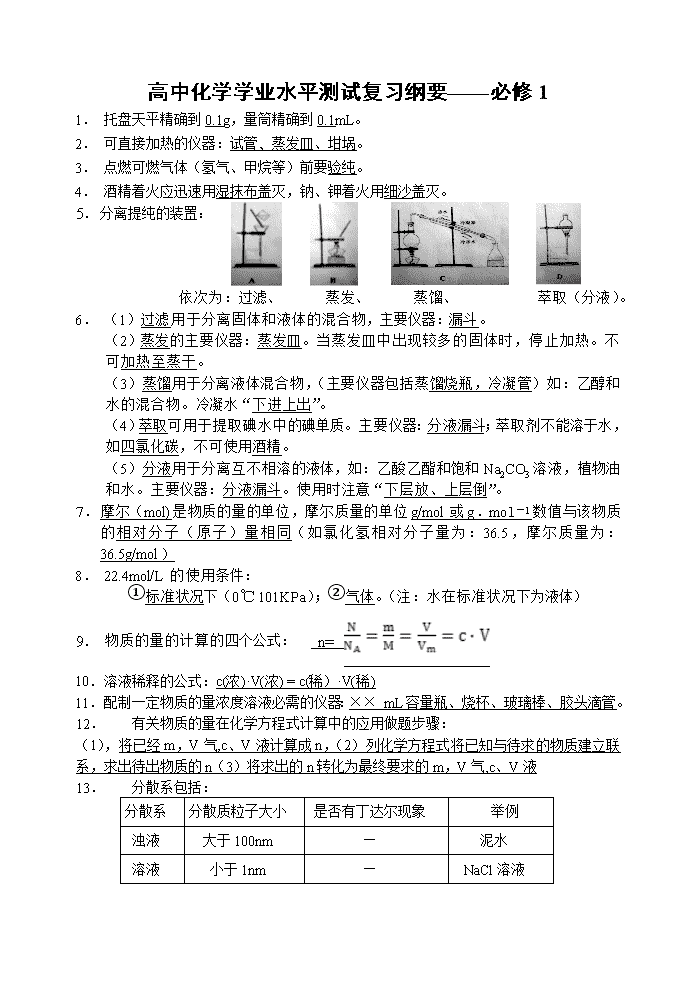
5. 分离提纯的装置:
依次为:过滤、 蒸发、 蒸馏、 萃取(分液)。
6. (1)过滤用于分离固体和液体的混合物,主要仪器:漏斗。
(2)蒸发的主要仪器:蒸发皿。当蒸发皿中出现较多的固体时,停止加热。不可加热至蒸干。
(3)蒸馏用于分离液体混合物,(主要仪器包括蒸馏烧瓶,冷凝管)如:乙醇和水的混合物。冷凝水“下进上出”。
(4)萃取可用于提取碘水中的碘单质。主要仪器:分液漏斗;萃取剂不能溶于水,如四氯化碳,不可使用酒精。
(5)分液用于分离互不相溶的液体,如:乙酸乙酯和饱和Na2CO3溶液,植物油和水。主要仪器:分液漏斗。使用时注意“下层放、上层倒”。
7. 摩尔(mol)是物质的量的单位,摩尔质量的单位g/mol或g.mol-1数值与该物质的相对分子(原子)量相同(如氯化氢相对分子量为:36.5,摩尔质量为:36.5g/mol)
8. 22.4mol/L的使用条件:
①标准状况下(0℃ 101KPa);②气体。(注:水在标准状况下为液体)
9. 物质的量的计算的四个公式: n=
10. 溶液稀释的公式:c(浓)·V(浓) = c(稀)·V(稀)
11. 配制一定物质的量浓度溶液必需的仪器:×× mL容量瓶、烧杯、玻璃棒、胶头滴管。
12. 有关物质的量在化学方程式计算中的应用做题步骤:
(1),将已经m,V气,c、V液计算成n,(2)列化学方程式将已知与待求的物质建立联系,求出待出物质的n(3)将求出的n转化为最终要求的m,V气,c、V液
13. 分散系包括:
分散系
分散质粒子大小
是否有丁达尔现象
举例
浊液
大于100nm
—
泥水
溶液
小于1nm
—
NaCl溶液
胶体
1~100nm
有
Fe(OH)3胶体
1. Fe(OH)3胶体的制备方法:是FeCl3+沸水,不是FeCl3+NaOH;区分胶体与溶液的方法是:丁达尔效应(用光束照射有光亮的通路)。胶体与其它分散系本质区别是:分散质粒子直径在1~100nm之间而不是丁达尔效应。
2. 常见的电解质有:酸、碱、盐等,其在水溶液中能发生电离。酸碱盐的溶液不是电解质。电离方程式:
如H2SO4= 2H++SO42- Ba(OH)2 =Ba2+ +2OH- Na2CO3 = 2Na++ CO32-
3. 在离子反应中可以拆开的物质:
强酸(HCl、H2SO4、HNO3)、
强碱[KOH、NaOH、Ba(OH)2、Ca(OH)2]、
可溶性盐(钾、钠、铵盐个个拆,硝酸盐类也相同,氯化物仅银(AgCl)不拆,硫酸盐仅钡(BaSO4)不拆,碳酸盐拆钾钠铵,)
4. 离子方程式典型错误:
1) 电荷、原子不守恒,如:Fe+Fe3+=2Fe2+、Na+H2O=Na++OH-+H2
2) 拆分错误,如:
碳酸钙与稀盐酸反应不能写成:CO32-+2H+ = CO2↑+H2O,
应写成:CaCO3+2H+ =Ca2++ CO2↑+H2O
3) 化学原理错误,如:Fe和HCl反应不能写成2Fe+6H+=2Fe3++3H2↑,
应写成Fe+2H+=Fe2++H2↑;
5. 不能与H+共存的离子有:OH-、CO32-、HCO3-
6. 不能与OH-共存的离子有:除K+、Na+、Ba2+、Ca2+以外的所有阳离子、HCO3-
7. 不能与CO32-共存的离子有:除K+、Na+、NH4+以外的所有阳离子
8. Cl-不能与Ag+共存。 SO42-不能与Ba2+共存。
9. 有色离子有:Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、MnO4-(紫红色)
10. 反应前后元素化合价发生变化的反应是氧化还原反应。一般而言,有单质参与的反应一定是氧化还原反应。
11. 氧化还原的口决:升 失 氧化(2) 还原剂(性);化合价升高的元素失去电子,含该元素的反应物被氧化,发生了氧化反应,该物质是还原剂,具有还原性。 降 得 还原(2) 氧化剂(性)(与上解释方法相同)。
12. 氧化还原相关分析首先从化合价变化入手。
13. 化合价口诀:钾钠氢银铵正一,钙镁钡锌铜正二,铝铁正三,亚铁二,氢氧硝酸氯负一,硫酸碳酸氧负二,其他元素需计算。
14. 金属钠存放在煤油中。 氯水存放在棕色瓶中。
15. 氢氧化钠溶液在存放时不能使用玻璃塞而用橡胶塞。
16. 钠是质软、密度小、熔点低,遇盐溶液先和水反应。
1. 过氧化钠为淡黄色粉末,可作供氧剂。
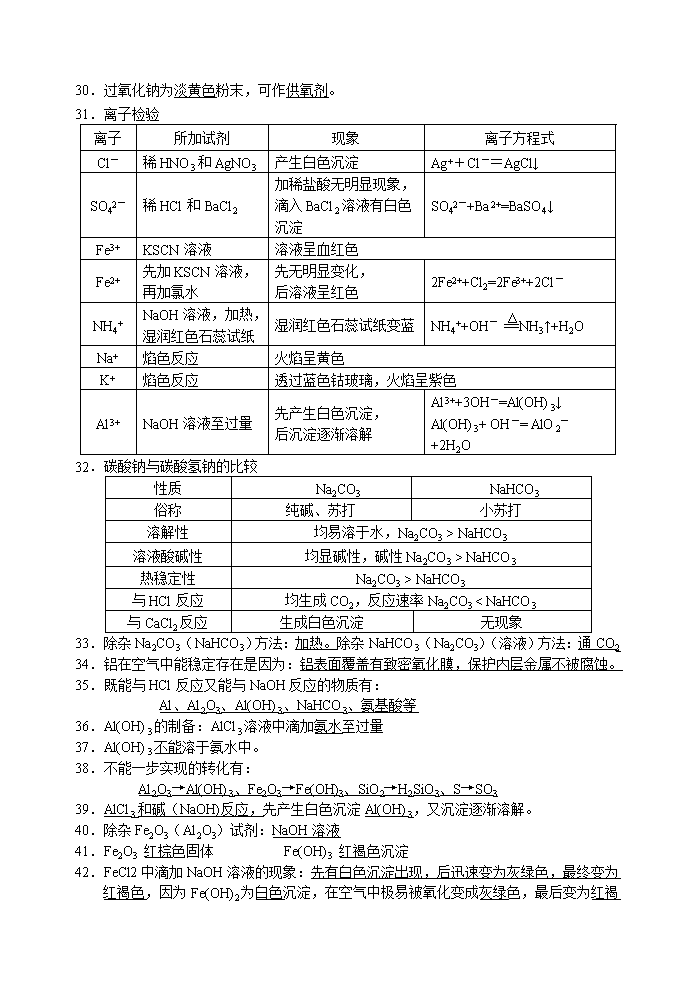
2. 离子检验
离子
所加试剂
现象
离子方程式
Cl-
稀HNO3和AgNO3
产生白色沉淀
Ag++Cl-=AgCl↓
SO42-
稀HCl和BaCl2
加稀盐酸无明显现象,滴入BaCl2溶液有白色沉淀
SO42-+Ba2+=BaSO4↓
Fe3+
KSCN溶液
溶液呈血红色
Fe2+
先加KSCN溶液,
再加氯水
先无明显变化,
后溶液呈红色
2Fe2++Cl2=2Fe3++2Cl-
NH4+
NaOH溶液,加热,
湿润红色石蕊试纸
湿润红色石蕊试纸变蓝
NH4++OH- NH3↑+H2O
Na+
焰色反应
火焰呈黄色
K+
焰色反应
透过蓝色钴玻璃,火焰呈紫色
Al3+
NaOH溶液至过量
先产生白色沉淀,
后沉淀逐渐溶解
Al3++3OH-=Al(OH)3↓
Al(OH)3+ OH-= AlO2-+2H2O
3. 碳酸钠与碳酸氢钠的比较
性质
Na2CO3
NaHCO3
俗称
纯碱、苏打
小苏打
溶解性
均易溶于水,Na2CO3 > NaHCO3
溶液酸碱性
均显碱性,碱性Na2CO3 > NaHCO3
热稳定性
Na2CO3 > NaHCO3
与HCl反应
均生成CO2,反应速率Na2CO3 < NaHCO3
与CaCl2反应
生成白色沉淀
无现象
4. 除杂Na2CO3(NaHCO3)方法:加热。除杂NaHCO3(Na2CO3)(溶液)方法:通CO2
5. 铝在空气中能稳定存在是因为:铝表面覆盖有致密氧化膜,保护内层金属不被腐蚀。
6. 既能与HCl反应又能与NaOH反应的物质有:
Al、Al2O3、Al(OH)3、NaHCO3、氨基酸等
7. Al(OH)3的制备:AlCl3溶液中滴加氨水至过量
8. Al(OH)3不能溶于氨水中。
9. 不能一步实现的转化有:
Al2O3→Al(OH)3、Fe2O3→Fe(OH)3、SiO2→H2SiO3、S→SO3
10. AlCl3和碱(NaOH)反应,先产生白色沉淀Al(OH)3,又沉淀逐渐溶解。
11. 除杂Fe2O3(Al2O3)试剂:NaOH溶液
12. Fe2O3 红棕色固体 Fe(OH)3 红褐色沉淀
13. FeCl2中滴加NaOH溶液的现象:先有白色沉淀出现,后迅速变为灰绿色,最终变为红褐色,因为Fe(OH)2为白色沉淀,在空气中极易被氧化变成灰绿色,最后变为红褐
色Fe(OH)3沉淀
1. 除杂FeCl2(FeCl3)方法:加铁粉
2. 除杂FeCl3(FeCl2)方法:通氯气或加氯水
3. 单质硅是半导体材料,可用于制硅芯片、太阳能电池板等
4. SiO2是制玻璃的原料,还可制光导纤维。
5. 常用的硅酸盐材料包括:玻璃、陶瓷和水泥。
6. 氯气:黄绿色气体,有刺激性气味,密度大于空气,有毒
7. Fe在Cl2中燃烧,生成FeCl3,不是FeCl2
8. H2在Cl2中燃烧,苍白色火焰。
9. 氯气溶于水生成盐酸HCl和次氯酸HClO(有漂白性)
10. 氯气具有强氧化性,可用于消毒、杀菌、漂白。
11. 氯气可使品红溶液褪色,且红色不可恢复。
12. 漂白粉的有效成分:Ca(ClO)2
13. NO为无色气体,极易与O2反应生成红棕色的NO2
14. NO2红棕色﹑有刺激性气味的气体,易溶于水,有毒,NO2与水反应生成硝酸和NO
15. 二氧化硫:无色、有刺激性气味的气体,易溶于水,有毒
16. SO2可使品红溶液褪色,但加热后红色可以恢复
17. 浓H2SO4和C反应产生的SO2和CO2的鉴别现象:
A检验SO2,品红褪色,B除去SO2,C检验SO2是否除尽;C不褪色,D变浑浊,说明有CO2存在。
18. 制取氨气装置图:氨气用向下排空气法收集,干燥氨气不选浓硫酸,而选碱石灰。
19. NH3为无色﹑有刺激性气味的气体,密度比空气小,易溶于水形成氨水
20. 氨气的检验:湿润的红色石蕊试纸变蓝
21. 铵盐与碱加热,一定生成NH3
22. 浓硫酸能作氢气,二氧化碳的干燥剂,但不能干燥氨气(NH3)会反应。
23. 浓硫酸与金属反应不能生产氢气
24. 浓硫酸加热能与Cu反应,生成SO2,不生成H2
25. 硝酸与金属反应不能生成氢气
1. 常温下,铝或铁遇浓硫酸或浓硝酸发生钝化(化学变化)。
高中化学学业水平测试复习纲要——必修2
1. 元素周期表的横行称为周期,共有7个周期,1~3周期为短周期共有18种元素。将前18号元素填于下表中:
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
2.元素周期表的纵行称为族,共有7个主族,主族的表示方法:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA。
2. 第三周期元素(11~17号元素)性质比较
原子序数
11
12
13
14
15
16
17
元素符号
Na
Mg
Al
Si
P
S
Cl
元素名称
钠
镁
铝
硅
磷
硫
氯
原子半径
大→小
元素性质
→ 金属性减弱,非金属性增强 →
最高正价
+1
+2
+3
+4
+5
+6
+7
最高价氧化物的水化物及其酸碱性
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性
H2SiO3
弱酸
H3PO4
中强酸
H2SO4
强酸
HClO4
强酸
递变性
→ 碱性减弱,酸性增强 →
最低负价
——
——
——
-4
-3
-2
-1
氢化物
——
——
——
SiH4
PH3
H2S
HCl
氢化物稳定性
→ 稳定性增强 →
3. 元素金属性越强,越容易与水或酸反应生成氢气,其最高价氢氧化物碱性越强。
元素非金属性越强,越容易与H2反应生成氢化物,其氢化物越稳定,其最高价含氧酸酸性越强。
4. 周期表中,左下方元素,原子半径大,元素金属性最强。
5. 周期表中,右上方元素,原子半径小,元素非金属性最强
6. 短周期元素中,原子半径最大的是Na,最小的是H;
最活泼的金属是Na,最活泼的非金属是F,
最强的碱是NaOH,最强的含氧酸是HClO4,最稳定的氢化物是HF。
7. 除稀有气体外,O元素和F元素没有正价。
8. 在周期表中金属与非金属的分界处可以找到半导体材料。如:Si
9. 核素的表达:
符号,其中:质量数= A、 质子数= Z、 中子数= A-Z、 电子数= Z
原子序数=核电核数=质子数=原子的核外电子数
质量数(A)=质子数(Z)+中子数(N)
如: 其中:质量数=14,质子数=6,中子数=14-6=8,电子数=6
1.
同位素:质子数相同,中子数不同的原子互为同位素。如H、H、H
2. 判断离子键和共价键的方法:离子键存在于金属离子[或铵根离子(NH4+)]与阴离子之间;共价键存在于非金属元素之间。
3. 离子化合物:
含有金属元素或铵根离子(NH4+)的化合物。如:NaCl、CaCl2、NaOH等。
共价化合物:
全部由非金属元素组成的化合物(除铵盐)。如:H2O、CO2、H2SO4等。
4. 电子式:
化学式
电子式
化学式
电子式
H2
N2
H2O
CO2
NH3
CH4
NaCl
Cl2
HCl
MgCl2
Na2O
NaOH
5. 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因。
6. 断键吸收能量,形成键放出能量。
7. 放热反应:反应物的总能量>生成物的总能量;
吸热反应:反应物的总能量<生成物的总能量。
8. 常见的放热反应有:
金属与酸的反应,酸碱中和反应,燃烧反应,大部分的化合反应(除了C+CO2 高温
2CO),氧化钙与水反应,钠与水反应,铝热反应(如铝与氧化铁反应)等
1. 常见的吸热反应有:
氢氧化钡晶体与氯化铵的反应、大部分的分解反应(如碳酸钙受热分解)
2. 原电池是将化学能转变为电能的装置。其中较活泼的金属做负极。
负极失电子发生氧化反应,电子从负极到正极。(负 活 失 氧)
3. 原电池工作原理:
例:Cu-Zn(稀硫酸)原电池:
负极(Zn片):
Zn-2e-=Zn2+(Zn片溶解)(氧化反应)
正极(Cu片):
2H++2e-=H2↑(Cu片有气泡产生)(还原反应)
电子流动方向:从Zn片沿导线流向Cu片
电流方向:从Cu到Zn
4. 影响化学反应速率的条件有:
①温度(温度越高,速率越大) ②气体压强(气压越大,速率越大)
③反应物的浓度(一般浓度越大,速率越大) ④催化剂
⑤固体表面积(粉状比块状速率大)等。
5. H2O2分解的催化剂有MnO2或FeCl3。
6. 对于可逆反应,反应物不可能全部转化为生成物。
7. 当可逆反应达到平衡状态时:
① 正反应速率=逆反应速率≠0;
② 各物质的量保持恒定;(①②为达到平衡状态的标志)
③ 达到了该条件下该反应所能进行的最大限度;
④此时,所有的反应物和生成物同时存在。
8. 天然气的主要成分为甲烷。
9. 石油分分馏属于物理变化,煤的干馏属于化学变化。
10. 工业中的乙烯来自于石油的裂解,苯来自于煤的干馏。
11. 甲烷的结构式为 ,空间为正四面体结构。
12. 同分异构体具有相同的分子式,如:丁烷(C4H10)有正丁烷()、
异丁烷()两种同分异构体;
1. 乙烯的结构简式为CH2=CH2,结构中存在碳碳双键。
2. 苯的结构中不存在碳碳双键。
3. 乙烯、苯空间结构都是平面型。
4. 乙醇的官能团为羟基(—OH)
5. 乙酸的官能团为羧基(—COOH)
6. 甲烷、乙烯常温下为气体
7. 苯、乙醇、乙酸常温下为液体,
其中苯不能溶于水,乙醇、乙酸易溶于水。
8. 甲烷可以发生取代反应
9. 乙烯易发生加成反应,可以使溴水褪色。
乙烯具有还原性,能使酸性高锰酸钾溶液褪色。
10. 甲烷、乙烯可用溴水或高锰酸钾溶液鉴别。
11. 乙烯可以做催熟剂(又叫植物生长调节剂)。
12. 苯易发生取代反应,可以发生加成反应,不能使高锰酸钾溶液褪色。
13. 乙醇可发生取代反应,易被氧化(高锰酸钾或O2),能与Na反应生成H2
14. 常见的高分子化合物有:
纤维素(棉花、麻)、淀粉、蛋白质(羊毛、蚕丝)、聚乙烯
15. 乙酸具有酸性,能与乙醇生成乙酸乙酯(酯化反应或取代反应)
16. 常见有机反应类型:①取代反应 Ax+By→Ay+Bx
②加成反应 A+B→C
③氧化反应:反应物中有O2、高锰酸钾等物质
17. 会引起温室效应的气体CO2,会引起酸雨的气体SO2(主要)和NO2
18. 金属冶炼的方法:K Ca Na Mg Al ︳Zn Fe Sn Pb (H) Cu︳Hg Ag
电解熔融物法 ︳热还原法 ︳热分解法
常见的还原剂有:H2、CO、C、Al
19. 符合“绿色化学”的思想,原子利用率100%的反应类型有:化合反应、加成反应、加聚反应。
20. 三大合成材料:塑料、合成橡胶、合成纤维
高中化学学业水平测试复习纲要——选修1
1. 葡萄糖分子式C6H12O6,不能水解。
2. 葡萄糖的检验方法有:
(1)在碱性、加热的条件下,与银氨溶液反应析出银。该反应被称为葡萄糖的银镜反应。
(2)在碱性、加热的的条件下,与新制氢氧化铜反应产生砖红色沉淀(Cu2O)。
3. 葡萄糖为人体提供能量的化学方程式:
C6H12O6+6O2 6CO2+6H2O。
4. 淀粉是一种多糖,分子式(C6H10O5)n,其水解的最终产物为葡萄糖,
其化学方程式为:(C6H10O5)n(淀粉)+nH2O nC6H12O6(葡萄糖)。
5. 淀粉的检验:加碘水(含I2)变成蓝色。
6. 棉花、麻的成分为纤维素,其分子式为(C6H10O5)n,是一种多糖,其水解的最终产物为葡萄糖。淀粉和纤维素不是互为同分异构体的关系。
7. 油脂的主要成分为高级脂肪酸甘油酯,是单位质量提供热量最多的物质。
8. 油脂在酸性或酶的作用条件下水解生成高级脂肪酸和甘油;
在碱性条件下水解生成高级脂肪酸盐和甘油,
油脂的碱性水解又称为皂化反应。
9. 氨基酸的通式为,
分子中所包含的官能团有氨基(—NH2)和羧基(—COOH)
10. 羊毛、蚕丝属于蛋白质。检验蛋白质的简单方法:灼烧有特殊气味
11. 蛋白质的盐析是指向蛋白质溶液中加入某些浓的无机轻金属盐(如:NaCl、(NH4)2SO4、Na2SO4)后,蛋白质发生凝聚从溶液中析出的过程。
盐析是一个可逆过程,属物理变化。利用该反应可以进行蛋白质的分离和提纯。
12. 能使蛋白质发生变性有重金属盐、甲醛(福尔马林溶液)、强酸强碱、紫外线、加热等,误食重金属离子后应喝大量牛奶解毒。
13. 人体有8种氨基酸自身不能合成,称为必需氨基酸。
14. 维生素按照其不同的溶解性,分为脂溶性维生素(如维生素A、D、E和K)和水溶性维生素(如维生素C、B族)。
1. 维生素C又称抗坏血酸,是一种水溶性维生素,具有酸性和还原性,广泛存在于新鲜水果和绿色蔬菜中。
2. 碘是人体必需的微量元素,有“智力元素”之称。
缺碘会造成甲状腺肿大,补碘过量会造成甲状腺功能亢进。
在食物中,海带、海鱼等海产品中含碘最多。
加碘盐中添加的是碘酸钾(KIO3)。
3. 铁是人体中必需微量元素中含量最多的一种。
缺铁会发生缺铁性贫血。
含铁较多的食物有动物内脏、动物全血、肉类、鱼类、蛋类等。
4. 食物的酸碱性是按食物代谢产物的酸碱性分类的。
酸性食物
碱性食物
所含元素
C、N、S、P等
非金属元素
K、Na、Ca、Mg等
金属元素
举例
富含蛋白质的物质
如:肉类、蛋类、鱼类
蔬菜、水果等
5. 正常情况下,人体血液的pH总保持弱碱性范围(7.35~7.45)。
长期以来,我国居民由于摄入蔬菜水果偏少,一般尿液偏酸性。
6. 婴儿食品内不能加入任何着色剂。
7. 常用的调味剂有食盐、醋、味精、糖等。
8. 常用的防腐剂有苯甲酸钠、山梨酸钾、亚硝酸钠。
亚硝酸钠既是防腐剂又是发色剂。
9. 人工合成药物主要有_解热镇痛药、_抗生素_和_抗酸药_等
10. 阿司匹林具有解热镇痛作用。阿司匹林是人们熟知的治感冒药,具有_解热镇痛_作用,其化学名是_乙酰水杨酸_,是第一个重要的_人工合成药物_。阿司匹林是一种_有机酸_,白色晶体,_难溶_于水,但长期大量服用阿司匹林会有不良反应如_胃肠道反应_、水杨酸反应,出现后者这种情况是中毒的表现,应立即停药并静脉滴注NaHCO3溶液。
11. 青霉素是重要的抗生素,具有消炎作用,在使用之前要进行皮肤敏感试验(皮试),以防止过敏反应的发生。青霉素的钠盐被称为盘尼西林。
1. 胃酸成分为盐酸(HCl)。常见的抗酸药成分包括碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等,其与胃酸反应的化学方程式及离子方程式分别为:
NaHCO3 + HCl = NaCl + H2O + CO2 HCO3- + H+ = H2O + CO2
CaCO3 + 2HCl = CaCl2 + H2O +CO2 CaCO3 + 2H+ = Ca2+ +H2O + CO2
MgCO3 + 2HCl = MgCl2 + H2O + CO2 MgCO3 + 2H+ = Mg2+ + H2O + CO2
Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O Mg(OH)2 + 2H+ = Mg2+ + 2H2O
2. 麻黄碱属于天然中草药,具有止咳平喘的作用,是国际奥委会严格禁止的兴奋剂。
3. R表示处方药,OTC表示非处方药。
4. 合金是由两种或两种以上的金属 (或金属与非金属)熔合而成的具有金属特性的物质。与各成分的金属相比,其具有硬度大,熔点低的特点。
5. 金属的腐蚀可以分为化学腐蚀和电化学腐蚀,金属的腐蚀主要是电化学腐蚀。铁发生电化学腐蚀时的负极反应为Fe - 2e- = Fe2+
析氢腐蚀:正极反应:2H++2e-=H2
吸氧腐蚀:O2 + 2H2O+2e-= 4OH-
6. 生铁和钢是含碳量不同的的两种铁合金。
7. 防止金属腐蚀的方法有:
① 改变其内部结构(如制成不锈钢);
② 在金属表面添加保护膜(如刷漆、涂油、加塑料膜等);
③ 在要保护的金属上连接一块比该金属更活泼的金属(如Fe表面镀Zn)
8. 制造普通玻璃的主要原料是纯碱(Na2CO3)、石灰石(CaCO3)、石英(SiO2),反应方程式:Na2CO3+SiO2 Na2SiO3+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑
玻璃的主要成分是硅酸钠、硅酸钙、二氧化硅。
9. 在玻璃生产过程中加入不同的物质,调整玻璃的_化学组成_,可制成具有不同性能和用途的玻璃。例如,提高SiO2的含量或加入B2O3能提高玻璃的化学稳定性和降低它的热膨胀系数,从而使其_更耐高温_和_抗化学腐蚀_,可用于制造高级的_化学反应容器;加入_PbO后制得的光学玻璃折光率;加入某些金属氧化物可制成彩色玻璃:加入Co2O3玻璃呈蓝色,加入_Cu2O玻璃呈红色,我们看到的普通玻璃一般呈绿色,这是因为原料中混有_二价铁的缘故。
1. 制造陶瓷的主要原料是黏土。制造水泥的原料有石灰石和黏土。水泥具有水硬性,存放时应注意防潮。
2. 光导纤维的主要成分为SiO2,简称光纤。用作太阳能电池、芯片的为:Si
3. 通常所说的三大合成材料是指塑料、合成纤维和合成橡胶。
4. 塑料分为热塑性塑料和热固性塑料两种。
热塑性指的是塑料冷却后变固体,加热后又熔化,具有长链状的线性结构,常见的热塑性塑料聚乙烯_和_聚氯乙烯_。热固性指的是加工成型后就不会受热熔化,
具有_体型网状结构。
5. 酸雨是指pH小于5.6的降水,主要是SO2和NO2等酸性气体转化而成的。
SO2→H2SO4 SO2+H2OH2SO3 2H2SO3+O2 = 2H2SO4
NO→HNO3 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
6. 氟氯代烷(又叫“氟利昂”)会破坏臭氧层,这是由于氟氯代烷在紫外线的照射下分解出氯原子,对臭氧变为氧气起催化作用。
7. SO2主要来源于煤的燃烧,NO2主要来源于汽车尾气。
8. 温室气体CO2的主要来源:化石燃料的燃烧、乱砍滥伐等导致森林面积急剧减少等,可植树造林减少CO2。
9. 使用石灰石对煤炭进行脱硫:2CaCO3+2SO2+O2=2CaSO4+2 CO2(高温条件)
使用生石灰对煤炭进行脱硫:2CaO+2SO2+O2=2CaSO4(高温条件)
10. 汽车尾气系统中装置催化转化器,其化学方程式为2CO+2NO2CO2+N2
11. 装修材料的黏合剂中含有甲醛,天然大理石中含有放射性元素氡。
12. 水中的污染物种类繁多:①_重金属污染物_:主要包括汞、镉_、_铅_、_铬_;②生活污水的N、P等元素会引起水体的富营养化。
13. 污水处理的方法有混凝法(如明矾的净水明矾[KAl(SO4)2·12H2O]是常用的混凝剂,其净水的原理是:Al3++3H2OAl(OH)3(胶体)+3H+)、_中和法(如用Ca(OH)2中和酸性废水,用H2SO4中和碱性废水、_沉淀法_(含重金属离子的污水主要用沉淀法处理,如用Na2S除去Hg2+ :Hg2++S2-= HgS)。
14. “白色污染”指的是废塑料制品引起的污染,可回收后进行热裂解制得乙烯、丙烯等小分子。
15. 处理垃圾要遵循_无害化_、_减量化_、_资源化_原则。常用方法有:卫生填埋、堆肥、封闭焚烧。
16. 某垃圾箱上贴有如右图所示的标志的含义是:可回收垃圾。