- 5.65 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
湖南省 2021 年普通高等学校招生适应性
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试
卷上无效。
3.结束后,将本试卷卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56
Ag 108 Sb 122
一、选择题:本题共 10 小题,每小题 3 分,共 30 分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 化学与生活、环境和能源密切相关,下列过程没有涉及化学变化的是( )
A. 垃圾焚烧发电,废物利用 B. 风力发电,发展新能源
C. 环境消毒杀菌,阻断病毒传播 D. 稻草发酵肥田,发展绿色农业
2. 工业制乙醇的反应为 CH2=CH2+H2O Δ催化剂 CH3CH2OH,下列有关化学用语错误的是( )
A. 乙烯的电子式: B. 碳的原子结构示意图:
C. 水的结构式: D. 中子数为 8 的氧的核素: 16
8 O
3. 椒素是辣椒的辣味来源,其结构简式如下:
下列有关辣椒素的说法错误的是( )
A. 分子中含有 18 个碳原子 B. 分子中苯环上的一溴代物有 3 种
C. 能使溴水褪色 D. 分子中含有 3 种官能团
4. 已知 AN 为阿伏加德罗常数的值,下列说法正确的是( )
2
A. 常温常压下, 422.4L CH 含有电子数为 A10N
B. 36g CH COOH 分子中含有共价键数为 A0.8N
C. 2 3
-11L 0.1 L Namol CO 溶液中含 2-
3CO 数为 A0.1N
D. 密闭容器中 22mol SO 与 21mol O 反应,生成 3SO 的分子数为 A2N
5. 下列实验操作规范且能达到目的的是( )
A B C D
溶液的配制 氯气的净化 氨气的收集 沉淀的过滤
A. A B. B C. C D. D
6. X、Y、Z、R、W 为原子序数依次增大的短周期元素,Z、W 为同族元素,R 的原子半径是同周期主族元
素中最大的。其中,X、Y、Z、W 形成的化合物可表示为 + -
4 4YX XWZ 。下列说法正确的是( )
A. 原子半径: W>Z>Y
B. 简单氢化物的沸点: W>Z
C. Z 与 X、Y、R、W 均可形成多种化合物
D. Z、R、W 三种元素形成的化合物的水溶液呈中性
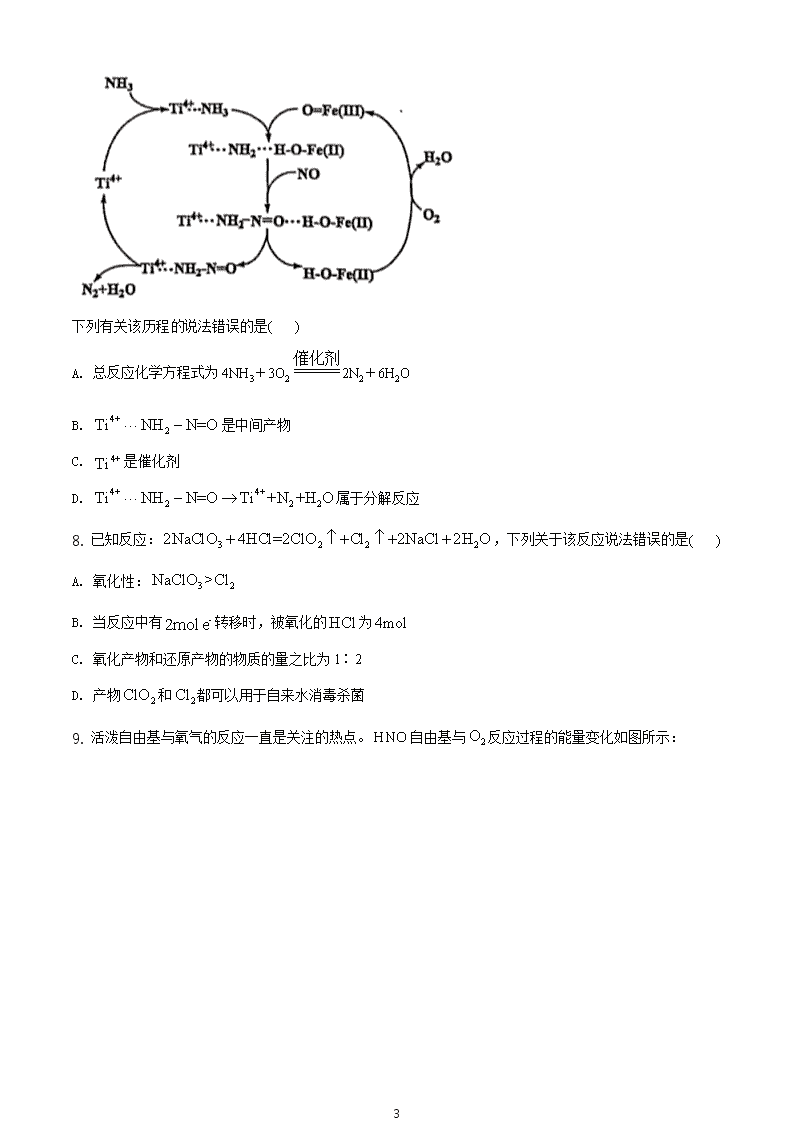
7. 据文献报道,某反应的反应历程如图所示:
3
下列有关该历程的说法错误的是( )
A. 总反应化学方程式为 4NH3+3O2
催化剂
2N2+6H2O
B. 4+
2Ti NH N=O 是中间产物
C. 4+Ti 是催化剂
D. 4+ 4+
2 2 2Ti NH N=O Ti +N +H O 属于分解反应
8. 已知反应: 3 2 2 22NaClO 4HCl=2ClO Cl 2NaCl 2H O ,下列关于该反应说法错误的是( )
A. 氧化性: 3 2NaClO >Cl
B. 当反应中有 -2mol e 转移时,被氧化的 HCl 为 4mol
C. 氧化产物和还原产物的物质的量之比为 1∶2
D. 产物 2ClO 和 2Cl 都可以用于自来水消毒杀菌
9. 活泼自由基与氧气的反应一直是关注的热点。 HNO 自由基与 2O 反应过程的能量变化如图所示:
4
下列说法正确的是( )
A. 该反应为吸热反应
B. 产物的稳定性: 1 2P >P
C. 该历程中最大正反应的活化能 1
正
-E =186.19kJ mol
D. 相同条件下,由中间产物 z 转化为产物的速率: 1 2v(P )HY
C
蔗糖溶液中加入少量稀硫酸,水浴加热5min ,加氢氧化钠溶液至溶液呈碱性,
再加入少量新制 2Cu(OH) ,继续加热5min ,生成砖红色沉淀
蔗糖完全水解
D
向等体积等浓度的稀硫酸中分别加入少量等物质的量的 ZnS 和 CuS 固体,
ZnS 溶解而 CuS 不溶解
sp spK (ZnS)>K (CuS)
A. A B. B C. C D. D
12. 某单液电池如图所示,其反应原理为 放电
2 充电H +2AgCl(s) 2Ag(s)+2HCl 。下列说法错误的是
( )
A. 放电时,左边电极为负极
B. 放电时,溶液中 +H 向右边电极移动
C. 充电时,右边电极上发生的电极反应式: Ag e Ag
D. 充电时,当左边电极生成 21mol H 时,电解质溶液减轻 2g
13. 以某冶金工业产生的废渣(含 2 3Cr O 、 2SiO 及少量的 2 3Al O )为原料,根据下列流程可制备 2 2 7K Cr O 。
下列说法正确的是( )
A. 煅烧时没有发生氧化还原反应
B. 滤渣Ⅱ中主要成分是 3Al(OH)
6
C. 可循环使用的物质是 2CO 和 2 3Na CO
D. 由 2 4Na CrO 转化为 2 2 7K Cr O 的过程中需加入 KOH
14. 常温下,向 20.00mL0.1000mol / L 的 3CH COOH 溶液中滴加 0.1000mol / L的 NaOH 溶液,溶液中,
-
3
3
c(CH COO )lg c(CH COOH)
随 pH 的变化关系如图所示(取1g5=0.7 )。
下列说法正确的是( )
A. 常温下, 3CH COOH 的电离常数为 -4.7610
B. 当溶液的 pH=7 时,消耗 NaOH 溶液 20.00mL
C. 溶液中水的电离程度大小:a>b>c
D. c 点溶液中: + - - +
3c(Na ) c(CH COO ) c(OH ) c(H )> > >
三、非选择题:包括必考题和选考题两部分。第 15~17 题为必考题,每个试卷考生都必须作
答。第 18、19 题为选考题,考生根据要求作答。
(一)必考题:此题包括 3 小题,共 39 分。
15. 蛋壳是一种很好的绿色钙源,其主要成分为 3CaCO 。以蛋壳为原料制备葡萄糖酸钙晶体
( -1
6 11 7 22M Ca C H O H O =448g mol ),并对其纯度进行测定,过程如下:
步骤Ⅰ.葡萄糖酸钙晶体的制备
步骤Ⅱ.产品纯度测定—— 4KMnO 间接滴定法
①称取步骤Ⅰ中制得的产品 0.600g 置于烧杯中,加入蒸馏水及适量稀盐酸溶解;
②加入足量 4 2 42NH C O 溶液,用氨水调节 pH 为 4~5,生成白色沉淀,过滤、洗涤;
7
③将②洗涤后所得的固体溶于稀硫酸溶液中,用 -1
40.020 00mol L KMnO 标准溶液滴定,消耗 4KMnO 标
准溶液 25.00mL 。
根据以上两个步骤,回答下列问题:
(1)以上两个步骤中不需要使用的仪器有______(填标号)。
A. B. C. D.
(2)步骤Ⅰ中“操作 a”是______、过滤、洗涤、干燥。
(3)步骤Ⅱ中用氨水调节 pH 为 4~5 的目的为______。
(4)用 4KMnO 标准溶液滴定待测液的反应原理为______(用离子方程式表示),判断滴定达到终点的现象为
______。
(5)根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为______(保留三位有效数字)。
16. 以镁铝复合氧化物( 2 3MgO Al O )为载体的负载型镍铜双金属催化剂( 2 3Ni Cu/MgO Al O )是一种
新型高效加氢或脱氢催化剂,其制备流程如下:
已知:常温下, 20
sp 2K Cu(OH) =2.21 10 , 33
sp 3K Al(OH) =1.30 10 。回答下列问题:
(1)在加热条件下,尿素 2 2CO NH 在水中发生水解反应,放出______和______两种气体(写化学式)。
(2)“晶化”过程中,需保持恒温 60℃,可采用的加热方式为______。
(3)“洗涤”过程中,检验滤饼是否洗净的方法是______。
(4)常温下,若“悬浊液”中
2+
9
3+
c Cu
=1.7 10
c Al
,则溶液的 pH= ______。
(5)“还原”过程中所发生反应的化学方程式为______。
8
(6) 4NiSO 在强碱溶液中被 NaClO 氧化可得 NiOOH ,该物质能用作碱性镍镉电池的正极材料。其电池反
应式: 放电
2 2 2充电Cd(s)+2NiOOH(s)+2H O(l) Cd(OH)(s)+2Ni(OH)(s)
①放电一段时间后,溶液的 pH 将______(填“增大”“减小”或“不变”)。
②充电时,阳极发生的电极反应式为______。
17. 氨基甲酸铵( 2 4H NCOONH )为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进
行探究。
已知:Ⅰ. 1
2 2 3 1N (g) 3H (g) 2NH (g) ΔH = 92.4kJ mol
Ⅱ. 1
2 2 2C(s) O (g) CO (g) ΔH = 393.8kJ mol
Ⅲ. 1
2 2 2 2 4 3N (g) 3H (g) C(s) O (g) H NCOONH (s) ΔH = 645.7kJ mol
回答下列问题:
(1)写出 2 4H NCOONH 分解生成 3NH 与 2CO 气体的热化学方程式:______。
(2)恒容条件下,实验测得数据如下表所示:
T/K 293 298 303 308 313
p/kPa
8.60 11.40 16.24 20.86 30.66
①恒温恒容时,下列能够说明该反应已达到化学平衡状态的是______(填标号)。
A.容器内总压强不再改变 B. 2逆正 32v NH =v CO
C. 2
3 2c NH c CO 的值不再改变 D. 3NH 的体积分数不再改变
②某温度下,该反应平衡时容器内总压强为 p,写出该反应的压强平衡常数的计算式 pK = ______(用平衡分
压代替平衡浓度,分压=总压×物质的量分数)。
③随着温度升高, pK 逐渐______(填“增大”、“减小”或“不变”),其主要原因是______。
④某温度下,达到平衠后,欲增加 3NH 的平衡浓度,可釆取的措施有______(填标号)。
A.加 2 4H NCOONH B.加催化剂 C.减小体积增大压强 D.移走 2CO
(3)已知: p
ΔHRlnK =- +CT (C 为常数)。根据上表实验数据得到图像,则该反应的反应热
ΔH= ______ -1kJ mol 。
9
(二)选考题:共 15 分。请考生从给出的两道题中任选一题作答。如果多做,则按所做的第一
题计分。
18. VA 族元素及其化合物在生产、生活中用途广泛。
(1)① 4 3P S 常用于制造火柴,P 和 S 的第一电离能较大的是______。
② 4 4As S 俗称雄黄,其中基态 As 原子的核外电子排布式为[Ar] ______,有______个未成对电子。
③P、S、 As 电负性由大到小的顺序是______。
(2) 3NH 、 3PH 、 3AsH 中沸点最高的是______,其主要原因是______。
(3)①白磷在氯气中燃烧可以得到 3PCl 和 5PCl ,其中气态 3PCl 分子的立体构型为______。
②研究发现固态 PCl5 和 PBr5 均为离子晶体,但其结构分别为 + -
4 6PCl PCl 和 + -
4PBr Br ,分析 PCl5 和
PBr5 结构存在差异的原因是______。
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为 anm、bnm、cnm, °α=β=γ=90 ,则:
①锑酸亚铁的化学式为______。
②晶体的密度为______ -3g cm (设 AN 为阿伏加德罗常数的值)。
19. 化合物 G 是一种抗骨质疏松药,俗称依普黄酮。以甲苯为原料合成该化合物的路线如下:
10
已知:RCOOH+ 一定条件 +H2O
回答下列问题:
(1)反应①的反应条件为______,反应②的反应类型是______。
(2)F 中含氧官能团的名称:______,______,______。
(3)D+H→E 的化学方程式:______。
(4)已知 N 为催化剂,E 和 M 反应生成 F 和另一种有机物 X,X 的结构简式为______。
(5)D 有多种同分异构体,同时满足下列条件的同分异构体有______种。
a.含苯环的单环化合物
b.核磁共振氢谱有四组峰,峰面积之比为 3∶2∶2∶1
(6)根据上述信息,设计由 和 为原料,制备 的合成路线
______(无机试剂任选)。
11
湖南省 2021 年普通高等学校招生适应性
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试
卷上无效。
3.结束后,将本试卷卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56
Ag 108 Sb 122
一、选择题:本题共 10 小题,每小题 3 分,共 30 分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 化学与生活、环境和能源密切相关,下列过程没有涉及化学变化的是( )
A. 垃圾焚烧发电,废物利用 B. 风力发电,发展新能源
C. 环境消毒杀菌,阻断病毒传播 D. 稻草发酵肥田,发展绿色农业
【答案】B
【解析】
【分析】
【详解】A.垃圾焚烧发电过程,生成新物质,涉及化学变化,故 A 不选;
B.风力发电,依靠风的动力将风能转化为电能,没有新物质生成,不涉及化学变化,故 B 选;
C.环境消毒杀菌,利用物质的强氧化性,使细菌蛋白质变性,有新物质生成,涉及化学变化,故 C 不选;
D.稻草发酵的过程,有新物质生成,涉及化学变化,故 D 不选;
故选:B。
2. 工业制乙醇的反应为 CH2=CH2+H2O Δ催化剂 CH3CH2OH,下列有关化学用语错误的是( )
A. 乙烯的电子式: B. 碳的原子结构示意图:
C. 水的结构式: D. 中子数为 8 的氧的核素: 16
8 O
【答案】A
12
【解析】
【分析】
【详解】A.乙烯是碳碳双键,其电子式: ,故 A 错误;
B.碳的原子序数为 6,其原子结构示意图: ,故 B 正确;
C.水是“V”形结构,其结构式: ,故 C 正确;
D.氧的质子数为 8,中子数为 8 的氧的核素,其质量数为 16,其核素符号为: 16
8 O ,故 D 正确。
综上所述,答案为 A。
3. 椒素是辣椒的辣味来源,其结构简式如下:
下列有关辣椒素的说法错误的是( )
A. 分子中含有 18 个碳原子 B. 分子中苯环上的一溴代物有 3 种
C. 能使溴水褪色 D. 分子中含有 3 种官能团
【答案】D
【解析】
【分析】
【详解】A.有结构简式可知,分子中含有 18 个碳原子,故 A 不选;
B.溴原子可以取代苯环上与酚羟基相邻,相间碳原子上的氢原子,则分子中苯环上的一溴代物有 3 种,故
B 不选;
C.该有机物中含有碳碳双键,能与溴单质发生加成反应,则能使溴水褪色,故 C 不选;
D.该有机物含有酚羟基、醚键、肽键和碳碳双键四种官能团 ,故 D 选;
故选:D。
4. 已知 AN 为阿伏加德罗常数的值,下列说法正确的是( )
A. 常温常压下, 422.4L CH 含有电子数为 A10N
B. 36g CH COOH 分子中含有共价键数为 A0.8N
13
C. 2 3
-11L 0.1 L Namol CO 溶液中含 2-
3CO 数为 A0.1N
D. 密闭容器中 22mol SO 与 21mol O 反应,生成 3SO 的分子数为 A2N
【答案】B
【解析】
【分析】
【详解】A.常温常压下,气体摩尔体积不为 22.4L/mol,22.4L 不为 1mol,故 A 错误;
B.一个醋酸分子含有 8 个共价键, 36g CH COOH 其物质的量是 6g
60g/mol =0.1mol,其分子中含有共价键
数为 A0.8N ,故 B 正确;
C. -1
2 31L 0.1mol L Na CO 溶液中,碳酸根离子水解,则含 2-
3CO 数小于 A0.1N ,故 C 错误;
D.密闭容器中 22mol SO 与 21mol O 反应是可逆反应,生成 3SO 的分子数小于 A2N ,故 D 错误;
故选:B。
5. 下列实验操作规范且能达到目的的是( )
A B C D
溶液的配制 氯气的净化 氨气的收集 沉淀的过滤
A. A B. B C. C D. D
【答案】C
【解析】
【分析】
【详解】A.配制一定物质的量浓度溶液转移溶液时需要玻璃棒引流 ,故 A 不选;
14
B. 除去氯气中的氯化氢和水杂质,先通入饱和食盐水,除去氯化氢,再通入浓硫酸,除去水,得到干燥
纯净的氯气,故 B 不选;
C.氨气的密度小于空气的密度,用向上排空气法收集气体,试管口塞一团棉花,防止氨气与空气对流 ,
故 C 选;
D.沉淀过滤时漏斗的下端要紧靠烧杯的内壁 ,故 D 不选;
故选:C。
6. X、Y、Z、R、W 为原子序数依次增大的短周期元素,Z、W 为同族元素,R 的原子半径是同周期主族元
素中最大的。其中,X、Y、Z、W 形成的化合物可表示为 + -
4 4YX XWZ 。下列说法正确的是( )
A. 原子半径: W>Z>Y
B. 简单氢化物的沸点: W>Z
C. Z 与 X、Y、R、W 均可形成多种化合物
D. Z、R、W 三种元素形成的化合物的水溶液呈中性
【答案】C
【解析】
【分析】
R 的原子半径是同周期主族元素中最大的,则 R 为第ⅠA 族元素,根据题意可知 R 元素之前至少还有 3 种
短周期元素,所以 R 为 Na 元素;Y 和 X 可以形成阳离子 YX +
4 ,可推测 X 为 H 元素,Y 为 N 元素,[XWZ4]-
为酸式盐的阴离子,Z、W 为同族元素,不难推出 Z 为 O 元素,W 为 S 元素;综上所述 X 为 H、Y 为 N、
Z 为 O、R 为 Na、W 为 S。
【详解】A.电子层数越多原子半径越大,电子层数相同核电荷数越小半径越大,所以原子半径 S>N>O,
即 W>Y>Z,故 A 错误;
B.W 和 Z 的简单氢化物分别为 H2S、H2O,水分子间存在氢键,所以沸点 H2SCl
B. 当反应中有 -2mol e 转移时,被氧化的 HCl 为 4mol
16
C. 氧化产物和还原产物的物质的量之比为 1∶2
D. 产物 2ClO 和 2Cl 都可以用于自来水消毒杀菌
【答案】B
【解析】
【分析】
在 3 2 2 22NaClO 4HCl=2ClO Cl 2NaCl 2H O 反应中,氯酸钠中氯元素的化合价降低被还原作氧
化剂,对应的 2ClO 是还原产物,氯化氢中氯元素的化合价升高被氧化作还原剂,对应的的 2Cl 是氧化产物,
据此回答问题。
【详解】A.有分析可知,氯酸钠是氧化剂,氯气是氧化产物,在同一个氧化还原反应中氧化剂的氧化性大
于氧化产物的氧化性,则氧化性: 3 2NaClO >Cl ,故 A 不选;
B.当反应中有 -2mol e 转移时,氯化氢中氯元素的化合价由-1 价升高到 0 价,则被氧化的 HCl 为 2mol ,
故 B 选;
C.有分析可知, 2Cl 是氧化产物, 2ClO 是还原产物,有方程式
3 2 2 22NaClO 4HCl=2ClO Cl 2NaCl 2H O 可知,氧化产物和还原产物的物质的量之比为 1∶2,
故 C 不选;
D.产物 2ClO 和 2Cl 都具有氧化性,可以用于自来水消毒杀菌,故 D 不选;
故选:B。
9. 活泼自由基与氧气的反应一直是关注的热点。 HNO 自由基与 2O 反应过程的能量变化如图所示:
17
下列说法正确的是( )
A. 该反应为吸热反应
B. 产物的稳定性: 1 2P >P
C. 该历程中最大正反应的活化能 1
正
-E =186.19kJ mol
D. 相同条件下,由中间产物 z 转化为产物的速率: 1 2v(P )HY
C
蔗糖溶液中加入少量稀硫酸,水浴加热5min ,加氢氧化钠溶液至溶液呈碱性,
再加入少量新制 2Cu(OH) ,继续加热5min ,生成砖红色沉淀
蔗糖完全水解
D
向等体积等浓度的稀硫酸中分别加入少量等物质的量的 ZnS 和 CuS 固体,
ZnS 溶解而 CuS 不溶解
sp spK (ZnS)>K (CuS)
A. A B. B C. C D. D
【答案】BD
19
【解析】
【分析】
【详解】A.二价铁离子和 KSCN 不反应,三价铁离子和 KSCN 溶液反应生成血红色络合物,二价铁离子
易被氯水氧化生成三价铁离子,Fe2+检验时要先加 KSCN 溶液后加氯水,防止 Fe3+干扰,故 A 错误;
B.相同物质的量浓度的钠盐溶液,溶液的 pH 越大,酸根离子的水解程度越大,相应的酸的酸性越弱;室
温下,测得相同浓度的 NaX 和 NaY 溶液的 pH 分别为 8 和 9 可知 HX 溶液的酸性强于 HY,故 B 正确;
C.蔗糖完全水解和部分水解,溶液中都含有葡萄糖,碱性条件下都能与新制氢氧化铜悬着液共热反应生成
氧化亚铜砖红色沉淀,故 C 错误;
D.相同条件下,组成和结构相似的难溶金属硫化物,溶解度大的物质先溶解于稀硫酸,向等体积等浓度的
稀硫酸中分别加入少量等物质的量的 ZnS 和 CuS 固体, ZnS 溶解而 CuS 不溶解,说明溶度积
sp spK (ZnS)>K (CuS) ,故 D 正确;
故选 BD。
12. 某单液电池如图所示,其反应原理为 放电
2 充电H +2AgCl(s) 2Ag(s)+2HCl 。下列说法错误的是
( )
A. 放电时,左边电极为负极
B. 放电时,溶液中 +H 向右边电极移动
C. 充电时,右边电极上发生的电极反应式: Ag e Ag
D. 充电时,当左边电极生成 21mol H 时,电解质溶液减轻 2g
【答案】CD
【解析】
【分析】
【详解】A.由图示分析可知,放电时左边电极发生氧化反应,为电池的负极,故 A 正确;
B.由 A 分析可知,放电时左边为电池的负极,右边则为电池的正极,工作时阳离子向正极移动,即氢离子
20
向右边电极移动,故 B 正确;
C.充电时左边电极为阴极,发生还原反应,即 22H 2e =H ;右边电极为阳极,发生氧化反应,即
Ag-e +Cl =AgCl ,故 C 错误;
D.由反应 22HCl 2Ag 2AgCl H
充电
可知,充电时,当左边电极生成 21mol H 时,电解质溶液中会
减少 2molHCl,则减少的质量为 73g,故 D 错误。
故选 CD。
13. 以某冶金工业产生的废渣(含 2 3Cr O 、 2SiO 及少量的 2 3Al O )为原料,根据下列流程可制备 2 2 7K Cr O 。
下列说法正确的是( )
A. 煅烧时没有发生氧化还原反应
B. 滤渣Ⅱ中主要成分是 3Al(OH)
C. 可循环使用的物质是 2CO 和 2 3Na CO
D. 由 2 4Na CrO 转化为 2 2 7K Cr O 的过程中需加入 KOH
【答案】 C
【解析】
【分析】
向废渣中加入碳酸钠和氧气并煅烧,发生如下反应,4Na2CO3+2Cr2O3+3O2
煅烧
4Na2CrO4+4CO2↑,
Na2CO3+SiO2
煅烧
Na2SiO3+CO2↑, Na2CO3+Al2O3
煅烧
2NaAlO2+CO2↑,用水浸之后,溶液中含有 Na2CrO4、
Na2SiO3、NaAlO2、Na2CO3,向溶液中通入二氧化碳,生成氢氧化铝沉淀和硅酸沉淀,过滤,滤液中含有
Na2CrO4、Na2CO3,再向溶液中加硫酸,2Na2CrO4+H2SO4= Na2Cr2O7+ Na2SO4+H2O,再向溶液中加入 KCl
固体,就会有 K2Cr2O7 晶体析出。
【 详 解 】 A . 向 废 渣 中 加 入 碳 酸 钠 和 氧 气 并 煅 烧 , 发 生 如 下 反 应 ,
21
4Na2CO3+2Cr2O3+3O2
煅烧
4Na2CrO4+4CO2↑,煅烧时有氧化还原反应,A 错误;
B. 用水浸之后,溶液中含有 Na2CrO4、Na2SiO3、NaAlO2、Na2CO3,向溶液中通入二氧化碳,会生成氢氧
化铝沉淀和硅酸沉淀,B 错误;
C.从上述流程图可知, 2CO 和 2 3Na CO 均可循环使用,C 正确;
D.由 2 4Na CrO 转化为 2 2 7K Cr O 的过程中需加入硫酸和 KCl 固体,反应如下:2Na2CrO4+H2SO4= Na2Cr2O7+
Na2SO4+H2O,再向溶液中加入 KCl 固体,就会有 K2Cr2O7 晶体析出,D 错误;
故选 C。
14. 常温下,向 20.00mL0.1000mol / L 的 3CH COOH 溶液中滴加 0.1000mol / L的 NaOH 溶液,溶液中,
-
3
3
c(CH COO )lg c(CH COOH)
随 pH 的变化关系如图所示(取1g5=0.7 )。
下列说法正确的是( )
A. 常温下, 3CH COOH 的电离常数为 -4.7610
B. 当溶液的 pH=7 时,消耗 NaOH 溶液 20.00mL
C. 溶液中水的电离程度大小:a>b>c
D. c 点溶液中: + - - +
3c(Na ) c(CH COO ) c(OH ) c(H )> > >
【答案】AD
【解析】
【分析】
3CH COOH 为 弱 电 解 质 , 在 溶 液 中 存 在 电 荷 平 衡 , - +
3 3CH COOH CH COO +H , 常 温 下 ,
22
3CH COOH 的 电 离 常 数 为 Ka=
- +
3
3
c(CH COO )c(H )
c(CH COOH)
, b 点 pH=4.76 时 ,
-
3
3
c(CH COO )lg c(CH COOH) =0 ,
c( 3CH COOH )=c( -
3CH COO ), 3CH COOH 的电离常数等于 c( +H )= -4.7610 ;向 20.00mL0.1000mol/L 的
3CH COOH 溶 液 中 滴 加 0.1000mol / L 的 NaOH 溶 液 , 由 于 温 度 不 变 , a 点 为 pH=2.88 时 ,
c(H+)=10-2.88mol/L ,
-
3
3
c(CH COO )lg c(CH COOH) =-1.88 ,
-
3
3
c(CH COO )
c(CH COOH) =10-1.88 ,
c(H+)×
-
3
3
c(CH COO )
c(CH COOH) =10-2.88×10-1.88=10-4.76=Ka,则 a 点为 3CH COOH ;Kh= w
a
K
K =
-14
-4.76
10
10
=10-9.24,c 点含有
3CH COONa , 3CH COONa 存 在 水 解 平 衡 , - -
3 2 3CH COO +H O CH COOH+OH ,
Kh=
-
3
-
3
c(CH COOH)c(OH )
c(CH COO )
, pH=8.73 时 , c(OH-)=
-14
-8.73
10
10
=10-5.27 ,
-
3
3
c(CH COO )lg c(CH COOH) =3.97 ,
3
-
3
c(CH COOH)
c(CH COO ) =10-3.97,Kh=
-
3
-
3
c(CH COOH)c(OH )
c(CH COO ) =10-3.97×10-5.27=10-9.24=Kh,c 点为 3CH COONa 溶液,则 b
点为 3CH COOH 和 3CH COONa 的混合溶液,由此分析。
【 详 解 】 A . 常 温 下 , 3CH COOH 的 电 离 常 数 为 Ka=
- +
3
3
c(CH COO )c(H )
c(CH COOH)
, b 点 pH=4.76 时 ,
-
3
3
c(CH COO )lg c(CH COOH) =0,c( 3CH COOH )=c( -
3CH COO ), 3CH COOH 的电离常数等于 c( +H )= -4.7610 ,故 A 符
合题意;
B.根据分析,c 点为 3CH COONa ,向 20.00mL0.1000mol/L 的 3CH COOH 溶液中滴加 0.1000mol / L的
NaOH 溶液 20mL,为弱酸强碱盐,水解显碱性,此时溶液的 pH 7> ,故 B 不符合题意;
C.酸碱抑制水的电离,弱酸强碱盐水解显碱性,促进水的电离,根据分析,a 点为 3CH COOH ,b 点为
3CH COOH 和 3CH COONa 的混合溶液,c 点为 3CH COONa 溶液,溶液中水的电离程度大小:c>b>a,故
C 不符合题意;
D.c 代表 3CH COONa 的溶液,由于醋酸根要水解, + -
3c(Na ) c(CH COO )> ,但水解较微弱,
- -
3c(CH COO ) c(OH )> ,根据电荷守恒, + + - -
3c(Na +c(H =c CH COO +c() ( ) OH) ) ,
+ - - +
3c(Na ) c(CH COO ) c(OH ) c(H )> > > ,故 D 符合题意;
23
答案选 AD。
【点睛】判断出各点代表的意义是解题的关键,需要熟悉电离平衡常数和水解平衡常数之间的关系。
三、非选择题:包括必考题和选考题两部分。第 15~17 题为必考题,每个试卷考生都必须作
答。第 18、19 题为选考题,考生根据要求作答。
(一)必考题:此题包括 3 小题,共 39 分。
15. 蛋壳是一种很好的绿色钙源,其主要成分为 3CaCO 。以蛋壳为原料制备葡萄糖酸钙晶体
( -1
6 11 7 22M Ca C H O H O =448g mol ),并对其纯度进行测定,过程如下:
步骤Ⅰ.葡萄糖酸钙晶体的制备
步骤Ⅱ.产品纯度测定—— 4KMnO 间接滴定法
①称取步骤Ⅰ中制得的产品 0.600g 置于烧杯中,加入蒸馏水及适量稀盐酸溶解;
②加入足量 4 2 42NH C O 溶液,用氨水调节 pH 为 4~5,生成白色沉淀,过滤、洗涤;
③将②洗涤后所得的固体溶于稀硫酸溶液中,用 -1
40.020 00mol L KMnO 标准溶液滴定,消耗 4KMnO 标
准溶液 25.00mL 。
根据以上两个步骤,回答下列问题:
(1)以上两个步骤中不需要使用的仪器有______(填标号)。
A. B. C. D.
(2)步骤Ⅰ中“操作 a”是______、过滤、洗涤、干燥。
(3)步骤Ⅱ中用氨水调节 pH 为 4~5 的目的为______。
(4)用 4KMnO 标准溶液滴定待测液的反应原理为______(用离子方程式表示),判断滴定达到终点的现象为
______。
24
(5)根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为______(保留三位有效数字)。
【答案】 (1). C (2). 蒸发浓缩、冷却结晶 (3). 中和溶液中的 H+离子,增大溶液中 C2O 2
4
浓度,
使 Ca2+离子完全沉淀 (4). 5H2C2O4+2MnO 4
+6H+=2Mn2++10CO2↑+8H2O (5). 滴入最后一滴高锰酸钾
标准溶液,溶液由无色变为浅紫色,且半分钟内不褪色 (6). 93.3%
【解析】
【分析】
蛋壳的主要成分是碳酸钙,洗涤、干燥后灼烧蛋壳,碳酸钙在高温下发生分解生成氧化钙和二氧化碳,加
水浸泡后氧化钙和水反应生成氢氧化钙,控制溶液 pH 在 6—7 的范围内,加入葡萄糖酸溶液,氢氧化钙与
葡萄糖酸溶液反应生成葡萄糖酸钙和水,过滤得到葡萄糖酸钙溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、
干燥得到葡萄糖酸钙晶体。
【详解】(1)过滤时要用到漏斗、灼烧时要用到坩埚、滴定时要用到酸式滴定管,则步骤Ⅰ和Ⅱ中不需要使
用的仪器是圆底烧瓶,故答案为:C;
(2)由分析可知,步骤Ⅰ中操作 a 是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却
结晶;
(3) 加入蒸馏水及适量稀盐酸溶解产品后所得溶液为酸性溶液,酸性溶液中加入饱和 (NH4)2C2O4, 2
2 4C O 会
与氢离子反应导致浓度降低而不能生成沉淀,则向溶液中滴加氨水调节 pH 为 4~5 的目的是中和溶液中的
氢离子,增大溶液中 2
2 4C O 浓度,有利于钙离子完全转化为草酸钙沉淀,故答案为:中和溶液中的 H+离子,
增大溶液中 C2O 2
4
浓度,使 Ca2+离子完全沉淀;
(4) 用高锰酸钾标准溶液滴定待测液的反应原理为酸性条件下,高锰酸钾溶液与草酸溶液发生氧化还原反应
生成硫酸钾、硫酸锰、二氧化碳和水,反应的离子方程式为 5H2C2O4+2MnO 4
+6H+=2Mn2++10CO2↑+8H2O;
当草酸与高锰酸钾溶液完全反应后,再滴入一滴高锰酸钾溶液,溶液会由无色变为浅紫色,且半分钟内不
褪色,故答案为:5H2C2O4+2MnO 4
+6H+=2Mn2++10CO2↑+8H2O;滴入最后一滴高锰酸钾标准溶液,溶液
由无色变为浅紫色,且半分钟内不褪色;
(5)由题意可得如下关系式:5Ca(C6H11O7)·H2O~5CaC2O4~5H2C2O4~2MnO 4
,则 5Ca(C6H11O7)·H2O 的
物质的量为 5
2
×0.02000mol/L×0.025L=1.250×10—3mol,产品中葡萄糖酸钙晶体的纯度为
31.250 10 448 /
0.600
mol g mol
g
×100%≈93.3%,故答案为:93.3%。
25
16. 以镁铝复合氧化物( 2 3MgO Al O )为载体的负载型镍铜双金属催化剂( 2 3Ni Cu/MgO Al O )是一种
新型高效加氢或脱氢催化剂,其制备流程如下:
已知:常温下, 20
sp 2K Cu(OH) =2.21 10 , 33
sp 3K Al(OH) =1.30 10 。回答下列问题:
(1)在加热条件下,尿素 2 2CO NH 在水中发生水解反应,放出______和______两种气体(写化学式)。
(2)“晶化”过程中,需保持恒温 60℃,可采用的加热方式为______。
(3)“洗涤”过程中,检验滤饼是否洗净的方法是______。
(4)常温下,若“悬浊液”中
2+
9
3+
c Cu
=1.7 10
c Al
,则溶液的 pH= ______。
(5)“还原”过程中所发生反应的化学方程式为______。
(6) 4NiSO 在强碱溶液中被 NaClO 氧化可得 NiOOH ,该物质能用作碱性镍镉电池的正极材料。其电池反
应式: 放电
2 2 2充电Cd(s)+2NiOOH(s)+2H O(l) Cd(OH)(s)+2Ni(OH)(s)
①放电一段时间后,溶液的 pH 将______(填“增大”“减小”或“不变”)。
②充电时,阳极发生的电极反应式为______。
【答案】 (1). NH3 (2). CO2 (3). 水浴加热 (4). 取最后一次洗涤液少量于试管,向试管中加
入稀盐酸,再加入氯化钡,若有白色沉淀则未洗净,若无沉淀则已洗净 (5). 10 (6). NiO+H2
550℃
Ni
+H2O,CuO+H2
550℃
Cu+H2O (7). 增大
(8). Ni(OH)2+OH--e-=NiOOH+H2O
【解析】
【分析】
将 MgSO4、Al2(SO4)3、NiSO4、CuSO4 混合溶液在 90℃下加入尿素发生反应生成悬浊液 Mg(OH)2、Al(OH)3、
Cu(OH)2、Ni(OH)2,在 60℃净化过滤,得到滤饼,洗涤、干燥,焙烧得到 MgO、CuO、NiO、Al2O3,在 550℃
温度下用氢气还原。
26
【详解】(1)根据题意,尿素[CO(NH2)2]在加热条件下与水发生水解反应即 CO(NH2)2+H2O
Δ
CO2↑+
2NH3↑,因此放出 NH3 和 CO2 两种气体;故答案为:NH3;CO2。
(2)“晶化”过程中,需保持恒温 60℃,温度在 100℃以下,因此采用的加热方式为水浴加热;故答案为:水
浴加热。
(3)“洗涤”过程中,检验滤饼是否洗净,主要检验洗涤液中是否还含有硫酸根,因此常用的方法是取最后一
次洗涤液少量于试管,向试管中加入稀盐酸,再加入氯化钡,若有白色沉淀则未洗净,若无沉淀则已洗净;
故答案为:取最后一次洗涤液少量于试管,向试管中加入稀盐酸,再加入氯化钡,若有白色沉淀则未洗净,
若无沉淀则已洗净。
(4)常温下,若“悬浊液”中
2+
9
3+
(Cu ) 1.7 10(Al )
c
c
,
2+ 2+ 3 20
sp 29 9
3+ 3+ 3 33
sp 3
[Cu(OH) ] (OH )(Cu ) (Cu ) (OH ) 2.21 10 (OH )1.7 10 1.7 10(Al ) (Al ) (OH ) [Al(OH) ] 1.30 10
K cc c c c
c c c K
,则
14(OH )=1 10 mol Lc ,
14
10w
4
1 11 10(H ) 1 10(OH ) 1.0 1 mol0 L mol LKc c
,则溶液的 pH= 10;
故答案为:10。
(5)“还原”过程最终得到 2 3Ni Cu/MgO Al O ,说明是 NiO、CuO 与氢气发生还原反应,因此所发生反应
的化学方程式为 NiO+H2
550℃
Ni+H2O,CuO+H2
550℃
Cu+H2O;故答案为:NiO+H2
550℃
Ni+H2O,
CuO+H2
550℃
Cu+H2O。
(6)①放电一段时间后,负极反应式为 Cd-2e-+2OH-=Cd(OH)2,正极是 2NiOOH+2e-+2H2O =2Ni(OH)2
+2OH-,正极生成的 OH-物质的量与负极消耗的 OH-物质的量相等,但是消耗了电解质中的水,使碱性增
强,因此溶液的 pH 将增大;故答案为:增大。
②根据放电时正极电极反应式 NiOOH+e-+H2O =Ni(OH)2+OH-,则充电时,阳极发生的电极反应式为
Ni(OH)2+OH--e-=NiOOH+H2O;故答案为:Ni(OH)2+OH--e-=NiOOH+H2O。
17. 氨基甲酸铵( 2 4H NCOONH )为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进
行探究。
已知:Ⅰ. 1
2 2 3 1N (g) 3H (g) 2NH (g) ΔH = 92.4kJ mol
27
Ⅱ. 1
2 2 2C(s) O (g) CO (g) ΔH = 393.8kJ mol
Ⅲ. 1
2 2 2 2 4 3N (g) 3H (g) C(s) O (g) H NCOONH (s) ΔH = 645.7kJ mol
回答下列问题:
(1)写出 2 4H NCOONH 分解生成 3NH 与 2CO 气体的热化学方程式:______。
(2)恒容条件下,实验测得数据如下表所示:
T/K 293 298 303 308 313
p/kPa
8.60 11.40 16.24 20.86 30.66
①恒温恒容时,下列能够说明该反应已达到化学平衡状态的是______(填标号)。
A.容器内总压强不再改变 B. 2逆正 32v NH =v CO
C. 2
3 2c NH c CO 的值不再改变 D. 3NH 的体积分数不再改变
②某温度下,该反应平衡时容器内总压强为 p,写出该反应的压强平衡常数的计算式 pK = ______(用平衡分
压代替平衡浓度,分压=总压×物质的量分数)。
③随着温度升高, pK 逐渐______(填“增大”、“减小”或“不变”),其主要原因是______。
④某温度下,达到平衠后,欲增加 3NH 的平衡浓度,可釆取的措施有______(填标号)。
A.加 2 4H NCOONH B.加催化剂 C.减小体积增大压强 D.移走 2CO
(3)已知: p
ΔHRlnK =- +CT (C 为常数)。根据上表实验数据得到图像,则该反应的反应热
ΔH= ______ -1kJ mol 。
28
【答 案】 (1). 2 4 3 2H NCOONH (s) 2NH (g)+CO (g) 159.5KJ/molH (2). A (3).
22 1( p) ( p)3 3 (4). 增大 (5). 该反应是吸热反应,升高温度,平衡正向移动,气体物质的量增大,压
强增大 (6). CD (7). 144.2 -1kJ mol
【解析】
【分析】
【详解】(1) 已知:Ⅰ. 1
2 2 3 1N (g) 3H (g) 2NH (g)ΔH = 92.4kJ mol
Ⅱ. 1
2 2 2C(s) O (g) CO (g)ΔH = 393.8kJ mol
Ⅲ. 1
2 2 2 2 4 3N (g) 3H (g) C(s) O (g) H NCOONH (s)ΔH = 645.7kJ mol ,有盖斯定律Ⅰ+Ⅱ-Ⅲ
得: 2 4 3 2H NCOONH (s) 2NH (g)+CO (g) 159.5KJ/molH ;
(2) ①A.容器内总压强不再改变 ,说明气体的体积不再发生变化,说明可逆反应处于平衡状态,故 A 正确;
B. 2逆正 32v NH =v CO ,不符合反应速率之比等于化学计量数之比,故 B 错误;
C. 2
3 2c NH c CO 是化学平衡常数,温度不变,平衡常数的值不变 ,不能说明处于平衡状态,故 C 错
误;
D.反应体系中只有氨气和二氧化碳是气体,物质的量之比等于化学计量数之比,则 3NH 的体积分数不再改
变,不能作为平衡状态判断的依据,故 D 错误;
故答案为:A。
②该反应的压强平衡常数的计算式 pK = 22 1( p) ( p)3 3
;
③随着温度升高, pK 逐渐增大,主要原因是该反应是吸热反应,升高温度,平衡正向移动,气体物质的量
增大,压强增大;
④A.加 2 4H NCOONH ,平衡不移动,氨气的浓度不变,故 A 错误;
B.加催化剂 ,平衡不移动,氨气的浓度不变,故 B 错误;
C.减小体积增大压强 ,氨气的浓度增大,故 C 正确;
D.移走 2CO ,平衡正向移动,氨气的浓度增大,故 D 正确;
故答案为:CD;
(3)图像上的点代入 p
ΔHRlnK =- +CT
得:69.50=
∆
H
×
3.19
×
310 +C 和 53.64=
∆
H
×
3.30
×
310 +C,联立求解
29
得,
∆
H=144.2 -1kJ mol 。
(二)选考题:共 15 分。请考生从给出的两道题中任选一题作答。如果多做,则按所做的第一
题计分。
18. VA 族元素及其化合物在生产、生活中用途广泛。
(1)① 4 3P S 常用于制造火柴,P 和 S 的第一电离能较大的是______。
② 4 4As S 俗称雄黄,其中基态 As 原子的核外电子排布式为[Ar] ______,有______个未成对电子。
③P、S、 As 电负性由大到小的顺序是______。
(2) 3NH 、 3PH 、 3AsH 中沸点最高的是______,其主要原因是______。
(3)①白磷在氯气中燃烧可以得到 3PCl 和 5PCl ,其中气态 3PCl 分子的立体构型为______。
②研究发现固态 PCl5 和 PBr5 均为离子晶体,但其结构分别为 + -
4 6PCl PCl 和 + -
4PBr Br ,分析 PCl5 和
PBr5 结构存在差异的原因是______。
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为 anm、bnm、cnm, °α=β=γ=90 ,则:
①锑酸亚铁的化学式为______。
②晶体的密度为______ -3g cm (设 AN 为阿伏加德罗常数的值)。
【答案】 (1). P (2). 3d104s24p3 (3). 3 (4). S>P>As (5). NH3 (6). NH3 分子间存在氢键
(7). 三角锥 (8). Br-半径较大,无法形成[PBr6]- (9). Fe(SbO3)2 (10). 2
A
110
792
Nabc
【解析】
【分析】
【详解】(1)①P 元素 3p 能级轨道半满,更稳定,第一电离能大于相邻元素,所以第一电离能较大的是 P;
②As 元素为为 33 号元素,第四周期第ⅤA 族,原子核外电子排布为[Ar]3d104s24p3;核外有 4p 轨道上 3 个
未成对电子;
30
③非金属性 S>P>As,所以电负性 S>P>As;
(2)PH3、AsH3 分子间只存在范德华力,而 NH3 分子间还存在氢键,所以 NH3 沸点最高;
(3)①PCl3 中心 P 原子价层电子对数为 5-3 13+ 2
=4,不含孤电子对,所以立体构型为三角锥形;
②Br-半径较大,而 Cl-半径较小,所以 P 周围可以容纳 6 个 Cl-,而无法容纳 6 个 Br-,无法形成[PBr6]-;
(4)①据图可知一个晶胞中含有 Sb 原子的个数为 18 4
+2=4,O 原子的个数为 14 2
+10=12 个,Fe2+的个数
为 18 8
+1=2,所以锑酸亚铁的化学式为 Fe(SbO3)2;
②晶胞的质量为
A
122 4+16 12+56 2 gN
=
A
792
N g,晶体的体积为 abc nm3=abc10-21cm3,所以晶体的密度为
21 3
A
10 c
79 g
m
2
abc
N
= 2
A
110
792
Nabc g·cm3。
19. 化合物 G 是一种抗骨质疏松药,俗称依普黄酮。以甲苯为原料合成该化合物的路线如下:
已知:RCOOH+ 一定条件 +H2O
回答下列问题:
(1)反应①的反应条件为______,反应②的反应类型是______。
(2)F 中含氧官能团的名称:______,______,______。
(3)D+H→E 的化学方程式:______。
(4)已知 N 为催化剂,E 和 M 反应生成 F 和另一种有机物 X,X 的结构简式为______。
(5)D 有多种同分异构体,同时满足下列条件的同分异构体有______种。
a.含苯环的单环化合物
b.核磁共振氢谱有四组峰,峰面积之比为 3∶2∶2∶1
31
(6)根据上述信息,设计由 和 为原料,制备 的合成路线
______(无机试剂任选)。
【答案】 (1). 光照 (2). 取代反应 (3). 羰基 (4). (酚)羟基 (5). 醚键 (6).
+H2O (7). 乙 醇
( 2 5C H OH 或 3 2CH CH OH ) (8). 4 (9).
【解析】
【分析】
由图示可知,A 与 2Cl 在光照条件下发生取代反应生成 B ; 与
NaCN 在一定条件下发生取代反应生成 C ; 在酸性条件下水解生成
D ; 与 在 一 定 条 件 下 反 应 生 成
E ; 与 2 5 3HC OC H 在 作 催 化 剂 反 应 生 成
F 和 2 5C H OH ; 与 在碱性条件下反
应生成 G ,结合有机化合物的相关知识分析分析可得;
32
【详解】(1)由分析可得反应①A 与 2Cl 在光照条件下发生取代反应生成 ;
与 NaCN 在一定条件下发生取代反应生成 ,故答案为:光照;取代反应;
(2)F 中所含官能团的名称为:羰基、醚键、(酚)羟基以及碳碳双键,其中含氧官能团为:羰基、醚键、(酚)
羟基,故答案为:羰基;醚键;(酚)羟基(顺序可颠倒);
(3)由分析可知 D 为 ,H 为 E 为 ,则 D+H→E
的化学方程式为: +H2O,
故答案为: +H2O;
(4)已知 N 为催化剂, 与 2 5 3HC OC H 在 作催化剂反应生成
和 2 5C H OH ,则 X 为 2 5C H OH 或 3 2CH CH OH ,故答案为:乙醇( 2 5C H OH
或 3 2CH CH OH );
(5)D 分子式 8 8 2C H O 有多种同分异构体,同时满足
a.含苯环的单环化合物
b.核磁共振氢谱有四组峰,峰面积之比为 3∶2∶2∶1,则有 ,
,共 4 中,故答案为:
33
4;
(6) 2Cl 在光照条件下发生取代反应生成 ; 与 NaCN 反应生成 ;
在酸性条件下水解生成 ; 与 反应生成目标物
,则其合成流线为:
故答案为: