- 312.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
新课标1试题
7.下列化合物中同分异构体数目最少的是
A.戊烷 B. 戊醇 C.戊烯 D.乙酸乙酯
8.化学与社会、生活密切相关.对下些列现象或事实的解释正确的是
选项
现象或事实
解释
A.
用热的烧碱溶液洗去油污
Na2CO3可直接与油污反应
B.
漂白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C.
施肥时,草木灰(有效成分为K2CO3)不能与
NH4 Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
D.
FeCl3溶液可用于铜质印刷线路版制作
FeCl3能从含Cu2+的溶液中置换出铜
9.已知分解1molH2O2放出热量98 kJ.在含少量I-的溶液中,H2O2分解的机理为:
H2O2 + I- H2O+ IO- 慢
H2O2+ IO- H2O+O2+ I- 快
下列有关该反应的说法正确的是
A. 反应速率与I-浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
10. X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是()
A原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
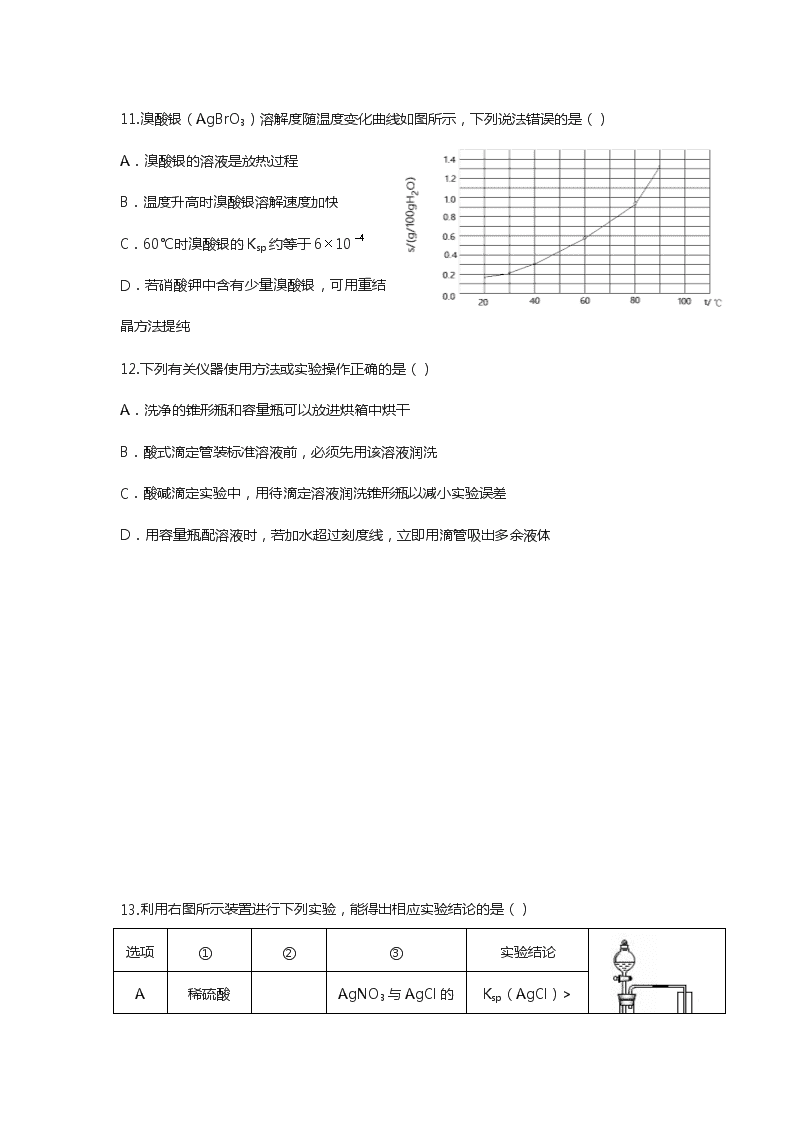
11.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是()
A.溴酸银的溶液是放热过程
B.温度升高时溴酸银溶解速度加快
C.60℃时溴酸银的Ksp约等于610
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
12.下列有关仪器使用方法或实验操作正确的是()
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
13.利用右图所示装置进行下列实验,能得出相应实验结论的是()
选项
①
②
③
实验结论
A
稀硫酸
AgNO3
Ksp(AgCl)>
Na2S
与AgCl的浊溶液
Ksp(Ag2S)
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2 与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
26.(13分)
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、
装置示意图和有关数据如下:
相对分子质量
密度/(g·cm-3)
沸点/C
水中溶解性
异戊醇
88
0.8123
131
微溶
乙酸
60
1.0492
118
溶
乙酸异戊酯
130
0.8670
142
难溶
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1) 仪器B的名称是
(2) 在洗涤操作中,第一次水洗的主要目的是 ,第二次水洗的主要目的是 .
在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号).
a直接将乙酸异戊酯从分液漏斗的上口倒出
b直接将乙酸异戊酯从分液漏斗的下口放出
c先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
⑷本实验中加入过量乙酸的目的是 .
⑸实验中加入少量无水MgSO4的目的是 .
⑹在蒸馏操作中,仪器选择及安装都正确的是 (填标号).
⑺本实验的产率是 .
a、30℅ b、40℅ c、 60℅ d、90℅
⑻在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏 (填“高”或“低”),其原因是
27、(15分)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一种中元强酸,写出其电离方程式:
⑵H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为 (填化学式).
② NaH2PO2为 (填“正盐”或“酸式盐”),其溶液显 性(填“弱酸性”、“中性”、或“弱碱性”).
⑵ H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式 .
⑷H3PO2也可以通过电解的方法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
① 写出阳极的电极反应式 .
② 分析产品室可得到H3PO2的原因 .
③ 早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有_______杂质,该杂质产生的原因是:
28.(15分)
乙醇是重要的有机化工原料,可由乙烯气相直接水合成法或间接水合法生产.回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇.写出相应反应的化学方程式________________.
(2)已知:
甲醇脱水反应 2CH3OH(g) = CH3OCH3(g) + H2O(g) △H1=-23.9 kJ·mol-1
甲醇制烯烃反应 2CH3OH(g) = C2H4(g) + 2H2O(g) △H2=-29.1 kJ·mol-1
乙醇异构化反应 C2H5OH(g) = CH3OCH3(g) △H3=-93.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g) + H2O(g)= C2H5OH(g)的△H=______ kJ·mol-1.与间接水合法相比,气相直接水合法的优点是__________.
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中nH2O:nC2H4=1:1).
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②图中压强(p1、p2、p3、p4)的大小顺序为______,理由是______.
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃、压强6.9MPa,nH2O:nC2H4=0.6:1.乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有______、______.
36.【化学------选修2:化学与技术】(15分)
磷矿石主要以磷酸钙[Ca3(PO4)2·H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在.图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸.图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程.
部分物质的相关性质如下:
熔点/℃
沸点/℃
备注
白磷
44
280.5
PH3
-133.8
-87.5
难溶于水,有还原性
SiF4
-90
-86
易水解
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的______%.
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为___________.
现有1t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸______t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2,过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是______(填化学式).冷凝塔1的主要沉积物是______,冷凝塔2的主要沉积物是______.
(4)尾气中主要含有______,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去______;再通入次氯酸钠溶液,可除去______.(均填化学式)
(5)相比于湿法磷酸、热法磷酸工艺复杂,能耗高,但优点是______.
37.【化学------选修3:物质结构与性质】(15分)
早期发现的一种天然准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过______方法区分晶体、准晶体和非晶体.
(2)基态Fe原子有______个未成对电子,Fe3+的电子排布式为______,可用硫氰化钾检验Fe3+,形成的配合物的颜色为______.
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O,乙醛中碳原子的杂化轨道类型为______,1mol乙醛分子中含有的σ键的数目为______.乙酸的沸点明显高于乙醛,其主要原因是______.Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子.
(4)Al单质为面心立方晶体,其晶胞参数α=0.405nm,晶胞中铝原子的配位数为______.列式表示Al单质的密度______g·cm-1(不必计算出结果).
38.【化学—选修5:有机化学基础】(15分)
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用.合成G的一种路线如下:
已知以下信息:
①
② 1molB经上述反应可生成2molC,且C不能发生银镜反应
③ D属于单取代芳烃,其相对分子质量为106
④ 核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤
回答下列问题:
(1)由A生成B的化学方程式为 ,反应类型是 .
(2)D的化学名称是 ,由D生成E的化学方程式为 .
(3)G的结构简式是 .
(4)F的同分异构体中含有苯环的还有 种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:2:1的是 (写出其中一种的结构简式).
(5)由苯及化合物C经如下步骤可合成N-异丙基苯胺:
反应条件1所选用的试剂为 ,反应条件2所选用的试剂为 ,I的结构简式为 .
新课标1答案解析
7【答案】A
【解析】A.选项戊烷有正异新三种同分异构体
B.选项戊醇可形成醇和醚两种类别同分异构体,数量远多于3种
C.选项戊烯存在环戊烷和顺反异构,多于3种
D.选项存在酸、酯、醇醛等多种类别,多于3种
8【答案】C
【解析】A. 烧碱为NaOH.纯碱为Na2CO3.前后不符.热的纯碱Na2CO3溶液可去油污,Na2CO3水解溶液为碱性,越热越水解,碱性增强,促进油脂水解,可去油污.
B.选项漂白粉变质是其有效成分Ca(ClO)2与空气中的CO2反应生成CaCO3和HClO,CaCl2与空气中的CO2不会反应.
C.选项草木灰K2CO3与NH4Cl双水解,生成氨气,氮元素损失,会降低肥效.
D.选项制作印刷线路板的原理是2FeCl3+Cu=CuCl2+FeCl2.氯化铁和铜离子并不会反应.
9【答案】A
【解析】此反应为双氧水的分解反应.2H2O2 = 2H2O+O2 I-为催化剂.
A.选项总反应速率应由最慢的反应决定,所以反应一决定反应速率,改变反应物I-可以改变反应速率.
B.选项由IO3-应为反应二的氧化剂.
C.选项活化能与反应的焓变无关.
D.由总反应可知,速率之比为计量数之比为2:2:1
10【答案】D
【解析】由题意知,X、Y、Z表中位置如下图
Z
Y
X
可知X为S,Y为Na,Z为F.
A. 最外层电子数是Z>X>Y
B. Na为金属晶体,S为分子晶体,所以沸点Na>S
C. 离子半径,层多半径大,层同序数大半径小,顺序为X>Z>Y
D. 原子序数为X>Y>Z
11【答案】A
【解析】 由题给条件无法判断溴酸银的溶解过程是吸热还是放热,所以A错误;由图像可知B正确.C选项,60℃时,100g水中溶解了约0.6g溴酸银,则1000g水即1升水中约溶解6g,c=6g÷236g/mol=0.025mol/L,所以Ksp=c(Ag+)×c(BrO3--)约为6×10-4所以C正确;
D选项,重结晶要求杂质在所选溶剂中溶解度很小或很大,易于除去;被提纯物质在热溶液中的溶解度较大,冷溶液中的溶解度较小,冷却后易于结晶析出.由图可知20℃时,100g水中溶解不到0.2g溴酸银,溶解度很小,所以可以用重结晶的方法可以提纯
12【答案】B
【解析】A.选项,容量瓶不能加热,也不能烘干,否则会引起微小形变,造成实验误差
B.选项,滴定管用蒸馏水洗净之后要用所盛装溶液润洗2--3次
C.选项,滴定时锥形瓶不能润洗,否则使得所取物质的量增大.
D.选项,加水超过刻线时,要重新配制
13【答案】B
【解析】A.选项,③中有AgNO3,H2S与AgNO3反应能生成硫化银黑色沉淀,无法证明是硫化银是氯化银转化而来的.
B.选项,硫酸滴到蔗糖中,变黑证明有脱水性.碳与浓硫酸反应生成二氧化硫使溴水褪色,证明浓硫酸具有强氧化性.
C.选项,①和②生成的二氧化硫(以及挥发的盐酸)进入③中,二氧化硫水溶液显酸性,二氧化硫在酸性的硝酸钡中被氧化生成硫酸钡沉淀.但是二氧化硫和可溶性钡盐不会反应生成亚硫酸钡.
D.选项,硝酸有挥发性会干扰后面碳酸与硅酸酸性的比较.
26题
【答案】(1)球形冷凝管
(2)洗掉大部分乙酸和浓硫酸、除去有机产物表面的易溶钠盐(3)d(4)提高异戊醇的转化率(5)干燥产物(6)b(7)C(8)高、会收集少量未反应的异戊醇
【解析】(1)而球形冷凝管一般用于反应装置,使蒸出的反应物冷凝回流,使反应更彻底!
(1) (2)制得的乙酸异戊酯中混有乙酸、异戊醇和浓硫酸,异戊醇微溶于水,所以第一次水洗除去大部分易溶于水的乙酸和硫酸.用饱和碳酸氢钠除去残留的酸.再次水洗是除去有机物表面的易溶钠盐.
(3)分液时下口将下层液体放出,并及时关闭活塞,上层液体从上口倒出.
(4)反应是可逆反应,增大乙酸的浓度,平衡右移,增大异戊醇的转化率
(5)硫酸镁作为干燥剂吸水
(6)在蒸馏操作时,冷凝时只能用直型冷凝管,而且温度计的水银球应位于蒸馏烧瓶支管口略低处.冷凝水应从下口入水,上口出水;为防止液体暴沸,在混合液中需加入少许碎瓷片.
(7)乙酸是过量的,计算时按少量的异戊醇的量进行计算.
C5H12O -----------C7H14O2
88 130
4.4 6.5
所以产率为3.9/6.5=60%.
(8)由于异戊醇微溶于水,所以进行蒸馏纯化的混合物为乙酸异戊酯和异戊醇的混合物,由于异戊醇的沸点为131℃,所以如果从130℃开始收集馏分,异戊醇开始蒸出,使得蒸馏所得的产物质量变大,产率变高
27题
【答案】(1)H3PO2H++ H2PO2-
(2)①+1②H3PO4③正盐 、弱碱性
(3)(4)①4OH--4e-=2H2O+O2↑②阳极室的H+通过阳膜进入产品室,原料室中的H2PO2-通过阴膜进入产品室,二者结合生成了H3PO2③PO43- 、H3PO2或 H2PO2-被氧化
【解析】次磷酸是无色油状液体或易潮解的结晶. 易溶于热水、乙醇、乙醚.溶于冷水.加热到130℃时则分解成正磷酸和磷化氢(剧毒).是强还原剂. (1)中强酸也是弱酸,所以电离是可逆的
(2)根据正负化合价代数和为零的原则,得到P的化合价为 +1;②H3PO2为还原剂,银离子为氧化剂,物质的量之比为1:4,据得失电子总数相等可知1mol H3PO2失4mol 电子,所以P的化合价有+1升高为+5价,即H3PO4 ;③由于次磷酸为一元弱酸,所以NaH2PO2为正盐 ,而且还是强碱弱酸盐因此显弱碱性
(3)
所以PH3与Ba(H2PO3)物质的量之比为2:3,进而配平反应方程式.(4)阳离子交换膜只允许阳离子通过,不允许气体和阴离子通过;阴离子交换膜只允许阴离子通过,不允许气体和阳离子通过;阳离子向阴极移动,阴离子向阳极移动.所以在产品室反应得到了H3PO2,而且在阳极是阴离子失电子,所以阳极的电极反应为氢氧根失电子;而且阳极室生成的氧气与产品室生成的次磷酸并不接触,保护了次磷酸..将“四室电渗析法”中阳极室的稀硫酸用H3PO3稀溶液代替,并撤去阳极室与产品室之间的阳离子交换膜,从而合并了阳极室与产品室,这样原料室中的H2PO2-通过阴膜进入阳极室,而且阳极电极反应为4OH--4e-=2H2O+O2↑剩余的H+和进入的H2PO2-反应就生成了H3PO2.但是H3PO2和H2PO2-具有还原性与阳极产生的氧气同在阳极室中,于是就发生了氧化还原反应,就生成了PO43-
28【答案】(1)C2H4+H2SO4C2H5OSO3H
C2H5OSO3H+H2OC2H5OH+H2SO4
(2) -45.5KJ/mol 原子利用率高,腐蚀性小等
(3)① 0.07(MPa)-1 ②P4>P3>P2>P1 增大压强,平衡向减小压强方向移动,右移C2H4转化率增大
(4)及时将产物乙醇液化分离出来 提高n(H2O)/ n(C2H4)比
【解析】(1)略
(2)间接水化法用浓硫酸对设备腐蚀较大,直接水化法腐蚀性小,由方程式可知,间接水化法无其他副产物产生,理论原子利用率100%
(3) C2H4 + H2O C2H5OH
起始 mol 1 1 0
转化mol x x x
平衡mol 1 -x 1-x x
乙烯平衡转化率为20%所以x=0.2
平衡时,n(C2H4):n(H2O):n(C2H5OH) =0.8:0.8:0.2
Kp=*7.85MPa =0.07(MPa)-1
(4)提高C2H4转化率就要使平衡正向移动,可及时分离出产物,或增大另一反应物H2O(g)的浓度
36【化学------选修2:化学与技术】
(1)【答案】69.28
【解析】磷矿石生成磷肥包含直接生成的4%的磷矿粉肥和湿法磷酸生产的磷肥
湿法磷酸产生的磷肥:96%×85%×80%=65.28%
∴整个磷肥料占磷矿石使用量4%+65.28%=69.28%
(2) 【答案】Ca5F(PO4)3+5H2SO4=5CaSO4+3H3PO4+HF 0.49
【解析】设商品磷酸质量为x,所以生成纯净磷酸85%x
P2O5~~~~~~~~~~~~~H3PO4
142 196
1t×30% 85%x
∴x=0.49
(2) 【答案】CaSiO3 SiO2 P4(白磷)
【解析】碳还原磷矿石的氧化产物是CO,高温下SiO2形成SiO32-与Ca2+结合形成CaSiO3,即为炉渣.冷凝塔1中温度为70℃,SiF4水解成SiO2和HF,SiO2形成沉淀,冷凝塔2中温度为18℃,低于白磷熔点,白磷沉积出来.
(4)【答案】CO HF、H2S PH3
【解析】碳还原磷矿石的氧化产物是CO,氢氟酸酸性强于碳酸:
Na2CO3+2HF=2NaF+H2O+CO2↑
由于硫化氢的一步电离小于碳酸的一步电离大于碳酸的二步电离,因此碳酸钠溶液与H2S反应:
Na2CO3+H2S=NaHCO3+NaHS
因此碳酸钠溶液可以吸收HF和H2S;PH3具有还原性,可以用强氧化性的NaClO溶液除去:
PH3+4ClO-+3OH-=PO43-+4Cl-+3H2O
(5) 【答案】得到的磷酸纯度较高.
【解析】由于湿法磷酸中用过量硫酸分解,制得的磷酸中会含有硫酸等可溶性杂质,而热法磷酸中生成的白磷纯净,再经过氧化水解制得较为纯净的磷酸.
37【化学------选修3:物质结构与性质】
(1) 【答案】X光衍射分析.
(2) 【答案】4 1s22s22p63s23p63d5(或[Ar]3d5) 血红色
【解析】基态Fe的电子排布为[Ar]3d64s2,因此3d轨道上还有四个未成对电子.当失去三个电子后,达到3d层电子半充满稳定结构.Fe3+可以与KSCN形成血红色络合物,用此来检验三价铁离子.
(3)【答案】sp3和sp2杂化 6 分子间氢键 16
【解析】乙醛中甲基上的C成四个单键,因此是sp3杂化,醛基上的碳形成了一个碳氧双键,形成了一个π键,共用电子对数为3,因此是sp2杂化.一共有5个单键和一个双键,因此是6个σ键和一个π键.乙酸间可以形成分子间氢键,导致沸点升高.氧化亚铜立方晶胞内O原子个数:4+8×1/8+6×1/2=8,所以铜原子个数为8×2=16.
(4)【答案】12
【解析】面心立方晶体配位数为12,一个晶胞中有四个铝原子.
38【化学—选修5:有机化学基础】
【答案】(1),
消去反应
(2)乙苯,
(3)
(4)19 或或
(5)浓硝酸、浓硫酸 铁粉/稀盐酸
【解析】1molB经上述反应可生成2molC,且C不能发生银镜反应,根据题目已知①可推知C为丙酮,因此推出B的结构式为;根据A生成B的条件可推知是卤代烃的消去反应,因此A为;D属于单取代芳烃,根据相对分子质量和碳原子数可推知是乙基苯,D生成E则为硝化反应,根据F中苯环上的等效H为两种可推知为对位取代.因此E的结构式为,根据F中分子式可推知将 -NO2还原为 -NH2,再根据已知⑤推出化合物G.
19种的详解:、;、、、、、;、、、、;、、;、、.