- 4.09 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考仿真模拟11
第Ⅰ卷 选择题
一、选择题(本题包括7小题)
7.(2011江西上饶二模,7)下列有关说法中正确的是( )
A.32S和34S的化学性质相同 B.37Cl原子核内中子数为17
C.12CO2和14CO2互为同分异构体 D.Ca和Ca2+是同种元素,且性质相同
8..(2011山东潍坊二模,10)下列各组离子在指定溶液中一定能大量共存的是( )
A.在能使石蕊试纸变蓝色的溶液中:Na+、[Al(OH)4]-、S2-、SO42-
B.由水电离出的c(H+) = 10-12 mol · L-1的溶液中:Cl-、CO32-、NH4+、SO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3-
D.pH = 2的溶液中:Na+、SO42-、ClO-、SO32-
9.下列实验操作正确的是( )
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基
③实验室制硝基苯要在水浴的热水中插入温度计
④可用FeCl3溶液除去试管内难以刷去的铜迹
⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
A.①④ B.②④⑤ C.①③ D.③④⑥⑦
10.(2011新课标模拟2,10)下列化学原理表述正确的是( )
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大
B.Na2CO3溶液中满足:c(Na+)=2c(CO32-)+2 c(HCO3-)+ 2c(H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-+H2OCO32-+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多
11.(2011宁夏银川一中二模,11)关于下列四个图像的说法中正确的是( )
A.图①表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0
B.图②是在以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
D.图④中曲线表示反应2SO2(g) + O2(g) 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
12.(2011哈尔滨九中二模,12)某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的只有Na+ ②有胶状物质生成 ③有气体产生
④溶液颜色发生变化 ⑤共发生了2个氧化还原反应
A.①②③④⑤ B.①②③④ C.①③⑤ D.②④⑤
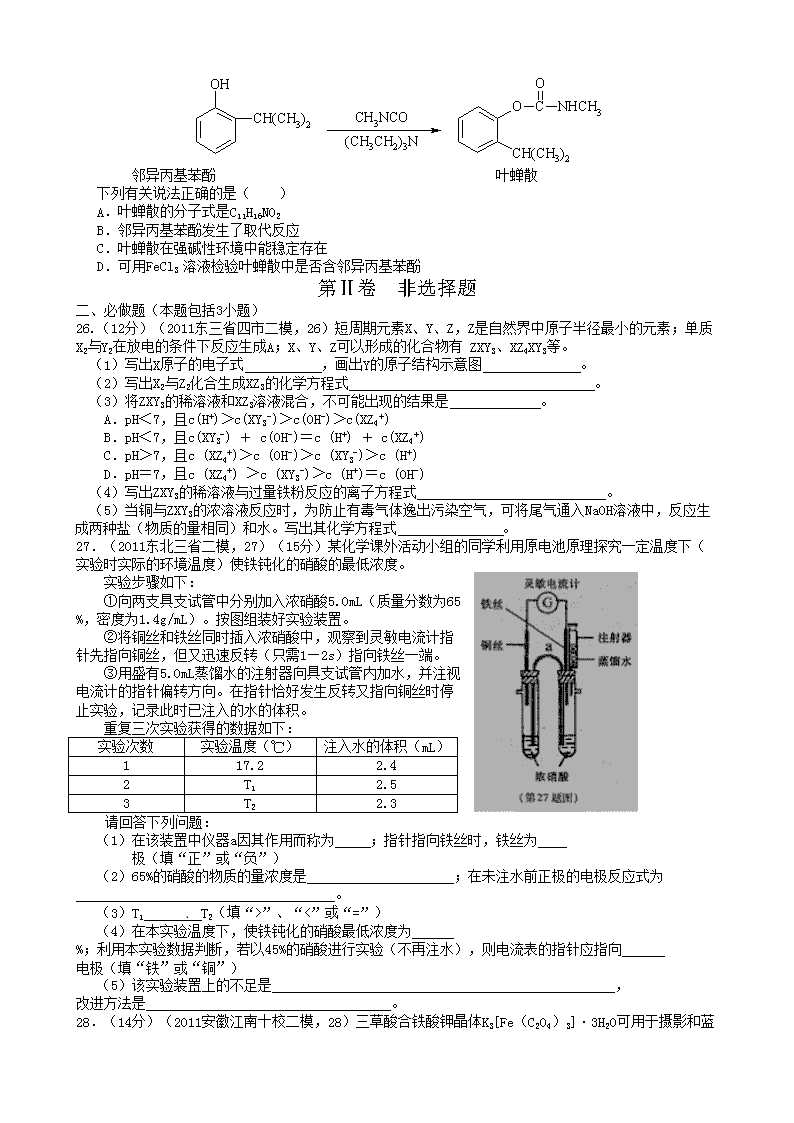
13.(2011甘肃兰州一中三模,13)叶蝉散(isoprocard)对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长。工业上用邻异丙基苯酚合成叶蝉散的过程如下:
邻异丙基苯酚 叶蝉散
下列有关说法正确的是( )
A.叶蝉散的分子式是C11H16NO2
B.邻异丙基苯酚发生了取代反应
C.叶蝉散在强碱性环境中能稳定存在
D.可用FeCl3 溶液检验叶蝉散中是否含邻异丙基苯酚
第Ⅱ卷 非选择题
二、必做题(本题包括3小题)
26.(12分)(2011东三省四市二模,26)短周期元素X、Y、Z,Z是自然界中原子半径最小的元素;单质X2与Y2在放电的条件下反应生成A;X、Y、Z可以形成的化合物有 ZXY3、XZ4XY3等。
(1)写出X原子的电子式 ,画出Y的原子结构示意图 。
(2)写出X2与Z2化合生成XZ3的化学方程式 。
(3)将ZXY3的稀溶液和XZ3溶液混合,不可能出现的结果是 。
A.pH<7,且c(H+)>c(XY3-)>c(OH-)>c(XZ4+)
B.pH<7,且c(XY3-) + c(OH-)=c (H+) + c(XZ4+)
C.pH>7,且c (XZ4+)>c (OH-)>c (XY3-)>c (H+)
D.pH=7,且c (XZ4+) >c (XY3-)>c (H+)=c (OH-)
(4) 写出ZXY3的稀溶液与过量铁粉反应的离子方程式 。
(5) 当铜与ZXY3的浓溶液反应时,为防止有毒气体逸出污染空气,可将尾气通入NaOH溶液中,反应生成两种盐(物质的量相同)和水。写出其化学方程式 。
27.(2011东北三省二模,27)(15分)某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度。
实验步骤如下:
①向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g/mL)。按图组装好实验装置。
②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1—2s)指向铁丝一端。
③用盛有5.0mL蒸馏水的注射器向具支试管内加水,并注视电流计的指针偏转方向。在指针恰好发生反转又指向铜丝时停止实验,记录此时已注入的水的体积。
重复三次实验获得的数据如下:
实验次数
实验温度(℃)
注入水的体积(mL)
1
17.2
2.4
2
T1
2.5
3
T2
2.3
请回答下列问题:
(1)在该装置中仪器a因其作用而称为 ;指针指向铁丝时,铁丝为 极(填“正”或“负”)
(2)65%的硝酸的物质的量浓度是 ;在未注水前正极的电极反应式为
。
(3)T1 T2(填“>”、“<”或“=”)
(4)在本实验温度下,使铁钝化的硝酸最低浓度为 %;利用本实验数据判断,若以45%的硝酸进行实验(不再注水),则电流表的指针应指向 电极(填“铁”或“铜”)
(5)该实验装置上的不足是 ,
改进方法是 。
28.(14分)(2011安徽江南十校二模,28)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2
O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。实验装置图如下:
限选试剂:
浓H 2SO4、、1.0mo1·L-1H2 SO4、1.0mo1·L-1HNO3、1.0mo1·L-1NaOH、3%H2O2、1.0mol·L-1CuSO4
、20%KSCN、饱和澄清石灰水、蒸馏水、0.1%酸性高锰酸钾溶液。
(1)实验时观察到:C试管中饱和澄清石灰水变浑浊,E试管中盛浓H2SO4,从E试管流出的气体被点燃,则气体产物是 。D试管中应盛有 溶液,其作用是: 。
(2)固体产物中有钾盐和含铁元素的物质。该小组同学查阅资料后推知固体产物中铁元素无正三价形式,并对固体产物中铁元素存在形式进行了探究。实验过程如下:①取适量固体产物于试管中,加入足量蒸馏水,充分振荡。过滤取出不溶性固体,用蒸馏水充分洗涤。②向试管中加入少量上述不溶固体,加入过量CuSO4溶液,充分振荡。溶液的蓝色明显变浅,且有暗红色固体物质生成。③过滤取出暗红色不溶性固体,用蒸馏水洗涤至洗涤液无色。取少量该固体于试管中,加过量1.0mol·L-1·H2SO4后,静置,取上层清液少许于试管中,滴加适量3%H2O2溶液,充分振荡后滴加20%KSCN溶液,发现溶液呈红色。
以上实验证明固体产物中铁元素的存在形式为: 。
(3)请你对固体产物中钾盐的成分进行探究。
①提出合理假设
假设1:全部为 (写化学式) 假设2:全部为K2 C2O4假设3:为以上二者的混合物。 ②设计实验方案证明你的假设(不用作答) ③实验过程 根据②中方案进行实验。在答题卡上完成下表实验步骤、现象与结论。
实验步骤
预期现象与结论
步骤1:取适量固体产物于试管中,加人适量
蒸馏水,充分振荡,过滤,滤液备用。
固体部分溶解
步骤2:
若有 ,则假设1或3成立。若无此现象,则假设2成立。
步骤3:
若 ,则假设3成立。反应的离子方程式为:
若无此现象则假设1成立。
……
三、选做题(从以下三个模块中任选一题进行解答)
36.【化学—选修化学与技术】(15分)
(2011长春调研二,36)我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: ______。
(2)上述流程中,工业上分离H2 、CO2合理的方法是___________。
A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B.混合气加压冷却,使CO2液化
C.混合气用氨水洗涤
D.混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行___________,目的是________________________________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法: 。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。
37.【化学—选修物质结构与性质】(15分)
(2011海口调研二,19-2)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图
所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
图1
图2
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。
19.(20分)
38.【化学——选修有机化学基础】(15分)
(2011哈三中三模,38)已知:
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5molA完全燃烧只生成3molCO2和2.5molH2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成含甲基的六元环状酯类化合物。
请回答:
(1)1molB与足量的金属钠反应产生的22.4L(标准状况)H2。B中所含官能团的名称是
。B与C的相对分子质量之差为4,B→C的化学方程式是 。
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是 。
(3)F可发生多种类种类型的反应:
①两分子F反应生成的六元环状酯类化合物的结构简式是 。
②由F可生成使 Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是 。
③F在一定条件下发生缩聚反应的化学方程式是 。
(4)A的结构简式是 。
高考仿真模拟11答案解析
7.A 同位素的化学性质相同,A正确;37Cl原子核内中子数应该为20,B错误;12CO2和14CO2为同一种物质,C错误;Ca和Ca2+是同种元素,但性质不同,D错误。
8.A A项溶液显碱性,各种离子可以共存;B项溶液显强酸性或强碱性,在酸性条件下,CO32-、SO32-不能大量共存,在碱性条件下,NH4+不能大量共存,B错误;与铝能产生氢气的溶液,若显强酸性,有NO3-存在,得不到氢气,若显强碱性,NH4+、Fe2+不能大量共存,C错误;D项酸性条件下,ClO-、SO32-因发生氧化还原反应不能大量共存。
9. D ①浓硫酸具有强氧化性,不能用带橡皮塞的棕色试剂瓶存放浓硫酸;②检验醛基要在碱性条件下,氢氧化钠要过量;⑤欲测某溶液的pH,不能用蒸馏水润湿pH试纸。
10.B 本题考查水溶液的相关知识。A项中加水稀释,电离程度增大,H+浓度减小;B项为物料守恒关系式;C项给出的为HCO3-的电离方程式,NaHCO3溶液显碱性是由于HCO3-的水解程度大于电离程度引起的:HCO3-+H2OH2CO3+OH-;D项中两酸的pH相同,c(HCl)