- 82.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考电化学口诀
伍要
高中电化学的教学与学习中,学生们对某些问题的分析与掌握含糊不清;只知其表,不知其实。甚至在教师的教学中对某些问题的讲解与分析也存在诸多讨论。高中电化学是高中化学教学中的重点部分之一,也是难点之一。高考中占有很大的比例。同时,在我们的日常生产、生活中关于电化学知识的运用及现象原理也非常普遍;因此掌握好电化学知识,有着极其重要的意义。但在整个高中化学的教学与学习中都还存在一些问题有待进一步将其讲解透彻,否则会给学生造成错误的理解或学生对知识点的掌握仅局限于表面,出现只知其表,而不知其实的现象,现将自身的一些教学中的体会整理如下:
一、原电池
1.构成原电池的条件
1.要有活动性不同的两个电极(一种金属与另一种金属或石墨或不溶性的金属氧化物);
2.要有电解质溶液;
3.两电极浸入电解质溶液且用导线连接或直接接触。
2.确定原电池电极名称的方法
方法一:根据电极材料的性质确定。通常是
(1)对于金属——金属电极,活泼金属是负极,不活泼金属是正极;
(2)对于金属——非金属电极,金属是负极,非金属是正极,如干电池等;
(3)对于金属——化合物电极,金属是负极,化合物是正极。
方法二:根据电极反应的本身确定。
失电子的反应→氧化反应→负极;
得电子的反应→还原反应→正极。
3.归纳总结:学生理解了原电池的工作原理后,还是很难记住这么多的理论知识,只要时间久了,学生还是忘记的差不多了。上面对于原电池描述的很多,也很详细。我教了几年的化学,每次上课上到这里,我自己都还要把其中的理论知识从头到尾再次梳理几次,还是很难快速定位原电池的正极和负极的反应。今年我再次教高三的学生,我想到了个口诀,它可以快速的定位正极和负极的反应。
4.口诀:“负失负活”(原电池负极失去电子,负极金属比正极材料活泼)
负极:M — ne—=Mn+
正极:(1)酸性溶液中2H++2e—=H2↑
(2)不活泼金属盐溶液Mn++ne—=M
(3)中性、弱酸性条件下2H2O+O2+4e—=4OH—
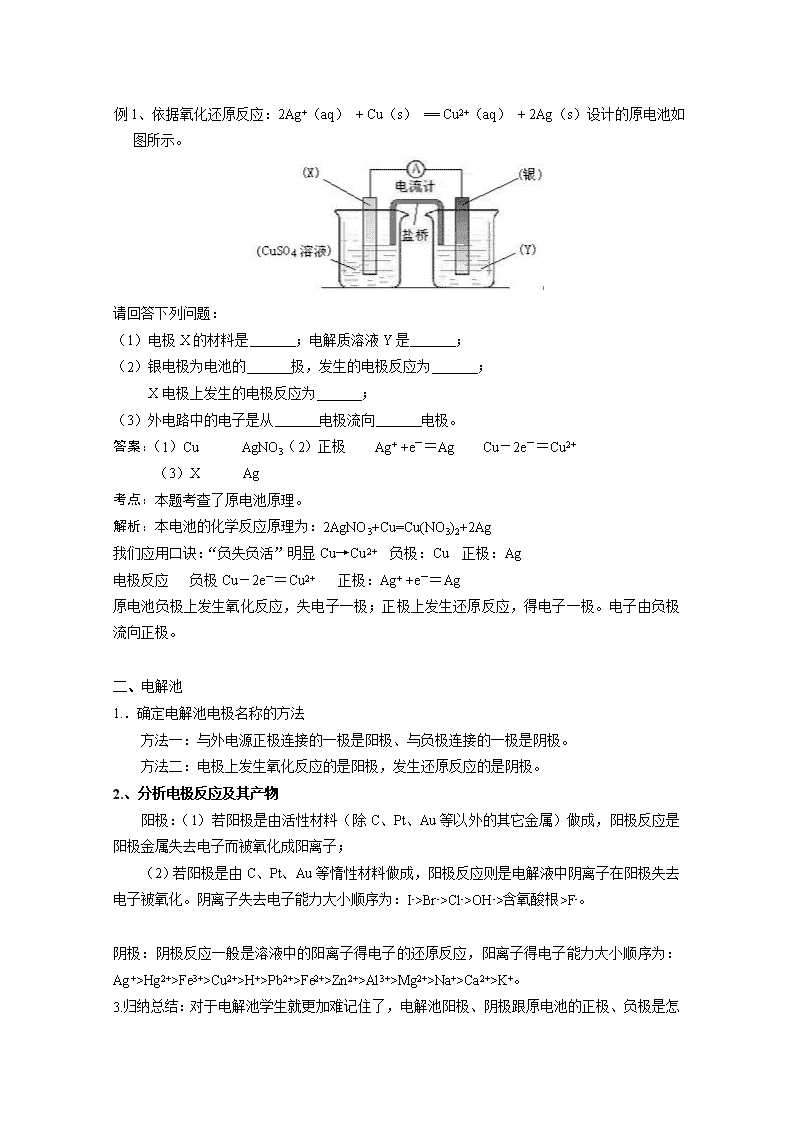
例1、依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
答案:(1)Cu AgNO3(2)正极 Ag+ +e-=Ag Cu-2e-=Cu2+
(3)X Ag
考点:本题考查了原电池原理。
解析:本电池的化学反应原理为:2AgNO3+Cu=Cu(NO3)2+2Ag
我们应用口诀:“负失负活”明显Cu→Cu2+ 负极:Cu 正极:Ag
电极反应 负极Cu-2e-=Cu2+ 正极:Ag+ +e-=Ag
原电池负极上发生氧化反应,失电子一极;正极上发生还原反应,得电子一极。电子由负极流向正极。
二、电解池
1..确定电解池电极名称的方法
方法一:与外电源正极连接的一极是阳极、与负极连接的一极是阴极。
方法二:电极上发生氧化反应的是阳极,发生还原反应的是阴极。
2.、分析电极反应及其产物
阳极:(1)若阳极是由活性材料(除C、Pt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子而被氧化成阳离子;
(2)若阳极是由C、Pt、Au等惰性材料做成,阳极反应则是电解液中阴离子在阳极失去电子被氧化。阴离子失去电子能力大小顺序为:I->Br->Cl->OH->含氧酸根>F-。
阴极:阴极反应一般是溶液中的阳离子得电高考资源网子的还原反应,阳离子得电子能力大小顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。
3.归纳总结:
对于电解池学生就更加难记住了,电解池阳极、阴极跟原电池的正极、负极是怎么连接在一起的。学生是短时间是记住了,但长时间就容易接反,不能准确快速定位。再把原理回想一遍,考试做题的时候就会浪费时间。同样,学生需要一个快速定位的方法,我想了个口诀帮学生快速定位电解池的阳极和阴极的反应。
4.口诀:“阳正阳失”(电解池的阳极跟电源的正极相连接,阳极失去电子)
阳极:(1)活泼金属M — ne— === Mn+
(2)惰性材料(C、Pt、Au)
阴离子失去电子能力大小顺序为:S2—>I—>Br—>Cl—>OH—
阴极:Ag+>Hg2+>Fe3+>Cu2+>H+
例2. 下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列判断正确的是( )
A. a为负极,b为正极 B. a为阳极,b为阴极
C. 电解过程中,d电极的质量增加 D. 电解过程中,氯离子的浓度不变
解析:我们应用口诀:“负失负活”“阳正阳失”根据电流方向可判断出a为正极,b为负极,c为阳极,d为阴极。用惰性电极电解CuCl2溶液时,两个电极上发生的反应阳极(c电极)为:,阴极(d电极)为:。答案:C