- 359.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Mn-55
Fe-56 Cu-64
7.化学与生产、生活相关,下列有关说法正确的是
A.汽车用压缩天然气代替燃油可减少NOx和PM2.5的排放
B.油脂在人体内水解为氨基酸和甘油等小分子物质后才能被吸收
C.“天宫二号”中使用的碳纤维是一种新型有机高分子材料
D.用二氧化硫漂白后的食品显得白亮,二氧化硫可作食品漂白剂
8.双环戊二烯()主要用于制医药,农药,树脂制品,常存在于煤焦油中。下列叙述不正确的是
A.从煤的干馏产物中可分离出苯,甲苯等基本化工原料
B.双环戊二烯与蓝烷()互为同分异构体
C.双环戊二烯能与溴的四氯化碳溶液发生取代反应
D.双环戊二烯所有碳原子不可能共平面
9.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1.8g H218O与D2O的混合物中含有的质子数为NA
B.4.4 g CO2和N2O混合气体中含有的原子总数为0.3NA
C.常温下,5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D.标准状况下,11.2 L乙酸中含有的碳碳键数为0.5NA
10.2017年5月18日,我国海域天然气水合物试采成功,下列分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是 Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是
A.该分析仪工作时,电极a为正极
B.电极a的反应式为:CH4+10OH--8e-=CO32-+7H2O
C.当固体电解质中有1 mol O2-通过时,电子转移4mol
D.该分析仪可用于分析空气中的天然气的含量
11.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的,X2-与Y的简单离子的核外电子排布相同。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄绿色气体产生。下列说法不正确的是
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子半径比X的简单离子半径大
C.X与Y形成化合物的水溶液可使红色石蕊试纸变蓝
D.Z与X不属于同一主族,与Y属于同一周期
12.下列实验中根据现象得出的结论错误的是
选项
实验
现象
结论
A
将充有NO2的密闭烧瓶放入热水中
烧瓶内气体颜色变深
NO2生成N2O4的反应中,△H<0
B
向某溶液中加铜和浓H2SO4
试管口有红棕色气体产生
原溶液可能含有NO3-
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
向浓度均为0.1 mol·L−1的MgCl2、CuCl2混合溶液中逐滴加入氨水
先出现蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
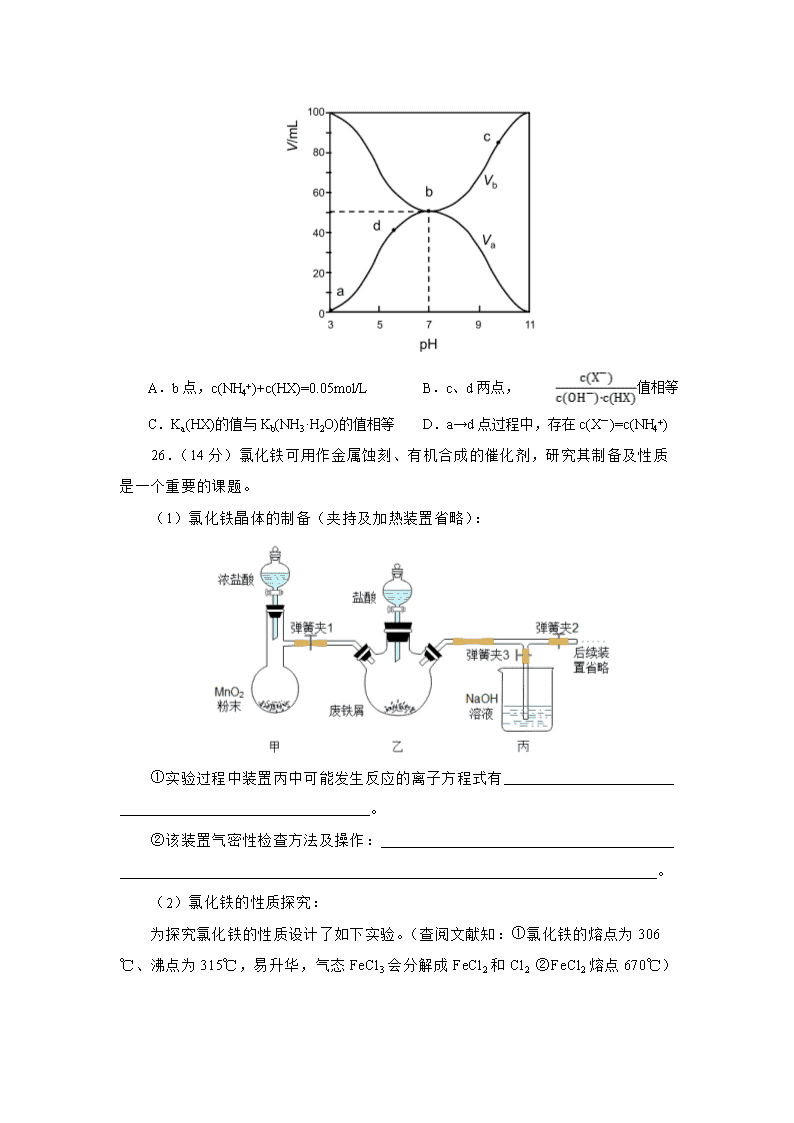
13.25℃时,将浓度均为0.1mol/L 、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是
A.b点,c(NH4+)+c(HX)=0.05mol/L B.c、d两点,值相等
C.Ka(HX)的值与Kb(NH3·H2O)的值相等 D.a→d点过程中,存在c(X-)=c(NH4+)
26.(14分)氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略):
①实验过程中装置丙中可能发生反应的离子方程式有 _ 。
②该装置气密性检查方法及操作: 。
(2)氯化铁的性质探究:
为探究氯化铁的性质设计了如下实验。(查阅文献知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ②FeCl2熔点670℃)
操作步骤
实验现象
解释原因
打开K,充入氮气
D中有气泡产生
①充入N2的原因_____________________。
关闭K,加热至600℃,充分灼烧固体
B中出现棕黄色固体
②产生现象的原因____________________________。
实验结束,振荡C静置
③_______________
④__________________________。(用方程式解释)
27.(14分)一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为__________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,除去Fe2+可用的方法是_____________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH 4~5,再继续煮沸一段时间,“继续煮沸”的目的是_________________。步骤⑤所得滤渣为____________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为____________________。
(4)测定产品MnSO4·H2
O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液VmL,滴定反应的离子方程式为_______________________________,产品中Mn2+的质量分数为w(Mn2+)=_____________。
28.(15分)硫及其化合物在生产生活中应用广泛。回答下列问题:
(1)铁铵矾是一种化学物质,分子式是NH4Fe(SO4)2·12H2O,其溶于水后,溶液中的离子浓度大小关系为__________________。
(2)已知某溶液中含有CO32-、SO42-等离子,取一定量的该溶液,向其中滴加BaCl2溶液,当CO32-开始沉淀时,溶液中为_____。(已知Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9)
(3)已知:S2Cl2(l)+Cl2(g)2SCl2(l) ΔH=-50.2 kJ·mol-1。断裂1mol Cl-Cl键、1mol S-S键分别需要吸收243kJ、268kJ的能量,则断裂1mol S-Cl键需要吸收的能量为______________kJ。
(4)某密闭容器中发生如下反应:2SO2(g)+O2(g)2SO3(g) △H=-197 kJ·mol-1。
①该反应的平衡常数的表达式K=____________。下列能说明反应达到平衡状态的是__________。
a.体系压强保持不变 b.混合气体的密度保持不变
c.SO3和O2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol SO2
②向同温、同体积的两个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;恒温、恒容下反应达平衡时,两个容器内的压强大小关系为__________(用p甲、p乙表示),SO3的质量大小关系为_______________(用m甲、m乙表示)。
(5)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如下图所示(电极材料为石墨)。
阳极的电极反应式为______________________;其中可循环使用的物质是________。
35、[化学——选修3:物质结构与性质](15分)
X、Y、Z、P、Q为前四周期元素,且原子序数依次增大。X基态原子的L层有3个单电子(未成对电子),Z是周期表中电负性最大的元素;Y与P为同主族元素,且P基态原子的M层电子数为K层的3倍;Q2+离子的3d轨道上有9个电子。回答下列问题。
(1)基态Y原子的价电子排布图是____;P所在周期中第一电离能最大的主族元素是__________ (元素名称)。
(2)XY3-中,中心原子的杂化方式为____________;XY2-离子的立体构型是_______________。
(3)X 的氢化物比Y的氢化物沸点低的原因是_________________________。
(4)X的氢化物易形成配位键,而XZ3不易形成配位键,原因是_____________________。
(5)Y 与Q所形成的化合物晶体晶胞如右图所示,该晶体的化学式:______________;晶胞参数如图所示,则该晶胞密度是_______________g·cm-3。(列式并计算结果,保留小数点后一位)。
36.【选修5——有机化学基础】(15分)
尼美舒利是一种非甾体抗炎药,它的一种的合成路线如下:
已知:(易氧化)
回答下列问题:
(1)A的化学名称为__________。
(2)B的结构简式为__________________。
(3)由C生成D的化学方程式为________________________________,其反应类型为________。
(4)E中的官能团有__________、__________ (填官能团名称)。
(5)由甲苯为原料可经三步合成2,4,6-三氨基苯甲酸,合成路线如下:
反应①的试剂和条件为_________________;中间体B的结构简式为_____________;反应③试剂和条件为____________________。
(6)E的同分异构体中能同时满足下列条件的共有_______种(不含立体异构);
①含有两个苯环且两个苯环直接相连
②能与FeCl3溶液发生显色反应
③两个取代基不在同一苯环上
其中核磁共振氢谱为6组峰,峰面积比为2∶2∶2∶2∶2∶1的结构简式为________。
7.A.8.C9.B10.D.11.B12.C13.D
26.(14分)
【答案】(1)①OH-+ H+= H2O (只写对这个给1分); C12+2OH-= ClO-+ Cl-+ H2O(只写对这个给2分)(两个全写对给3分)
② 关闭两个分液漏斗活塞及弹簧夹2,打开弹簧夹1、3,丙烧杯中盛蒸馏水,将导气管插入烧杯中水中,用酒精灯微热甲装置中的烧瓶,若导管末端产生气泡,停止微热,有水柱形成,说明装置不漏气。(3分)
(2)①排出装置内的空气(1分) ②FeCl3易升华(2分)
③溶液分层,上层接近无色,下层为橙红色 (2分)
④2FeCl32FeCl2+Cl2 ; 2Br-+Cl2=Br2+2Cl-(写对一个给2分,两个全写对给3分)
27.(14分)
【答案】(1)提高硫酸浸取时的浸取率(1分)
3MnO2 +2FeS2+6H2SO4=3MnSO4+Fe2(SO4)3+4S↓+6H2O(2分)
(2)加入软锰矿粉或H2O2溶液(2分); 破坏Fe(OH)3胶体并使沉淀颗粒长大,便于过滤分离(2分) Fe(OH)3(1分)
(3)(NH4)2Sx+12NH3+H2S + xS↓(2分)
(4)2MnO4-+3Mn2++2H2O5MnO2↓+4H+ (2分)(2分)
28.(15分)
【答案】(1)c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-) (2分)
(2)25(1分)
(3)280.6(2分)
(4)①(1分) ac(2分)
②p乙2m乙(2分,写 m甲>m乙
给1分)
(5)SO32--2e-+H2O=SO42-+2H+(2分) NaOH(1分)
35、[化学——选修3:物质结构与性质](15分)
(1)(2分)氯(1分)
(2)sp2(1分)V形(2分)
(3)H2O之间的氢键数目比NH3之间氢键数目多(2分)
(4)由于氟元素的电负性比氮元素大,因此在NF3分子中,电子偏向于氟原子,使NF3分子形成配位键的能力减弱。(3分)
(5)CuO(2分) 2.1(2分)
36.【选修5——有机化学基础】(15分)
【答案】(1)苯(1分)
(2)(2分)
(3)(2分) 取代反应(1分)
(4)醚键 、 氨基(2分)
(5)浓硝酸/浓硫酸,加热(1分); (1分); H2,雷尼镍(1分)
(6)9 (2分) (2分)