- 501.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
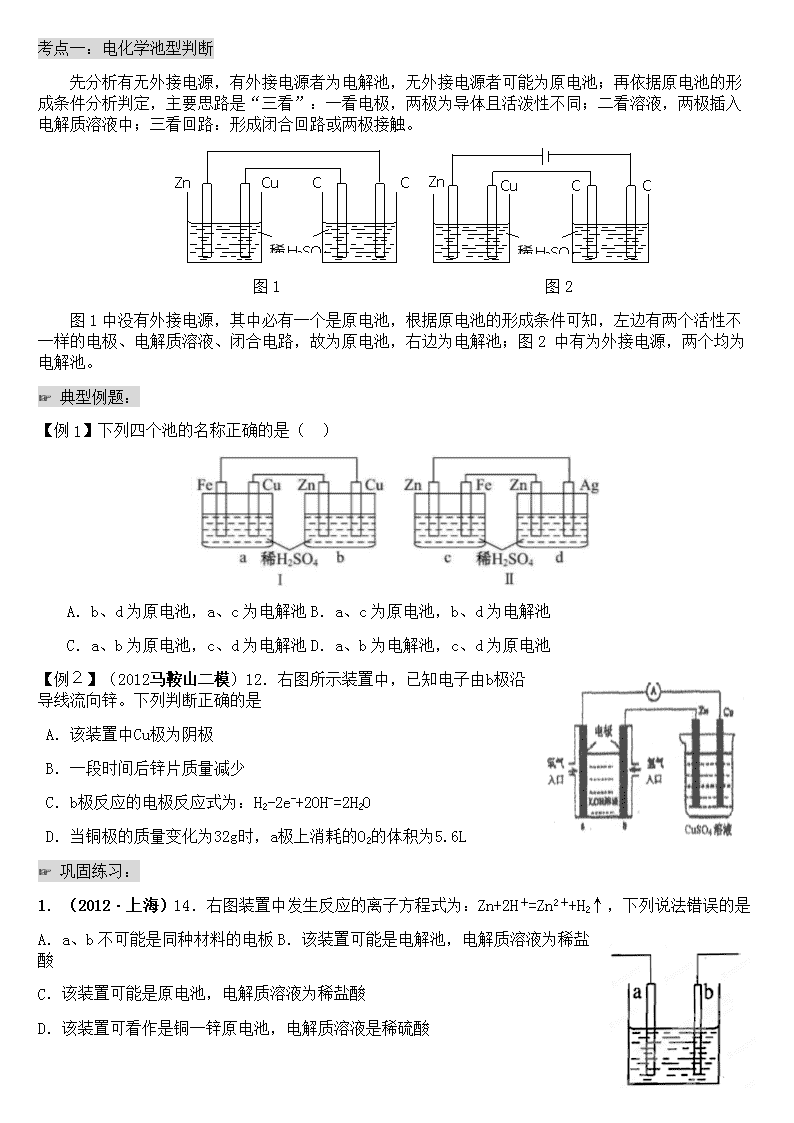
考点一:电化学池型判断
先分析有无外接电源,有外接电源者为电解池,无外接电源者可能为原电池;再依据原电池的形成条件分析判定,主要思路是“三看”:一看电极,两极为导体且活泼性不同;二看溶液,两极插入电解质溶液中;三看回路:形成闭合回路或两极接触。
Zn
Cu
C
C
稀H2SO4
Zn
Cu
C
C
稀H2SO4
图1 图2
图1中没有外接电源,其中必有一个是原电池,根据原电池的形成条件可知,左边有两个活性不一样的电极、电解质溶液、闭合电路,故为原电池,右边为电解池;图2 中有为外接电源,两个均为电解池。
☞ 典型例题:
【例1】下列四个池的名称正确的是( )
A.b、d为原电池,a、c为电解池B.a、c为原电池,b、d为电解池
C.a、b为原电池,c、d为电解池D.a、b为电解池,c、d为原电池
【例2】(2012马鞍山二模)12.右图所示装置中,已知电子由b极沿导线流向锌。下列判断正确的是
A.该装置中Cu极为阴极
B.一段时间后锌片质量减少
C.b极反应的电极反应式为:H2-2e-+2OH-=2H2O
D.当铜极的质量变化为32g时,a极上消耗的O2的体积为5.6L
☞ 巩固练习:
1.(2012·上海)14.右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
A.a、b不可能是同种材料的电板B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可能是原电池,电解质溶液为稀盐酸
D.该装置可看作是铜一锌原电池,电解质溶液是稀硫酸
2.下列装置所示的实验不能达到实验目的的是 ( )
A.形成稳定电流的装置
B.电解饱和食盐水
C.将用含有酚酞的氯化钠溶液润湿的滤纸铺在铂片上写“祝你成功”
D.电解精炼铝
考点二:电化学电极判断
典型例题:
【例1】电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:
Zn + 2 OH- -2e=ZnO + H2O ;Ag2O +H2O + 2e=2Ag +2 OH- ;下列判断正确的是
A.锌为正极,Ag2O为负极。 B.锌为负极,Ag2O为正极。
C.原电池工作时,负极区溶液PH减小。D.原电池工作时,负极区溶液PH增大。
【例2】(2011·大纲版)11.①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极,②④相连时,②有气泡逸出 ;③ ④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是
A.①③②④ B.①③④② C.③ ④ ②① D.③ ① ②④
【例3】(2012·福建)9.将右图所示实验装置的 K 闭合,下列判断正确的是
A.Cu 电极上发生还原反应
B.电子沿 Zn→a→b→Cu 路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色
☞ 巩固练习:
1.(2012合肥三模)12.按右图装置连接后,电流计指针发生偏转。下列有关叙述正确的是
A.此装置是原电池,工作时I-发生氧化反应.
B.此装置工作时,电极反应式为:Fe3++3e-→Fe
C. 若反应物足量,当电路中有1mol电子通过时,将生成 1mol I2
D. 此装置工作时,盐桥中电解质的阳离子向右边电极移动
2.(2012皖南八校第二次联考)10.锌汞电池又称罗宾电池。电解质溶液为KOH溶液,放电时的总反应可表示如下: Zn+HgO=ZnO+Hg 下列有关该电池的说法正确的是 ( )
A.电池放电时,负极反应为Zn2++2e-=Zn B.电池充电时,阴极反应为HgO+H2O+2e-=Hg+2OH-
C.电池放电时,电池正极附近区域K+浓度增大
D.充电时电池上标注有“+”的电极应与外接电源的负极相连
3.(2012宿州三模)11.锂一空气电池是备受瞩目的新一代大容量可充电电池,其放电时的工作原理如图。下列说法正确的是
A.Li+由正极通过有机电解液移动到负极
B.该电池中的有机电解液也可换成水性电解液
C.该电池充电时,a极应与外接电源正极相连
D.b极发生还原反应,其电极反应式为2H2O十O2+4e-=4OH-
考点三:原电池设计
1、原电池的设计方法
(1)首先将已知氧化还原反应拆为两个半反应(即氧化反应和还原反应),如:2FeCl3+Cu=2FeCl2+CuCl2
氧化反应:Cu-2e-→Cu2+ (负极) 还原反应:2Fe3++2e-→2Fe2+ (正极)
(2)根据原电池的电极反应特点,根据两个半反应找出正负极和正负极材料及电解液:Cu失电子负极,正极应选用比Cu不活泼的金属或非金属导体(如C),以保证Cu做负极;电解液中Fe3+应该在正极得到电子,电解液应选用FeCl3溶液。
(3)常见实例
2e-
原 理
负极
正极
电解质溶液
电极反应
2e-
Cu+2FeCl3=2FeCl2+CuCl2
Cu
Pt(C)
FeCl3
负极:Cu-2e-=Cu2+
正极:2Fe3++2e-=2Fe2+
Zn+Ag2O=ZnO+2Ag
Zn
Ag2O
KOH
负极:Zn+2OH--2e-=ZnO+H2O
正极:Ag2O+H2O+2e-=2Ag+2OH-
4e-
2e-
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb
PbO2
H2SO4
负极:Pb+SO-2e-=PbSO4
正极:PbO2+4H++SO+2e-=PbSO4+2H2O
2H2+ O2=2H2O
pt(H2)
pt(O2)
KOH
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
典型例题:
【例1】某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列说法中正确的是:
A.放电时,负极上发生反应的物质是Fe B.放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2
C.充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O D.充电时,阳极附近pH值减小.
【例2】(2012池州一模)12.一种新型燃料电池,一极通入空气,另一极通入甲烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。下列对燃料电池说法正确的是( )
A.在熔融电解质中,O2—由负极移向正极 B.电池的总反应是:CH4+2O2=CO2+2H2O
C.通入空气的一极是正极,电极反应为:O2+4H++4e—=2H2O
D.通入甲烷的一极是正极,电极反应为:CH4+4e—+4O2—=CO2+2H2O
☞ 巩固练习:
1.镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是:H2+NiO(OH)Ni(OH)2。根据此反应式判断,下列叙述中正确的是 ( )
A.电池放电时,电池负极周围溶液的pH不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,氢气是负极
考点四:电极方程式的书写
1、原电池电极反应式的书写方法
①首先,确定正负极。如果题目给的是图示装置,先分析正、负极,再根据正、负极反应规律去写反应式;如果题目给的是总反应式,可分析此反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况),再选择一个简单变化情况去写电极反应式,另一极的电极反应式可直接写或将各反应式看作数学中的代数式,用总反应式减去已写出的电极反应式,即得结果。正负极发生反应的物质分别是发生氧化还原反应的氧化剂和还原剂。
②注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上的反应物质是O2,且电解质溶液为中性或碱性,则H2O必须写入正极反应式中,生成OH-;若电解质溶液为酸性,则H+必须写入正极反应式中,生成H2O。
③正、负极反应式相加得到电池反应的总方程式。若能写出已知电池反应的总方程式,可以减去较易写出的电极反应式,从而得到较难写出的电极反应式。
2、可充电电池电极反应式的书写方法
对于可充电电池的反应,需要看清楚“充电、放电”的方向,放电的过程应用原电池原理,充电的过程应用电解池原理。
如:蓄电池放电时作原电池,充电时作电解池。蓄电池是原电池和电解池二者功能的结合。原电池的负极反应与电解池阴极反应,原电池的正极反应与电解池的阳极反应互为逆过程。
3、燃料电池电极反应式的书写方法
要正确地书写出燃料电池的电极反应,首先要抓住燃料电池的特点:
①在燃料电池中,都是燃料在负极失电子,O2在正极得电子,电解质溶液可能是碱性、酸性,电解质也可能是熔融盐。
②燃料电池的总反应相当于燃料直接燃烧,如果燃烧产物不与所用电解质溶液反应,则燃烧的总反应就是原电池总反应,如燃烧产物与所用电解质溶液反应,则电解质溶液要参与反应,这两个反应的总反应即为原电池的总反应。
③燃料电池的正极反应一般有3个:O2+2H2O+4e-=4OH-(中性、碱性);O2+4H++4e-=2H2O(酸性);O2+4e-=2O2-(熔盐作电解质)。用总反应减去正极反应即得到燃料电池的负极反应。
☞ 典型例题:
【例1】(09广东化学14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH
溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
【例2】(2012蚌埠三模)11.氯碱工业是高耗能产业,一种将电解池与燃料电池相结合的新工艺可以节能30%以上。有关物质之间传输与转化关系如图所示,所有的离子膜只允许钠离子通过。
下列说法正确的是 ( )
A.X气体为H2,Y气体为Cl2 B.装置甲为原电池,装置乙为电解池
C.装置甲膜右侧发生反应为H2-2e-=2H+
D.装置乙膜右侧NaOH浓度增大是因为发生了O2+4e-+2H2O=4OH-反应
☞ 巩固练习:
1.钢铁在很弱的酸性或中性条件下发生电化学腐蚀时,正极的反应式为 ( )
A.Fe-2e-=Fe2+ B.2H++2e-=H2↑ C.2H2O+O2+4e-=4OH- D.Fe-3e-=Fe3+
2.(2012·北京)12.人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH
l 【五年安徽高考题回顾】
l 1.【2010安徽卷·11题】某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本 结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
n 电子通过外电路从b极流向a极
n b极上的电极反应式为:O2+2H2O+4e-=4OH-
n 每转移0.1 mol电子,消耗1.12 L的H2
n H+由a极通过固体酸电解质传递到b极
l 2.【2011安徽卷·12题】研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2 + 2Ag + 2NaCl = Na2Mn5O10 + 2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
l A.正极反应式:Ag + Cl―― e-= AgCl B.没生成1 mol Na2Mn5O10转移2 mol电子
l C.Na+不断向“水”电池的负极移动 D.AgCl是还原产物
l 3. 【2012安徽卷·10题】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。下列有关说法正确的是
l 正极反应式:Ca+2Cl- - 2e- =CaCl2
l 放电过程中,Li+向负极移动
l 每转移0.1mol电子,理论上生成20.7gPb
l 常温时,在正负极间接上电流表或检流计,指针不偏转
l