- 4.46 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
天津高考化学有机推断试题
27.(19分)烯烃通过臭氧化并经锌和水处理得到醛或酮。例如:
I. 已知丙醛的燃烧热为,丙酮的燃烧热为,试写出丙醛燃烧的热化学方程式 。
II. 上述反应可用来推断烯烃的结构。一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。反应图示如下:
回答下列问题:
(1)B的相对分子质量是 ;CF的反应类型为 ;D中含有官能团的名称 。
(2)的化学方程式是: 。
(3)A的结构简式为 。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理只得到一种产物,符合该条件的异构体的结构简式有 种。
27.(19分)I.某天然油脂A的分子式C57H106O5。1摩尔该油脂水解可得到1摩尔甘油、1摩尔不饱和脂肪酸B和2摩尔直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1。
(1)写出B的分子式: 。
(2)写出C的结构简式: ;
C的名称是 。
(3)写出含5个碳原子的C同系物的同分异构体的结构简式: 。
II.RCH=CHR′与碱性KMnO4溶液共热后酸化,发生双键断裂生成羧酸:
①碱性KMnO4,溶液,△
②酸化
RCH=CHR′ RCOOH+R′COOH,常利用该反应的产物反推含碳碳
双键化合物的结构。
在催化剂存在下,1摩尔不饱和脂肪酸B和1摩尔氢气反应后经处理得D和E的混合物,D和E互为同分异构体。当D和E的混合物与碱性KMnO4溶液共热后酸化,得到如下四种产物:
HOOC—(CH2)10—COOH CH3—(CH2)7—COOH
HOOC—(CH2)7—COOH CH3—(CH2)4—COOH
(4)写出D和E的结构简式:
(5)写出B的结构简式: 。
(6)写出天然油脂A的一种可能结构简式: 。
27.(19分)碱存在下,卤代烃与醇反应生成醚(R—O—R‘):
KOH
室温
R—X + R‘OH R—O—R ’+HX
化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下:
请回答下列问题:
(1)1molA和1molH2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为 。
A分子中所含官能团的名称是 。A的结构简式为 。
(2)第①②步反应类型分别为① ② 。
(3)化合物B具有的化学性质(填写字母代号)是 。
a.可发生氧化反应b.强酸或强碱条件下均可发生消去反应c.可发生酯化反应 d.催化条件下可发生加聚反应
(4)写出C、D和E的结构简式:
C 、D和E 。
(5)写出化合物C与NaOH水溶液反应的化学方程式:
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式:
27.(19分)奶油中有一种只含C、H、O的化合物A 。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
⑴.A的分子式为___________。
⑵.写出与A分子式相同的所有酯的结构简式:____________________。
已知:
A中含有碳氧双键,与A相关的反应如下:
⑶.写出A → E、E → F的反应类型:A → E ___________、E → F ___________。
⑷.写出A、C、F的结构简式:A _____________、C ____________、F ___________。
⑸.写出B → D反应的化学方程式:_________________________________________。
⑹.在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:________________。A → G的反应类型为_________。
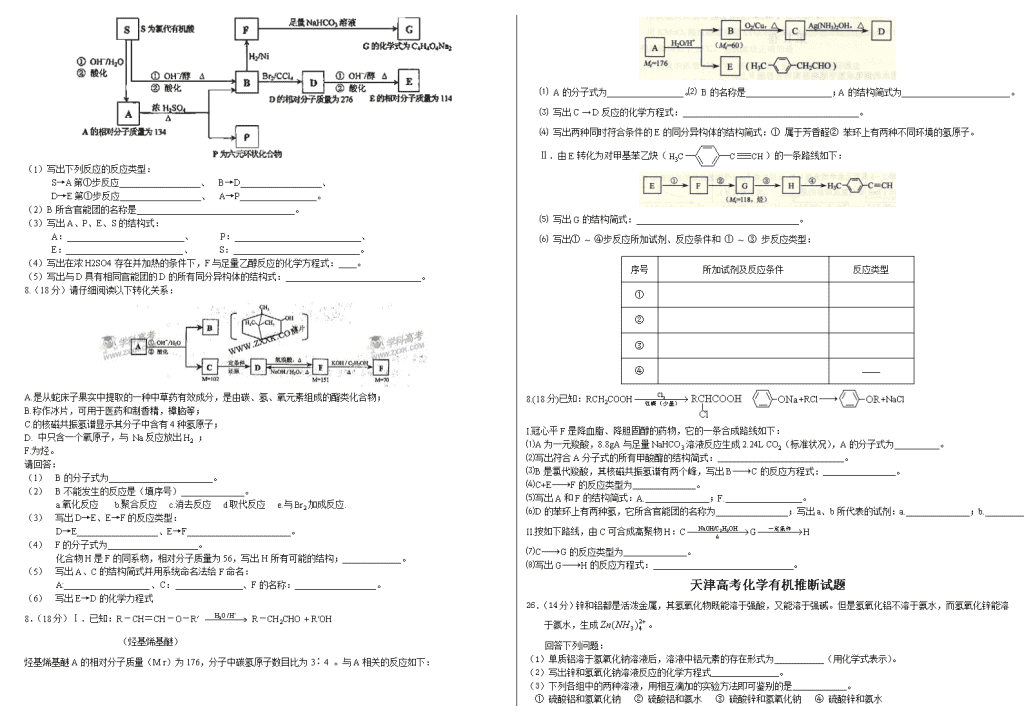
27.(19分)某天然有机化合物A仅含C、H、O元素,与A相关的反应框图如下:
(1)写出下列反应的反应类型:
S→A第①步反应__________________、 B→D__________________、
D→E第①步反应__________________、 A→P_________________。
(2)B所含官能团的名称是___________________________________。
(3)写出A、P、E、S的结构式:
A:__________________________、 P:____________________________、
E:__________________________、 S:____________________________。
(4)写出在浓H2SO4存在并加热的条件下,F与足量乙醇反应的化学方程式:____。
(5)写出与D具有相同官能团的D的所有同分异构体的结构式:______________________________。
8.(18分)请仔细阅读以下转化关系:
A.是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;
B.称作冰片,可用于医药和制香精,樟脑等;
C.的核磁共振氢谱显示其分子中含有4种氢原子;
D. 中只含一个氧原子,与 Na反应放出H2 ;
F.为烃。
请回答:
(1) B的分子式为_______________________。
(2) B不能发生的反应是(填序号)______________。
a.氧化反应 b.聚合反应 c.消去反应 d取代反应 e.与Br2加成反应.
(3) 写出D→E、E→F的反应类型:
D→E__________________、E→F_______________________。
(4) F的分子式为____________________。
化合物H是F的同系物,相对分子质量为56,写出H所有可能的结构;_____________。
(5) 写出A、C的结构简式并用系统命名法给F命名:
A:___________________、C: 、F的名称:__________________。
(6) 写出E→D的化学力程式
8.(18分)Ⅰ.已知:R-CH=CH-O-R′ R-CH2CHO + R′OH
(烃基烯基醚)
烃基烯基醚A的相对分子质量(M r)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
⑴ A的分子式为_________________。⑵ B的名称是___________________;A的结构简式为________________________。
⑶ 写出C → D反应的化学方程式:_______________________________________。
⑷ 写出两种同时符合条件的E的同分异构体的结构简式:① 属于芳香醛② 苯环上有两种不同环境的氢原子。
Ⅱ.由E转化为对甲基苯乙炔()的一条路线如下:
⑸ 写出G的结构简式:____________________________________。
⑹ 写出① ~ ④步反应所加试剂、反应条件和 ① ~ ③ 步反应类型:
序号
所加试剂及反应条件
反应类型
①
②
③
④
——
8.(18分)已知:RCH2COOH +RCl+NaCl
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
⑴A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24L CO2(标准状况),A的分子式为 。
⑵写出符合A分子式的所有甲酸酯的结构简式: 。
⑶B是氯代羧酸,其核磁共振氢谱有两个峰,写出BC的反应方程式: 。
⑷C+EF的反应类型为 。
⑸写出A和F的结构简式:A. ;F. 。
⑹D的苯环上有两种氢,它所含官能团的名称为 ;写出a、b所代表的试剂:a. ;b. 。
II.按如下路线,由C可合成高聚物H:CGH
⑺CG的反应类型为 。
⑻写出GH的反应方程式: 。
天津高考化学有机推断试题
26.(14分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
26.(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
请回答:
(1)写出A、B和C的化学式:A ,B ,C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式: 。
(4)写出由F→H的化学方程式: 。
26.(14分)中学化学中几种常见物质的转化关系如下:
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围: 。
(2)A、B、H的化学式:A 、B 、H 。
(3)①H2O2分子的电子式: 。
②写出C的酸性溶液与双氧水反应的离子方程式:
。
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
26.(14分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为___________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
26.(14分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_______________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为___________________________。
(3)X的硝酸盐水溶液显_________性,用离子方程式解释原因:_______________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为________________。
(5)比较Y、Z气态氢化物的稳定性:______________ >______________(用分子式表示)。(6)W、X、Y、Z因种元素简单离子的离子半径由大到小的顺序是_____________ > ___________ > ___________ > ______________。
(7)Z的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并
放出Q kJ 的热量。写出该反应的热化学方程式:_______________________。
7.(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期
IA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: ____。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
7.(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是__________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。[来源:学科网]
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:______________。
7.(14分)图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题:
⑴组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 ;R的化学式是 。
⑵一定条件下,Z与H2反应转化为ZH4。ZH4的电子式为 。
⑶已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量,写出该反应的热化学方程式: 。
⑷写出A和D的稀溶液反应生成G的离子方程式: 。
⑸向含4mol D的稀溶液中,逐渐加入X粉末至过量,假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
[例题4]:
如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体。化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去。试回答下列问题:
(1)H的电子式:__ ____;
(2)写出化学反应方程式:反应① ;反应③ ;
(3)C与T溶液反应的离子方程式: ;
(4)5.4gC在G中燃烧放出166.9kJ热量,反应②的热化学方程式为: 。
5.下图每一方框中的字母代表一种反应物或生成物:
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
(1) 物质H的分子式是___________。 (2) 反应①的化学方程式是________________________。
(3) 反应②的化学方程式(须注明反应条件)是_______________。
6.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所
示的物质之间的变化:
据此判断:
(1) 固体B所含物质的化学式 。
(2) 固体E所含物质的化学式 。
(3) 反应①的离子方程式为 。
相关文档
- 高考一轮作业必修4Unit4Bodylangua2021-05-1310页
- 高考数学冲刺专题复习之——平面向2021-05-1315页
- 高考的味道——考前必刷题之英语全2021-05-1319页
- 新课标高考历史强化复习讲义104 2021-05-1313页
- 高考英语作文万能句子及高分作文素2021-05-1335页
- 2015年高考北京地理(高清版)2021-05-136页
- 新课标高考总复习人教物理选修32932021-05-1319页
- 高考语言文字运用题汇编附答案2021-05-1326页
- 2018高考倒计时第二天语文必考题型2021-05-134页
- 高考第二轮复习数学江西文科专题升2021-05-135页