- 240.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第 22 讲原电池化学电源二
一、单项选择题
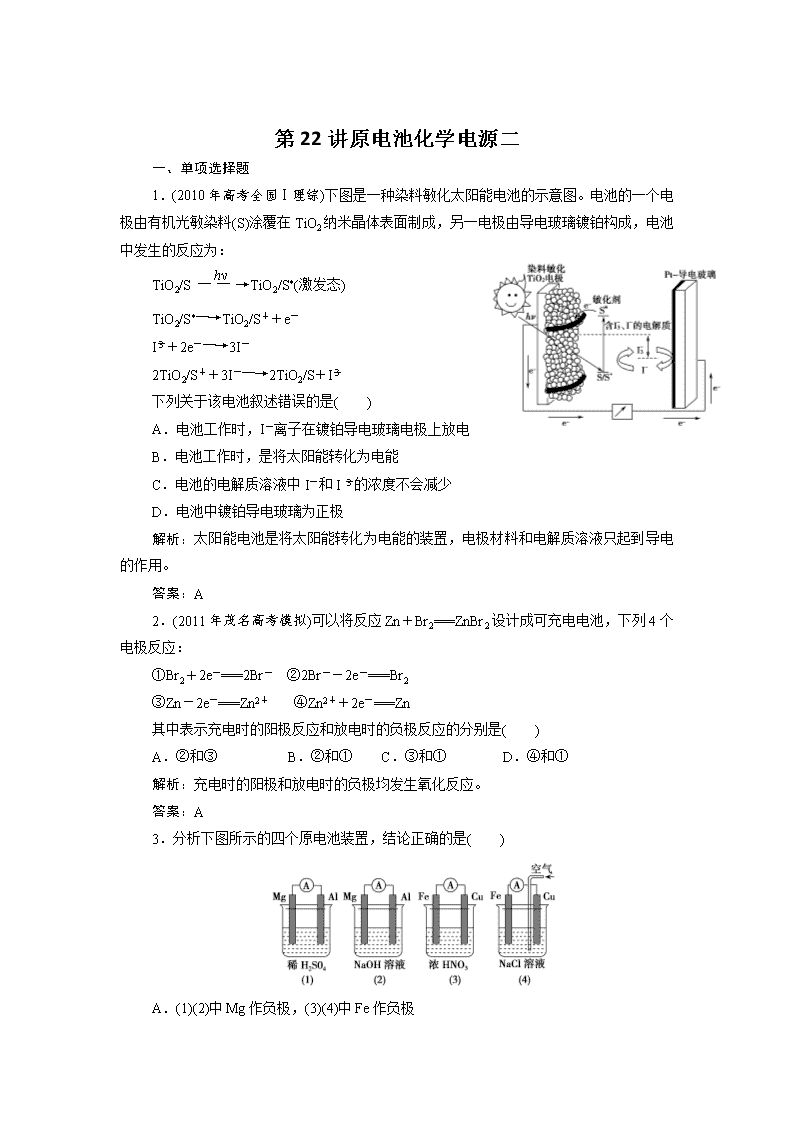
1.(2010 年高考全国Ⅰ理综)下图是一种染料敏化太阳能电池的示意图。电池的一个电
极由有机光敏染料(S)涂覆在 TiO2 纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池
中发生的反应为:
TiO2/S ― ― →hν
TiO2/S*(激发态)
TiO2/S*―→TiO2/S++e-
I-3 +2e-―→3I-
2TiO2/S++3I-―→2TiO2/S+I-3
下列关于该电池叙述错误的是( )
A.电池工作时,I-离子在镀铂导电玻璃电极上放电
B.电池工作时,是将太阳能转化为电能
C.电池的电解质溶液中 I-和 I -3 的浓度不会减少
D.电池中镀铂导电玻璃为正极
解析:太阳能电池是将太阳能转化为电能的装置,电极材料和电解质溶液只起到导电
的作用。
答案:A
2.(2011 年茂名高考模拟)可以将反应 Zn+Br2===ZnBr2 设计成可充电电池,下列 4 个
电极反应:
①Br2+2e-===2Br- ②2Br--2e-===Br2
③Zn-2e-===Zn2+ ④Zn2++2e-===Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A.②和③ B.②和① C.③和① D.④和①
解析:充电时的阳极和放电时的负极均发生氧化反应。
答案:A
3.分析下图所示的四个原电池装置,结论正确的是( )
A.(1)(2)中 Mg 作负极,(3)(4)中 Fe 作负极
B.(2)中 Mg 作正极,电极反应式为:6H2O+6e-===6OH-+3H2↑
C.(3)中 Fe 作负极,电极反应式为:Fe-2e-===Fe2+
D.(4)中 Cu 作正极,电极反应式为:2H++2e-===H2↑
解 析 : (1) 中 Mg 作 负 极 ; (2) 中 Al 作 负 极 , 发 生 的 反 应 为 2Al + 2NaOH +
2H2O===2NaAlO2+3H2↑,Mg 不与 NaOH 反应;(3)中铁遇浓 HNO3 钝化,Cu 与浓 HNO3
反应,Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O;(4)中铁作负极,为中性环境,发生吸氧
腐蚀。
答案:B
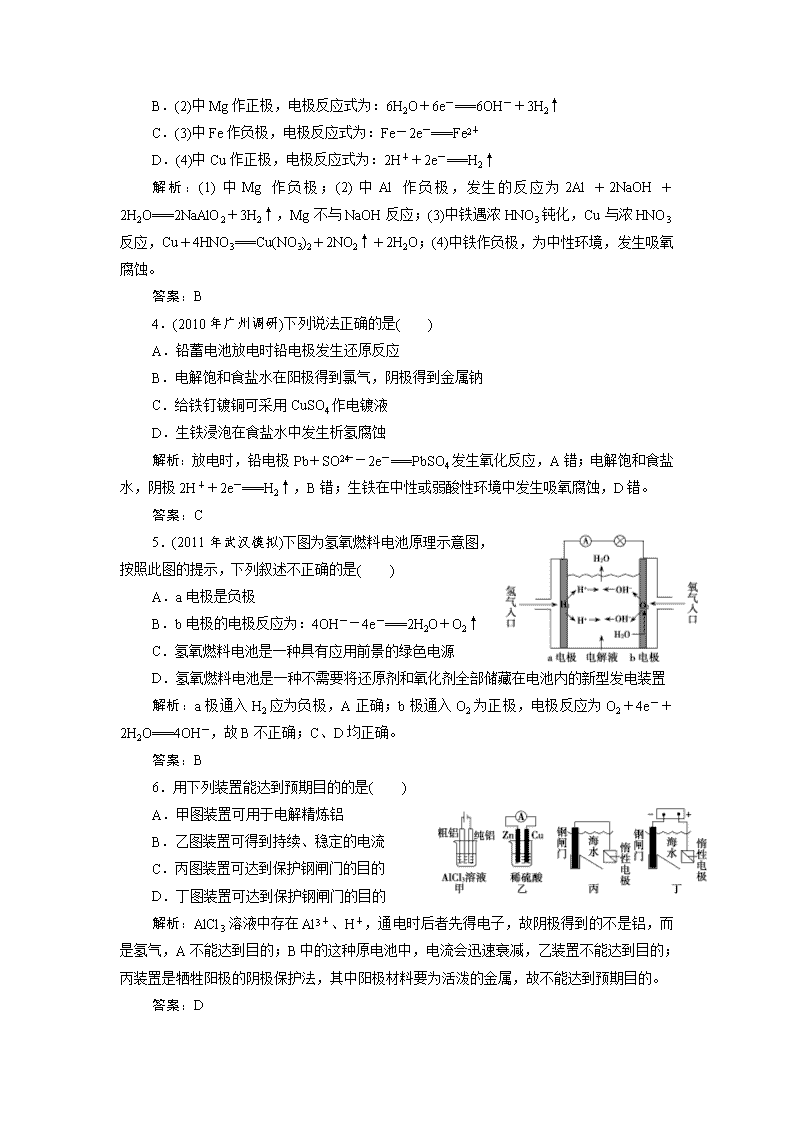
4.(2010 年广州调研)下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用 CuSO4 作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
解析:放电时,铅电极 Pb+SO2-4 -2e-===PbSO4 发生氧化反应,A 错;电解饱和食盐
水,阴极 2H++2e-===H2↑,B 错;生铁在中性或弱酸性环境中发生吸氧腐蚀,D 错。
答案:C
5.(2011 年武汉模拟)下图为氢氧燃料电池原理示意图,
按照此图的提示,下列叙述不正确的是( )
A.a 电极是负极
B.b 电极的电极反应为:4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
解析:a 极通入 H2 应为负极,A 正确;b 极通入 O2 为正极,电极反应为 O2+4e-+
2H2O===4OH-,故 B 不正确;C、D 均正确。
答案:B
6.用下列装置能达到预期目的的是( )
A.甲图装置可用于电解精炼铝
B.乙图装置可得到持续、稳定的电流
C.丙图装置可达到保护钢闸门的目的
D.丁图装置可达到保护钢闸门的目的
解析:AlCl3 溶液中存在 Al3+、H+,通电时后者先得电子,故阴极得到的不是铝,而
是氢气,A 不能达到目的;B 中的这种原电池中,电流会迅速衰减,乙装置不能达到目的;
丙装置是牺牲阳极的阴极保护法,其中阳极材料要为活泼的金属,故不能达到预期目的。
答案:D
7.镁H2O2 酸性电池采用海水作电解质溶液(加入一定量的酸),下列说法正确的是( )
A.电池总反应的离子方程式为: Mg+H2O2+2H+===Mg2++2H2O
B.负极的电极反应为:H2O2+2H++2e-===2H2O
C.工作时,正极周围海水的 pH 减小
D.电池工作时,溶液中的 H+向负极移动
解析:如果总反应式为 Mg+H2O2===Mg(OH)2,则产物为难溶的氢氧化镁,势必导致
电池反应不能长久,正确的总反应式为 Mg+H2O2+2H+===Mg2++2H2O,故 A 正确;正
极反应消耗 H+,故电池工作时,正极周围海水的 pH 增大,且溶液中的 H+向正极移动,
故 B、C、D 错误。
答案:A
8.(2009 年高考广东化学)可用于电动汽车的铝—空气燃料电池,通常以 NaCl 溶液或
NaOH 溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以 NaCl 溶液或 NaOH 溶液为电解液时,正极反应都为:O2+2H2O+4e-===4OH-
B.以 NaOH 溶液为电解液时,负极反应为:Al+3OH--3e-===Al(OH)3↓
C.以 NaOH 溶液为电解液时,电池在工作过程中电解液的 pH 保持不变
D.电池工作时,电子通过外电路从正极流向负极
解析:以 NaOH 溶液作为电解质溶液时,由于 NaOH 过量,因此产物为 AlO -2 或
[Al(OH)4]-,且消耗了 OH-,因此 pH 减小,故 B、C 都不正确;在原电池中电子都是由负
极流向正极的,故 D 也不正确。
答案:A
二、双项选择题
9.(2010 年高考浙江理综改编)LiAl/FeS 电池是一种正在开发的车载电池,该电池中正
极的电极反应式为:
2Li++FeS+2e-===Li2S+Fe
有关该电池的下列说法中,正确的是( )
A.LiAl 在电池中作为负极材料,该材料中 Li 的化合价为+1 价
B.该电池的电池反应式为:2Li+FeS===Li2S+Fe
C.负极的电极反应式为:Al-3e-===Al3+
D.充电时,阳极发生的电极反应式为:Li2S+Fe-2e-===2Li++FeS
解析:在该电池中 LiAl 是负极材料,该材料中 Li 的化合价为 0 价,负极电极反应式
为:Li-e-===Li+,结合题给的正极电极的反应式可推出总反应式为:2Li+FeS===Li2S+
Fe;故 B 正确,A、C 错误。D 项,充电时,阳极上发生反应为放电时正极反应的逆反应,
故 D 正确。
答案:BD
10.(2010 年高考广东理综)铜锌原电池(如图)工作时,下列叙述正确的是( )
A.正极反应为 Zn-2e-===Zn2+
B.电池反应为 Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的 K+移向 ZnSO4 溶液
解析:本题考查原电池。电池的正极得电子,A 选项错
误;结合该电池的装置图可知,该过程中的氧化还原反应为 Zn+Cu2+===Zn2++Cu,B 选项
正确;外电路中,电子从负极流向正极,C 选项正确;左烧杯中由于 Zn 失去电子形成 Zn2
+,使得该烧杯中正电荷的离子增加,为维持电中性,K+应该通过盐桥流向 CuSO4 所在的
右烧杯,D 选项错误。
答案:BC
三、非选择题
11.(2009 年高考海南卷)LiSOCl2 电池可用于心脏起搏器。该电池的电极材料分别为
锂和碳,电解液是 LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+
SO2。
请回答下列问题:
(1)电池的负极材料为________,发生的电极反应为____________________________。
(2)电池正极发生的电极反应为____________________________________。
(3)SOCl2 易挥发,实验室中常用 NaOH 溶液吸收 SOCl2,有 Na2SO3 和 NaCl 生成。如
果把少量水滴到 SOCl2 中,实验现象是__________,
反应的化学方程式为_______________。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
____________。
解析:该题以电池在医疗中的应用为载体,考查了原电池原理,其中包括电极反应的
判断,电极反应式的书写。
(1)从电池的总反应式可知,化合价升高的元素是 Li,故金属 Li 为原电池的负极,失去
1 个电子而成为 Li+。
(2)用原电池总反应式减去负极反应式,即(4Li+2SOCl 2)-4(Li-e -)===(4LiCl+S+
SO2)-4Li+,化简即得 2SOCl2+4e-===4Cl-+S+SO2。
(3)由 SOCl2 与 NaOH 溶液反应生成 Na2SO3 和 NaCl 可知,SOCl2 与水反应的产物是
H2SO3(SO2)和 HCl。由于题目提供的条件是少量水,故 HCl 与二氧化硫挥发,与空气中的水
蒸气结合,出现白雾现象。
(4)锂为碱金属元素的单质,极易与水、氧气反应,而且由第(3)问可知 SOCl2 在水中极
易水解,所以组装这种电池必须在无水、无氧的环境中进行。
答案:(1)锂 Li-e-===Li+
(2)2SOCl2+4e-===4Cl-+S+SO2
(3)出现白雾,有刺激性气体生成 SOCl2+H2O===SO2↑+2HCl↑
(4)锂是活泼金属,易与 H2O、O2 反应;SOCl2 也可与水反应
12.目前移动设备迅猛发展的最大障碍恐怕就是电池的问题,不论手机、MP3 还是笔
记本电脑,如何延长电池续航时间都是人们最头疼的问题。当前,大部分移动设备都使用锂
离子充电电池,但锂电池的安全问题已经越来越受人关注。而银锌材料电池在安全和能量密
度上都比锂离子电池有优势,据称,银锌材料电池的容量比同体积的锂电池高 30%,甚至
可以在不危及安全的情况下过充以实现更高的容量。因此,未来的银锌电池可能替代现有锂
离子电池。
下面是一种银锌电池的充电、放电过程的表示式:
2Ag+Zn(OH)2 Ag2O+Zn+H2O。
根据上述反应原理回答下列问题:
(1)这种电池属于________性电池(填“酸”、“碱”或“中”)。
(2)电池在放电时,作负极的是__________;正极反应式为
_______________。
(3)充电时,电池的正极应接电源的________极。
(4)写出充电时的阳极和阴极电极反应式:
阳极:___________________;
阴极:____________________。
答案:(1)碱性 (2)Zn
Ag2O+2e-+H2O===2Ag+2OH-
(3)正
(4)2Ag-2e-+2OH-===Ag2O+H2O
Zn(OH)2+2e-===Zn+2OH-
13.(2009 年高考山东理综)ZnMnO2 干电池应用广泛,其电解质溶液是 ZnCl2NH4Cl
混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负
极”)。
(2)若 ZnCl2—NH4Cl 混合溶液中含有杂质 Cu2+,会加速某电极的腐蚀,其主要原因是
_______________________。
欲除去 Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2 的生产方法之一是以石墨为电极,电解酸化的 MnSO4 溶液。阴极的电极反应
式是_______________________。若电解电路中
通过 2 mol 电子,MnO2 的理论产量为________g。
解析:(1)原电池的负极是发生氧化反应的一极:Zn-2e-===Zn2+;电池工作时,电子
是从负极流向正极。
(2)Zn 与 Cu2+发生氧化还原反应,生成的 Cu 附着在 Zn 的表面构成铜锌原电池,加快
反应速率,从而加快 Zn 的腐蚀。
(3)电解池的阴极是发生还原反应的一极:2H++2e-===H2↑;每生成 1 mol MnO2 需转
移 2 mol 电子,故每通过 2 mol 电子,理论上生成 1 mol MnO2,质量为 87 g。
答案:(1)Zn(或锌) 正极
(2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 b
(3)2H++2e-===H2↑ 87
14.
(2009 年高考天津理综)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电
池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池的能量转化的主要形式是____________________,在导线中电子流动
方向为________(用 a、b 表示)。
(2)负极反应式为________________________。
(3)电极表面镀铂粉的原因是_________________。
(4)该电池工作时,H2 和 O2 连续由外部供给,电池可持续不断提供电能。因此,大量
安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 =====
△
2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是____________,反应Ⅱ中的氧化剂是____________。
②已知 LiH 固体密度为 0.82 g/cm3,用锂吸收 224 L(标准状况)H2,生成的 LiH 体积与
被吸收的 H2 体积比为________。
③由②生成的 LiH 与 H2O 作用,放出的 H2 用作电池燃料,若能量转化率为 80%,则
导线中通过电子的物质的量为________mol。
解析:(1)氢氧燃料电池是原电池装置,将化学能转化为电能,在燃料电池中通 H2 的一
极发生了氧化反应为负极,所以电子流向为 a→b。
(2)书写该原电池的电极反应式时要注意溶液的酸碱性,KOH 为电解质溶液时,负极反
应为:H2+2OH--2e-===2H2O。
(3)由题干信息可知电极表面镀铂粉目的是为了增强电极吸附气体的能力,可加快电极
反应速率。
(4)②V(LiH)
V(H2) =
20 mol × 8 g/mol
0.82 g/cm3 × 1 000 cm3/L
224 L = 1
1 148
③Ⅰ中消耗 H2 10 mol,则生成 LiH 为 20 mol,则Ⅱ中生成 H2 20 mol,20 mol H2 用作
燃料电池的负极反应,转移 40 mol 电子,若能量转化率为 80%,转移 32 mol 电子。
答案:(1)由化学能转变为电能 由 a 到 b
(2)2H2+4OH--4e-===4H2O 或 H2+2OH--2e-===2H2O
(3)增大电极单位面积吸附 H2、O2 分子数,加快电极反应速率
(4)①Li H2O ②1/1 148 或 8.71×10-4 ③32