- 899.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
第一章 金属及其化合物
第一节
钠及其化合物
1.了解钠的主要性质及其应用。
2.了解钠的重要化合物的主要性质及其应用。
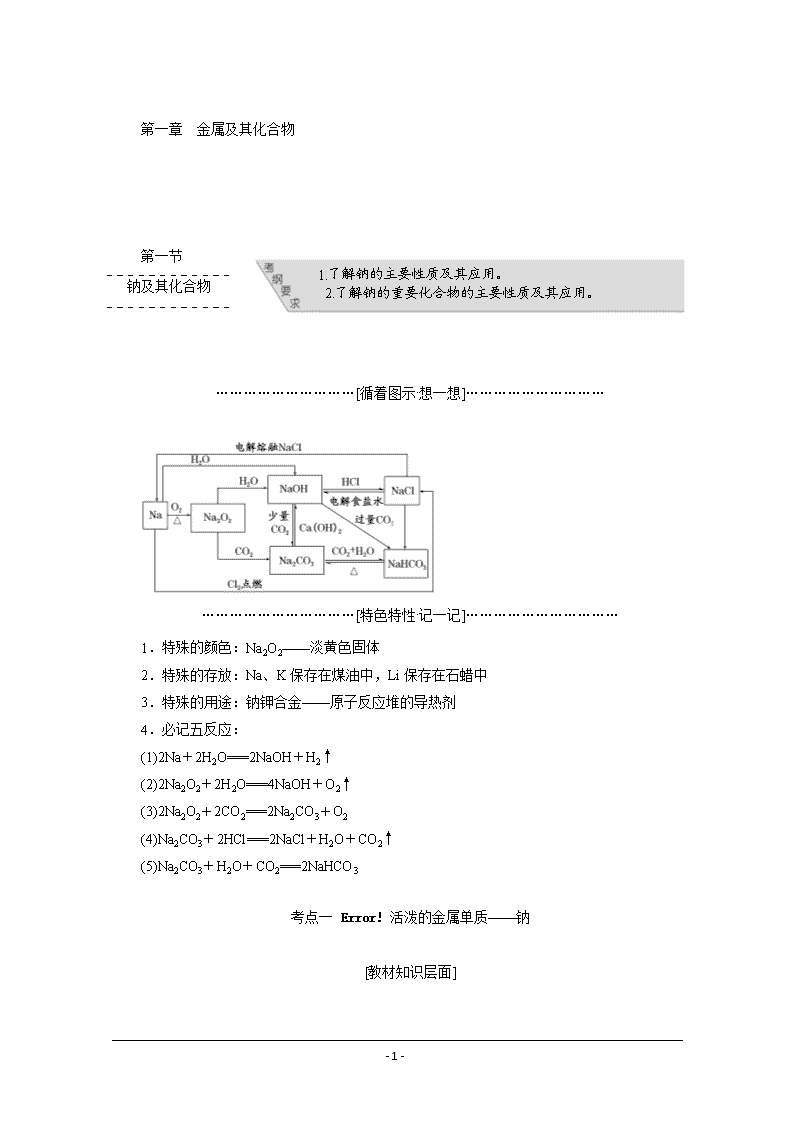
…………………………[循着图示·想一想]…………………………
……………………………[特色特性·记一记]……………………………
1.特殊的颜色:Na2O2——淡黄色固体
2.特殊的存放:Na、K保存在煤油中,Li保存在石蜡中
3.特殊的用途:钠钾合金——原子反应堆的导热剂
4.必记五反应:
(1)2Na+2H2O===2NaOH+H2↑
(2)2Na2O2+2H2O===4NaOH+O2↑
(3)2Na2O2+2CO2===2Na2CO3+O2
(4)Na2CO3+2HCl===2NaCl+H2O+CO2↑
(5)Na2CO3+H2O+CO2===2NaHCO3
考点一 活泼的金属单质——钠
[教材知识层面]
1.钠的原子结构
- 14 -
钠位于元素周期表中第三周期ⅠA族,原子结构示意图:,最外层只有1个电子,在化学反应中易失去最外层电子而呈现+1价,因而钠在化学反应中表现出较强的还原性。
2.钠的性质
(1)物理性质:
颜色
熔点
硬度
密度
导电导热性
银白色
低
小
比水的小
比煤油的大
良好
(2)化学性质:
①与非金属单质(如O2、Cl2)的反应
与O2反应
②与水的反应:
a.化学方程式:2Na+2H2O===2NaOH+H2↑。
b.与滴加酚酞的水反应的现象与解释:
3.钠的制备、保存与用途
(1)制备:电解熔融氯化钠,化学方程式为2NaCl电解,2Na+Cl2↑。
(2)保存:密封保存,通常保存在石蜡油或煤油中。
(3)用途:
①钠钾合金(液态)可用于原子反应堆的导热剂;
②作强还原剂,将某些稀有金属从它们的卤化物中还原出来,如4Na+TiCl4Ti+4NaCl;
③用作电光源,制作高压钠灯。
[高考考查层面]
命题点1 钠与盐溶液的反应
- 14 -
(1)钠投入到NaCl溶液中,只有氢气放出。
2Na+2H2O===2NaOH+H2↑。
(2)钠投入到CuSO4溶液中,产生蓝色沉淀。
2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑。
(3)钠投入到铵盐(如NH4Cl)溶液中,有H2和NH3逸出。
2Na+2H2O===2NaOH+H2↑,
NH4Cl+NaOH===NaCl+NH3↑+H2O。
[典题示例]
金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是( )
A.BaCl2溶液 B.K2SO4溶液
C.CuSO4溶液 D.NH4NO3溶液
解析:选C 因为是溶液中的反应,所以都有H2产生,NH4NO3溶液还产生NH3,CuSO4溶液还产生Cu(OH)2沉淀。
命题点2 焰色反应
(1)概念:
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊颜色的现象。属于元素的物理性质。
(2)操作步骤:
铂丝无色待测物观察火焰颜色铂丝无色。
(3)常见元素焰色反应的颜色:
钠元素:黄色;钾元素:紫色(透过蓝色钴玻璃观察)。
[典题示例]
用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是( )
A.只含有Na+
B.一定含有Na+,可能含有K+
- 14 -
C.既含有Na+,又含有K+
D.可能含有Na+,可能还含有K+
解析:选B Na元素的焰色为黄色,而K元素的焰色为紫色,而且黄色会干扰紫色,所以不能判断是否含有K元素。
[考点达标层面]
1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)(2014·北京高考)将钠块放入水中,产生气体的方程式为2Na+2H2O===2NaOH+H2↑。( )
(2)(2014·北京高考)钠表面自然形成的氧化层能够保护内层金属不被空气氧化。( )
(3)(2013·全国卷Ⅱ)钠与CuSO4溶液的反应:2Na+Cu2+===Cu↓+2Na+。( )
(4)(2013·广东高考)1 mol Na被完全氧化生成Na2O2,失去2NA个电子。( )
(5)钠与足量O2反应生成Na2O,随着温度的升高,生成Na2O的速率逐渐加快。( )
(6)焰色反应是大多数金属元素的性质,属于化学变化。( )
(7)金属钠可以保存在CCl4中。( )
(8)钠、钾着火后,用水或泡沫灭火器可迅速灭火。( )
答案:(1)√ (2)× (3)× (4)× (5)× (6)× (7)× (8)×
2.(2015·郑州模拟)取一小块金属钠,放在燃烧匙里加热,下列现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体物质
A.②⑤ B.①②③ C.①④⑤ D.④⑤
答案:C
考点二 钠的氧化物——氧化钠和过氧化钠
[教材知识层面]
物质
氧化钠(Na2O)
过氧化钠(Na2O2)
颜色状态
白色固体
淡黄色固体
类别
碱性氧化物
过氧化物
氧元素化合价
-2
-1
化学键类型
只有离子键
有离子键和共价键
电子式
Na+[]2-Na+
Na+[]2-Na+
与水反应
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
- 14 -
与CO2反应
Na2O+CO2===Na2CO3
2Na2O2+2CO2===2Na2CO3+O2
与盐酸反应
Na2O+2HCl===2NaCl+H2O
2Na2O2+4HCl===4NaCl+2H2O+O2↑
主要用途
可制烧碱
漂白剂、消毒剂、供氧剂
保存
密封
密封、远离易燃物
[高考考查层面]
命题点1 过氧化钠的强氧化性
1.从元素化合价角度分析Na2O2的性质
2.强氧化性的五个表现
[典题示例]
1.在溶液中加入足量的Na2O2后仍能大量共存的离子组是( )
A.Na+、Fe2+、Cl-、SO B.K+、AlO、Cl-、SO
C.Ca2+、Mg2+、NO、HCO D.Na+、Cl-、CO、SO
解析:选B Na2O2具有强氧化性,能将Fe2+氧化成Fe3+,能将SO氧化成SO,A、D两项不能共存;Na2O2与水反应生成NaOH,C项中的Mg2+、HCO与OH-不能大量共存。
2.下列关于Na2O2的说法正确的是( )
A.Na2O2与SO2反应生成Na2SO3和O2
B.Na2O2投入到酚酞溶液中,溶液变红
C.Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
D.Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
解析:选D Na2O2具有强氧化性,与SO2反应生成Na2SO4而不是Na2SO3,A错误;Na2O2投入到酚酞溶液中,溶液先变红后褪色,B错误;Na2O2不属于碱性氧化物而属于过氧化物,C错误。
命题点2 Na2O2与水、CO2反应的四个重要关系
- 14 -
1.物质的量的关系
无论是CO2或H2O(g)的单一物质还是二者的混合物,与足量的Na2O2反应时,消耗CO2或H2O(g)与放出O2的物质的量之比均为2∶1,即气体减小的体积等于生成的O2的体积。
2.固体质量关系
2CO+O22CO2 ①
2Na2O2+2CO2===2Na2CO3+O2 ②
①+②得,Na2O2+CO===Na2CO3(虚拟的反应)
即CO可被Na2O2完全吸收,固体增重即为CO的质量。
2H2+O22H2O ③
2Na2O2+2H2O===4NaOH+O2↑ ④
③+④得,Na2O2+H2===2NaOH(虚拟的反应)
即H2可被Na2O2完全吸收,固体增重即为H2的质量。
结论:凡分子组成符合(CO)m·(H2)n的物质,m g该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量Na2O2后,固体增重必为m g。或者是由C、H、O三种元素组成的物质,只要C、O原子个数比为1∶1,即可满足上述条件。中学阶段常见的符合这一关系的物质有:
(1)无机物:H2、CO及H2和CO的混合气体;
(2)有机物:CH3OH(甲醇)、HCHO(甲醛)、CH3COOH(乙酸)、C6H12O6(葡萄糖)等。
3.先后顺序关系
一定量的Na2O2与一定量CO2和H2O(g)的混合物反应,解决问题时可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O(g)发生反应(实际情况复杂得多)。
4.电子转移关系
不论是与CO2还是与H2O(g)反应,CO2与H2O(g)均既不是氧化剂也不是还原剂,反应的实质都是Na2O2自身发生的氧化还原反应,所以每有1 mol O2生成时,转移的电子均为2 mol。
[典题示例]
1.200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6 g,则原混合气体的总物质的量是( )
A.0.125 mol B.0.25 mol
C.0.5 mol D.1 mol
解析:选C 根据质量守恒定律可知,生成O2的质量为11.6 g-3.6 g=8 g,n(O2)==0.25 mol,
根据Na2O2与H2O(g)、CO2反应的物质的量的关系可知CO2和H2
- 14 -
O(g)的物质的量之和为0.25 mol×2=0.5 mol。
2.取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,下列物质不能满足上述结果的是( )
A.H2 B.CO
C.C6H12O6 D.C12H22O11
解析:选D 由反应2Na2O2+2H2O===4NaOH+O2↑和2Na2O2+2CO2===2Na2CO3+O2知每摩尔Na2O2与H2O、CO2分别完全反应时,相当于吸收了2 g H2、28 g CO。凡分子组成符合(CO)m·(H2)n的可燃物a g,在O2中完全燃烧,将生成的水和CO2通过足量的Na2O2固体后,固体增重也是a g,或者可以总结为由C、H、O三种元素组成的物质,只要C、O原子个数比为1∶1,即可满足题目要求。
[考点达标层面]
1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)(2014·山东高考)Na2O2与水反应是水作还原剂的氧化还原反应。( )
(2)(2014·江苏高考)过氧化钠的电子式为NaNa。( )
(3)(2014·江苏高考)在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA。( )
(4)(2014·大纲卷)1 mol Na2O2固体中含离子总数为4NA。( )
(5)(2014·全国卷Ⅱ)二氧化碳通过Na2O2粉末,反应后固体物质增重。( )
(6)(2013·江苏高考)Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O===2Na++2OH-+O2↑。( )
答案:(1)× (2)× (3)× (4)× (5)√ (6)×
2.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是( )
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
解析:选C Na2O2的电子式为Na+[]2-Na+,故阴、阳离子的个数比为1∶2,A错误;生成相同量的O2时消耗的水和二氧化碳的物质的量相同,但质量不同,B项错误;由得失电子守恒知两者转移电子的物质的量相同,C项正确;Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成不稳定的无色物质,故原理不同,D项错误。
考点三 钠重要的两种盐——碳酸钠与碳酸氢钠
- 14 -
[教材知识层面]
1.物理性质
名称
碳酸钠
碳酸氢钠
化学式
Na2CO3
NaHCO3
俗名
纯碱或苏打
小苏打
颜色、状态
白色粉末
细小白色晶体
水溶性
易溶于水
水中易溶,但比Na2CO3的溶解度小
2.化学性质
(1)热稳定性:
①Na2CO3性质稳定,受热难分解。
②NaHCO3性质不稳定,受热易分解,化学方程式为2NaHCO3△,Na2CO3+H2O+CO2↑。
(2)与酸(足量盐酸)反应:
①Na2CO3:Na2CO3+2HCl===2NaCl+H2O+CO2↑。
②NaHCO3:NaHCO3+HCl===NaCl+H2O+CO2↑。
(3)与碱(NaOH溶液)反应:
①Na2CO3:与NaOH溶液不反应。
②NaHCO3:NaHCO3+NaOH===Na2CO3+H2O。
(4)相互转化:
①Na2CO3―→NaHCO3
向Na2CO3溶液中通入CO2,化学方程式为Na2CO3+H2O+CO2===2NaHCO3。
②NaHCO3―→Na2CO3
NaHCO3固体加热分解转化成Na2CO3。
3.主要用途
(1)碳酸钠:
用于造纸、制造玻璃、制皂、洗涤等。
(2)碳酸氢钠:
用于发酵、医药、灭火剂等。
[高考考查层面]
命题点1 碳酸钠与碳酸氢钠的鉴别
[典题示例]
- 14 -
1.有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
方案
操作
判断
A
分别加入澄清石灰水
产生沉淀的为Na2CO3
B
分别加入等浓度的稀盐酸
反应较剧烈的为Na2CO3
C
分别加入CaCl2溶液
产生沉淀的为Na2CO3
D
逐渐加入等浓度的盐酸
立即产生气泡的为Na2CO3
解析:选C Na2CO3溶液与NaHCO3溶液均与澄清石灰水反应产生白色沉淀,A错误;等浓度的Na2CO3、NaHCO3溶液分别与等浓度的盐酸反应,产生气泡较快者为NaHCO3溶液,B错误;向Na2CO3溶液中逐滴加入盐酸,开始不产生气泡,过一段时间才有气体产生,D错误;Na2CO3溶液与CaCl2溶液反应产生白色沉淀而NaHCO3溶液与CaCl2溶液不反应,C正确。
2.(2015·扬州模拟)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是
________________________________________________________________________。
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为_____________。
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是(填化学式)________________________________________________________________________。
解析:(1)NaHCO3、Na2CO3都与盐酸反应放出CO2,不能达到目的。
(2)Ⅱ、Ⅲ都是利用NaHCO3的不稳定性进行鉴别。
(3)试管B中装入碳酸氢钠,试管A中装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠很不稳定。
答案:(1)无论是Na2CO3还是NaHCO3均可以与盐酸反应产生CO2,两者的反应现象相同,故达不到鉴别目的
(2)2NaHCO3Na2CO3+H2O+CO2↑,
CO2+Ca(OH)2===CaCO3↓+H2O
(3)NaHCO3
[方法技巧]
- 14 -
鉴别碳酸钠与碳酸氢钠的方法
命题点2 碳酸钠、碳酸氢钠与盐酸反应的四种基本图像
(1)向Na2CO3溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积关系(如图1所示)。
图像特点:Oa段、ab段消耗盐酸的体积相等。
反应原理:Oa段 CO+H+===HCO,
ab段 HCO+H+===H2O+CO2↑。
(2)向NaHCO3溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积关系(如图2所示)。
图像特点:从O点开始即产生CO2气体。
反应原理:HCO+H+===H2O+CO2↑。
(3)向Na2CO3、NaHCO3的混合溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积关系(如图3所示,设Na2CO3、NaHCO3的物质的量之比为m∶n=1∶1,其他比例时的图像略)。
图像特点:Oa段消耗盐酸的体积小于ab段消耗盐酸的体积。
反应原理:Oa段 CO+H+===HCO,
- 14 -
ab段 HCO+H+===H2O+CO2↑。
(4)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积关系(如图4所示,设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略)。
图像特点:Oa段消耗盐酸的体积大于ab段消耗盐酸的体积。
反应原理:Oa段 H++OH-===H2O,
CO+H+===HCO;
ab段 HCO+H+===H2O+CO2↑。
[典题示例]
1.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
解析:选C 向NaOH与Na2CO3的混合溶液中滴加盐酸,盐酸首先与NaOH反应,然后与Na2CO3反应转化为NaHCO3:CO+H+===HCO,之后与HCO反应生成CO2,因n(OH-)=n(CO)=0.01 mol,故加入0.02 mol HCl后开始有气体生成。结合各种物质的量分析图像可知,选项C符合题意。
2.(2015·潍坊期末)向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
A.在0~a范围内,只发生中和反应
B.ab斜段发生反应的离子方程式为CO+2H+===H2O+CO2↑
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
解析:选C 向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1
- 14 -
稀盐酸,发生的反应依次为:OH-+H+===H2O,CO+H+===HCO,HCO+H+===CO2↑+H2O,据此可以解答。在0~a范围内,发生的反应应该是OH-+H+===H2O,CO+H+===HCO,不只发生中和反应,A错误;ab段发生反应的离子方程式为HCO+H+===CO2↑+H2O,B错误;从图像知生成CO2 0.01 mol,根据方程式HCO+H+===CO2↑+H2O可知消耗盐酸的物质的量为0.01 mol,故a=0.3,C正确;根据方程式和图像可知Na2CO3的物质的量是0.01 mol,共计消耗盐酸0.02 mol,所以与氢氧化钠反应的盐酸是0.04 mol-0.02 mol=0.02 mol,则氢氧化钠的物质的量为0.02 mol,因此原混合液中,NaOH与Na2CO3的物质的量之比为2∶1,D错误。
[方法技巧]
依据图像特点判断溶液成分的方法
(1)若a=0,(即图像从原点开始),溶液中的溶质为NaHCO3;
(2)若V(Oa)=V(ab)(即Oa段与ab段消耗盐酸的体积相同),溶液中的溶质为Na2CO3;
(3)若V(Oa)>V(ab)(即Oa段消耗的体积大于ab段消耗盐酸的体积),溶液中的溶质为Na2CO3和NaOH的混合物;
(4)若V(Oa)