- 524.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
天津耀华中学2013届高考化学复习卷 (二十九)
7.化学与生产、环境、生活密切相关。下列叙述错误的是
A.利用高纯硅可以制成光电池,将光能直接转化为电能
B.可吸入颗粒物在空气中形成气溶胶,对人体无害
C.应用高效洁净的能源转化技术,有利于节能减排
D.从海带中提取碘单质的过程涉及氧化还原反应
8.下列说法正确的是
A.共价化合物中一定不含离子键
B.目前使用的元素周期表中,最长的周期含有18种元素
C.非金属元素原子最外层电子数越多,元素非金属性越强
D.同主族元素从上到下,单质的熔点逐渐降低
9.有关钠的说法中,错误的是
A.和是两种核素,的中子数为14
B.Na2O和Na2O2都属于碱性氧化物
C.热稳定性:Na2CO3>NaHCO3
D.钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
10.下列说法正确的是
A.元素由化合态变成游离态时,可能被氧化,也可能被还原
B.浓硝酸具有强氧化性,常温下能够溶解铁
C.日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应
D.添加过量难溶电解质MnS可除去MnCl2溶液中混有的Cu2+,说明MnS的溶解度小于CuS
11.“类推”的思维方式在化学学习与研究中经常采用,但有时会产生错误结论。下列类推结论中,正确的是
A.由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃
B.由Na2O中阴阳离子个数比为1︰2,可推出Na2O2中阴阳离子个数比为 1︰1
C.由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应
D.由“2Fe+3Br2=2FeBr3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
12.下列说法正确的是
A.对于平衡体系:,其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深
B.常温下pH=4的溶液中,、、、可以大量共存
C.常温常压下24g氧气和24g臭氧的混合气体中所含氧原子数为3NA(NA表示阿伏加德罗常数)
D.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
13.常温下,有下列4种溶液:
下列说法正确的是
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液显酸性,则溶液中离子浓度:c(CH3 COO-)>c(Na+)
28.(12分)硫及其化合物在国民生产中占有重要的地位。
(1)为实现废旧印刷线路板综合利用,可用H2O2和稀H2SO4的混合液溶解处理产生的铜粉末,以制备硫酸铜。已知:
①
②
Cu与H2O2和稀H2SO4的混合液反应生成Cu2+和H2O的热化学方程式为 ;
当有1molH2O2参与反应时,转移电子的物质的量为 mol。
(2)硫酸工业生产中涉及如下反应:
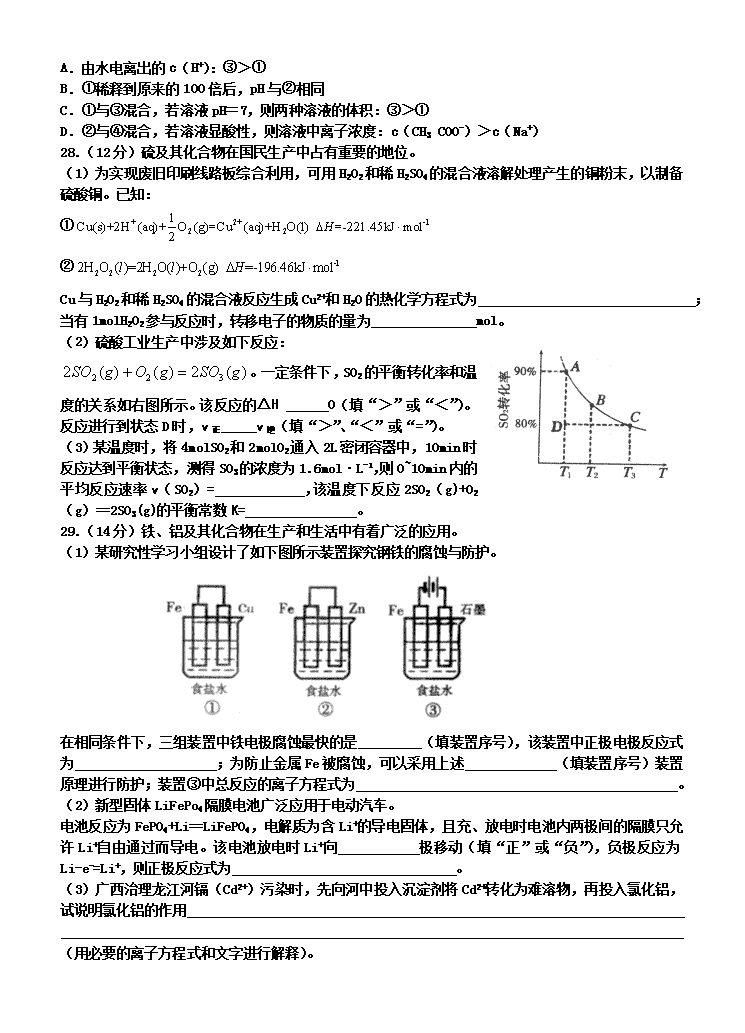
。一定条件下,SO2的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(3)某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol·L-1,则0~10min内的平均反应速率v(SO2)= ,该温度下反应2SO2(g)+O2(g)==2SO3(g)的平衡常数K= 。
29.(14分)铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。
在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为 。
(2)新型固体LiFePo4隔膜电池广泛应用于电动汽车。
电池反应为FePO4+Li==LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
(3)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,试说明氯化铝的作用
(用必要的离子方程式和文字进行解释)。
30.(16分)铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是 、
。
(2)试剂a最好选用 (供选择使用的有:铝粉、空气、浓HNO3);其作用是 。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是 (填序号)。
(4)检验溶液Z中含有的方法是
。
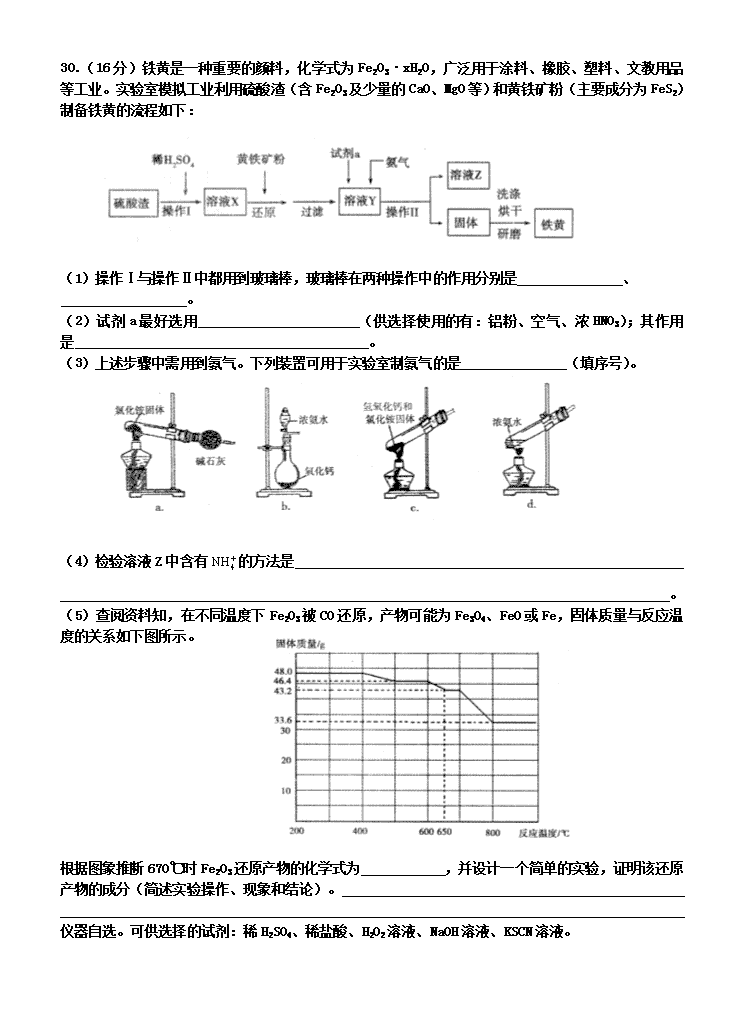
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。
根据图象推断670℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。
仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
33.(8分)普鲁卡因是常见麻醉剂,其合成路线如下:
回答以下问题:
(1)化合物IV的分子式 ,该化合物所含的官能团有:氨基、 、 (填名称)。
(2)化合物Ⅱ(HOCH2 CH2Cl)与氢氧化钠水溶液反应的化学方程式为 。
(3)化合物I→化合物Ⅲ的反应类型是 。
(4)普鲁卡因在酸性条件下的水解生成产物之一为 已知 的一种同分异构体经氧化后也能得到上述化合物Ⅰ,该同分异构体的结构简式是 。
山东省淄博市2012届高三第一次模拟考试
7
8
9
10
11
12
13
B
A
B
A
C
C
D
28.(12分)
(1)(2分)
(H数值随方程式中系数的变化而成比例变化。热化学方程式中各物质不标注聚集状态,不得分;H不标单位不扣分;不带负号、数值出错不得分) 2(2分)
(2)<(2分) >(2分) (写成汉字不得分)
(3)0.16mol·L-1·min-1(2分)(不带单位、单位写错均不得分)
80L·mol-1(2分)(不带单位不扣分,单位写错不得分)
29.(14分)
(1)①(2分)(2分)②③(2分)
(2分)(不同条件得1分)
(2)正(2分) (2分)
(3)氯化铝溶于水,发生水解:,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染。(2分)(把握三个要点:水解的离子方程式;生成胶体;吸附。缺一个要点扣1分。)
30.(16分)
(1)搅拌加速溶解(或搅拌加速反应)(2分)(只答搅拌也得分) 引流(2分)
(2)空气(2分) 作氧化剂,将Fe2+氧化为Fe3+(2分)(答氧化剂、氧化Fe2+或将Fe2+转化为Fe3+也得分)
(3)bd(2分)
(4)取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有。(2分)(三个要点:浓NaOH溶液、湿润的红色石蕊试纸、变蓝。缺一个要点扣1分)
(5)FeO(1分)取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO。(3分)(要点:三组操作与现象、最终结论,少一个扣1分)
33.(8分)【化学——有机化学基础】
(1)C9H10NO2Cl(1分) 氯原子(1分) 酯基(1分)
(2)
或写成:(2分)
(3)酯化反应或取代反应(1分)
(4) (2分)