- 172.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题 17 离子浓度大小比较
1.【2016 年高考江苏卷】H2C2O4 为二元弱酸。20℃时,配制一组 c(H2C2O4)+ c(HC2O4-)
+ c(C2O42-)=0.100 mol·L-1 的 H2C2O4 和 NaOH 混合溶液,溶液中部分微粒的物质的量浓
度随 pH 的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
( )
A.pH=2.5 的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B.c(Na+)=0.100 mol·L-1 的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C.c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O4-)
D.pH=7 的溶液中:c(Na+)>2c(C2O42-)
2.【2016 年高考四川卷】向 1L 含 0.01molNaAlO2 和 0.02molNaOH 的溶液中缓慢通入二氧化
碳,随 n(CO2)增大,先后发生三个不同的反应,当 0.01molc(AlO2-)+c(OH-)
B 0.01 c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C 0.015 c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D 0.03 c(Na+)> c(HCO3-)> c(OH-)>c(H+)
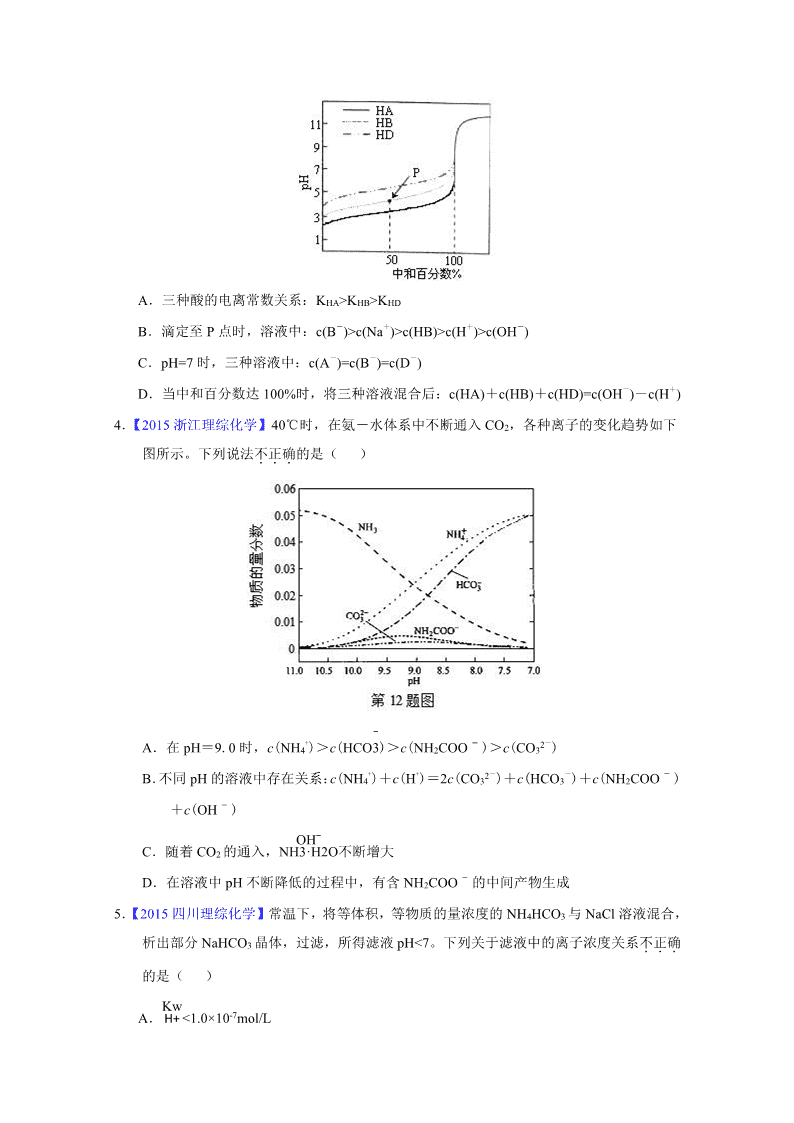
3.【2016 年高考天津卷】室温下,用相同浓度的 NaOH 溶液,分别滴定浓度均为 0.1mol·L-1
的三种酸(HA、HB 和 HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至 P 点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7 时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达 100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
4.【2015 浙江理综化学】40℃时,在氨-水体系中不断通入 CO2,各种离子的变化趋势如下
图所示。下列说法不正确...的是( )
A.在 pH=9.0 时,c(NH4
+)>c(HCO
ˉ
3)>c(NH2COOˉ)>c(CO32-)
B.不同 pH 的溶液中存在关系:c(NH4
+)+c(H+)=2c(CO32-)+c(HCO3
-)+c(NH2COOˉ)
+c(OHˉ)
C.随着 CO2 的通入, OHˉ
NH3·H2O不断增大
D.在溶液中 pH 不断降低的过程中,有含 NH2COOˉ的中间产物生成
5.【2015 四川理综化学】常温下,将等体积,等物质的量浓度的 NH4HCO3 与 NaCl 溶液混合,
析出部分 NaHCO3 晶体,过滤,所得滤液 pH<7。下列关于滤液中的离子浓度关系不正确...
的是( )
A.Kw
H+ <1.0×10-7mol/L
B.c(Na+)= c(HCO3
-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3
-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3
-)> c(CO32-)
6.【2015 山东理综化学】室温下向 10mL0.1mol·L-1NaOH 溶液中加入 0.1 mol·L-1 的一元酸
HA 溶液 pH 的变化曲线如图所示。下列说法正确的是( )
A.a 点所示溶液中 c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b 两点所示溶液中水的电离程度相同
C.pH=7 时,c(Na+)= c(A—)+ c(HA)
D.b 点所示溶液中 c(A—)> c(HA)
7.【2015 安徽理综化学】25℃时,在 10mL 浓度均为 0.1mol/LNaOH
和 NH3·H2O 混合溶液中,滴加 0.1mol/L 的盐酸,下列有关溶液中粒子浓度关系正确的是
( )
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入 10mL 盐酸时:c(NH4
+) +c(H+) = c(OH-)
C.加入盐酸至溶液 pH=7 时:c(Cl-) = c(Na+)
D.加入 20mL 盐酸时:c(Cl-) =c(NH4
+) +c(Na+)
8.【2015 江苏化学】室温下,向下列溶液中通入相应的气体至溶液 pH=7(通入气体对溶液体
积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向 0.10mol·L-1NH4HCO3 溶液中通入 CO2:c(NH4
+)=c(HCO3
-)+c(CO32-)
B.向 0.10mol·L-1NaHSO3 溶液中通入 NH3:c(Na+)>c(NH4
+)>c(SO32-)
C.0.10mol·L-1Na2SO3 溶液通入 SO2:c(Na+)=2[c(SO32-)+c(HSO3
-)+c(H2SO3)]
D.0.10mol·L-1CH3COONa 溶液中通入 HCl:c(Na+)>c(CH3COOH)=c(Cl-)
9.【2014 年高考海南卷】室温下,用 0.l00mol/L NaOH 溶液分别滴定 20.00
mL 0.100 mol/L 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的
是
A.II 表示的是滴定醋酸的曲线
B.pH=7 时,滴定醋酸消耗的 V(NaOH)小于 20 mL
C.V(NaOH)= 20.00 mL 时,两份溶液中 c(Cl-)= C(CH3COO-)
D.V(NaOH) =10.00 mL 时,醋酸溶液中 c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
10.【2014 年高考安徽卷第 11 题】室温下,下列溶液中粒子浓度大小关系正确的是( )
A.Na2S 溶液:c(Na+)>c(HS-) >c(OH-) >c(H2S)
B.Na2C2O4 溶液中:c(OH-)=c(H+)+c(HC2O4
-)+2c(H2C2O4)
C.Na2CO3 溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.CH3COONa 和 CaCl2 混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
11.【2014 年高考江苏卷第 14 题】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的
是( )
A.0.1mol/LCH3COONa 与 0.1mol/LHCl 溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)
>c(OH-)
B.0.1mol/LNH4Cl 与 0.1mol/L 氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4
+)>c(Cl-)
>c(OH-)
C.0.1mol/LNa2CO3 与 0.1mol/L NaHCO3 溶液等体积混合:2
3c(Na+)=c(CO32-)+c(HCO3
-)
+c(H2CO3)
D.0.1mol/LNa2C2O4 与 0.1mol/LHCl 溶液等体积混合(H2C2O4 为二元弱酸):
2c(C2O42-)+c(HC2O4
-)+c(OH-)=c(Na+)+c(H+)
12.【2014 年高考四川卷第 6 题】下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LNaHCO3 溶液与 0.1mol/LNaOH 溶液等体积混合,所得溶液中:
c(Na+)>c(CO32-)>c(HCO3
-)>c(OH-)
B.20ml0.1mol/LCH3COONa 溶液与 10ml0.1mol/LHCl 溶液混合后呈酸性,所得溶液中:
c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2 的盐酸与 pH=12 的氨水等体积混合,所得溶液中:
c(Cl-)>c(H+)>c(NH4
+)>c(OH-)
D.0.1mol/LCH3COOH 溶液与 0.1mol/LNaOH 溶液等体积混合,所得溶液中:
c(OH-)>c(H+)+c(CH3COOH)
13.【2014 年高考天津卷第 5 题】下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1 的 NaHSO4 溶液:c(H+)=c(SO42-)十 c(OH-)
B.含有 AgCl 和 AgI 固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
C.CO2 的水溶液:c(H+)>c(HCO3-)=2c(CO32-)
D . 含 等 物 质 的 量 的 NaHC2O4 和 Na2C2O4 的 溶 液 : 3c(Na+)=2[c(HC2O4-)+
c(C2O42-)+c(H2C2O4)]
14.【2013 年高考四川卷第 5 题】室温下,将一元酸 HA 的溶液和 KOH 溶液等体积混合(忽
略体积变化),实验数据如下表:
实验编号
起始浓度/(mol·L-1)
反应后溶液的 pH
c(HA) c(KOH)
① 0.1 0.1 9
② x 0.2 7
下列判断不正确...的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
Kw
1×10-9mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)