- 147.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题九 化学反应中的能量变化
【考纲要求】1. 了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2. 了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
1.化学反应中的能量变化、放热反应和吸热反应
2.反应热的概念,化学反应过程中能量变化与放热、吸热的关系
3.热化学方程式的概念,正确书写热化学方程式
4.燃烧热和中和热等概念;有关燃烧热和中和热的简单计算
5.中和热的测定。 6. 能量变化的综合利用。
3. 了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
4.了解能源是人类生存和社会发展的重要基础,了解化学在解决能源危机中的重要作用。
【知识梳理】
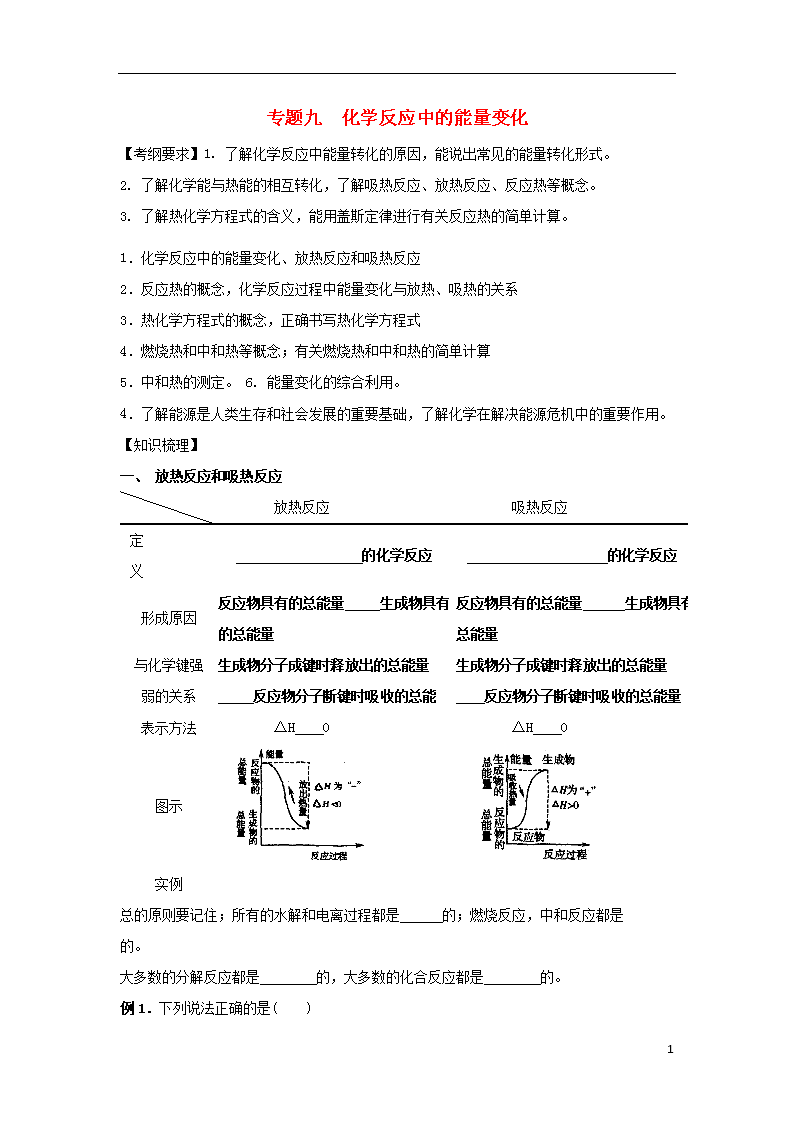
一、 放热反应和吸热反应
放热反应
吸热反应
定义
的化学反应
的化学反应
形成原因
反应物具有的总能量 生成物具有的总能量
反应物具有的总能量 生成物具有总能量
与化学键强弱的关系
生成物分子成键时释放出的总能量
反应物分子断键时吸收的总能
生成物分子成键时释放出的总能量
反应物分子断键时吸收的总能量
表示方法
ΔH 0
ΔH 0
图示
实例
总的原则要记住;所有的水解和电离过程都是 的;燃烧反应,中和反应都是 的。
大多数的分解反应都是 的,大多数的化合反应都是 的。
例1.下列说法正确的是( )
7
A、需要加热才能发生的反应一定是吸热反应
B、任何放热反应在常温条件下一定能发生
C、反应物和生成物所具有的总能量的相对大小决定了放热还是吸热
D、吸热反应在一定条件下(如常温,加热等)也能发生
例2.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨,s)+O2(g)=CO2(g) △H=- 393.51kJ·mol-1,C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ·mol-1
据此判断,下列说法正确的是 ( )
A.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的高
二、 热化学方程式的书写
与普通化学方程式相比,书写热化学方程式除了遵循书写化学方程式要求外还应注意以下五点:
(1) ΔH只能写在标有反应物和生成物状态的化学方程式的右边,若为放热反应,ΔH为“ ”:若为吸热反应,ΔH为“ ”。ΔH的单位一般为
(2)注意反应热ΔH与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明ΔH的测定条件。绝大多数ΔH在25℃、101325Pa下测定的,可不注明温度和压强。
(3)注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的 。因此化学计量数可以是整数、也可以是分数。
(4)注意反应物和产物的聚集状态不同,反应热数值以及符号都可能不同。因此,必须注明物质的聚集状态(s、l、g)才能完整地体现出热化学方程式的意义。热化学方程式中不用↑和↓。
(5)由于ΔH与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。当反应向逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
例如:已知H2(g)+1/2 O2(g)=H2O(1) ΔH=-285.8kJ·mol-1则:
H2O(1)=H2(g)+1/2 O2(g)ΔH= kJ·mol-1 2H2(g)+O2(g)=2H2O(1)ΔH= kJ·mol-1
7
例3. 已知在25℃,101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是 ( )
A.C8Hl8(1)+25/2 O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40kJ·mol-1
B.C8Hl8(1)+25/2 O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
C.C8Hl8(1)+25/2 O2(g)=8CO2(g)+9H2O(l) ΔH=+5518kJ·mol-1
D.C8Hl8(1)+25/2 O2(g)=8CO2(g)+9H2O(l) ΔH=-48.40kJ·mol-1
三、 盖斯定律及其应用
化学反应的反应热只与反应的 (各反应物)和 (各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。即:甲 ΔH 乙 , 甲 ΔH1 丙 ΔH2 乙 , ΔH=ΔH1+ΔH2
如:已知下列三个热化学方程式
①H2(g)+1/2 O2(g)=H2O(g) ΔH= -241.8kJ·mol- 1
②C(s)+O2(g)==CO2(g) ΔH= -393.5kJ·mol- 1
③C(s)+H2O(g)==CO(g)+H2(g) ΔH=+131kJ·mol- 1
写出碳燃烧生成等物质的量CO2和CO的热化学方程式: 。
例4. 100g碳粉燃烧所得气体中,CO占1/3 ,CO2占2/3 体积,且:
C(s)+1/2 O2(g)==CO(g) ΔH=-110.35kJ·mol-1
CO(g)+1/2 O2(g)==CO2(g) ΔH=-282.7kJ·mol-1
与这些碳完全燃烧相比较,损失的热量是 ( )
A、392.92kJ B、2489.44kJ C、784.92kJ D、3274.3KJ
四、燃烧热和中和热
燃烧热
中和热
相同点
能量变化
放热反应
△H
△H<0,单位:kJ/mol
不相同点
反应条件
25℃,101kPa
在稀溶液中
反应物的量
1mol (O2足量)
可能是1mol,也可能是0.5mol
生成物
不限量(稳定氧化物)
H2O是1mol
7
反应热的含义
1mol反应物完全燃烧时放出的热量;不同反应物燃烧热也不同。
生成1molH2O时放出的热量;
例5.氢气(H2)、一氧化碳(CO)、辛烷(C8H18),甲烷(CH4)的热化学方程式分别为
H2(g)+1/2O2(g)==H2O(1) ΔH=-285.8kJ·mol-1 CO(g)+ 1/2O2(g)==CO2(g)ΔH=-283.0kJ·mol-1
C8H18(l)+25/2 O2(g)==8CO2(g)+9H2O(1) ΔH=-5518kJ·mol-1
CH4(g)+2O2(g)==CO2(g)+2H2O(1) ΔH=-890.3kJ·mol-1
相同质量的H2、CO、C8Hl8、CH4完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
例6.强酸与强碱的稀溶液发生中和反应的热效应:H十(aq)+OH- (aq)=H2O(l)ΔH=-57.3kJ·mol-1;分别向1L 0.5mo1·L-1的NaOH溶液中加入:①稀醋酸,②浓H2SO4,③稀硝酸,恰好完全反应时的热效应分别为ΔH l、ΔH2、ΔH3它们的关系正确的是( )
A、ΔH l>ΔH2>ΔH3 B、ΔH2<ΔH3<ΔH l C.ΔH l= ΔH2=ΔH3 D、 ΔH l<ΔH3<ΔH2
五、 能量变化的综合利用
最有希望的新能源是太阳能、燃料电池、风能和氢能等。这些新能源的特点是资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
例7.有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,使之能够实现,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为
A、化学能 B、热能 C、生物能 D、电能
【知能训练】
1、下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)===CO2(g)△H1 C(s)+1/2O2(g)===CO(g)△H2
②S(s)+O2(g)===SO2(g)△H3 S(g)+O2(g)===SO2(g)△H4
③H2(g)+1/2O2(g)===H2O(l)△H5 2H2(g)+O2(g)===2H2O(l)△H6
④CaCO3(s)===CaO(s)+CO2(g)△H7 CaO(s)+H2O(l)===Ca(OH)2(s)△H8
A.① B.④ C.②③④ D.①②③
7
2、[2012·全国大纲理综化学卷9]反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X→C(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是( )
3.下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5KJ/mo1,则水电解的热化学方程式为:
2H2O(1) =2H2(g)+O2(g) △H=+285.5KJ/mo1
B.1moI甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,它的热化学方程式为: CH4(g)+2O2(g)= CO2(g)+2H2O(1)△H=-890kJ/mol
C. 已知2C(s)+O2(g)=2CO(g)△H=-221kJ·mol- 1,则可知C的燃烧热为110.5kJ/mo1
D. HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(1)△H= -57.3kJ/mol
4.已知下列两个热化学方程式:2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ/mo1,C3H8(g)+5O2 (g)=3CO2(g)+4H2O(1)△H=-2220kJ/mol,实验测得氢气和丙烷的混合气体共5mo1,完全燃烧时放出3847kJ的热量,则混合气体中氢气与丙烷的体积比为( )
A.1:3 B.3:1 C.1:4 D.1:1
5.白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A.(6a+5d-4c-12b)kJ·mol—1 B(4c+12b-6a-5d)kJ·mol—1
C.(4c+12b-4a-5d)kJ·mol—1 D.(4a+5d-4c-12b)kJ·mol—1
6. (09年宁夏理综·28)(14分)2SO2(g)+O2(g) 2SO3(g)
反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3
的ΔH= —99kJ·mol—1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol—1;
7
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率v(SO2)为0.05 mol·L—1·min—1,则v(O2)= mol·L—1·min—1、v(SO3)=
mol·L—1·min—1;
(5)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H
7
专题九 化学反应中的能量变化 参考答案
例1—例7 CD, A, B, C, B, B, B
知能训练:1 C 2 D 3 B 4 B 5 A
6. (1)反应物能量 生成物能量 无 降低 因为催化剂改变了反应的历程使活化能E降低
(2)—198 (3)SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5 (4)0.025 0.05
(5)S(s)+O2(g) =2SO2(g)△H1=—296 KJ·mol—1 ,
SO2(g)+1/2O2(g) SO3(g) △H2=—99 KJ·mol—1
3S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=—1185 KJ·mol—1
7
相关文档
- 高考化学一轮复习 专题 Fe2+、Fe3+2021-05-136页
- 2020高考化学第一轮复习 专题 离子2021-05-134页
- 高考化学二轮复习资料专题金属及其2021-05-1319页
- 高考化学一轮复习 基础题系列(2)(含解2021-05-1312页
- 2020年高考化学第一轮复习 专题 氮2021-05-137页
- 高考化学一轮复习 专题1-2 物质的2021-05-1315页
- 高考化学一轮复习课时分层训练28沉2021-05-1314页
- 2014年版高考化学题目型十三有机物2021-05-134页
- 全国II卷高考化学试题2021-05-138页
- 2014北京高考化学试卷及答案2021-05-138页