- 229.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
加试31题专练
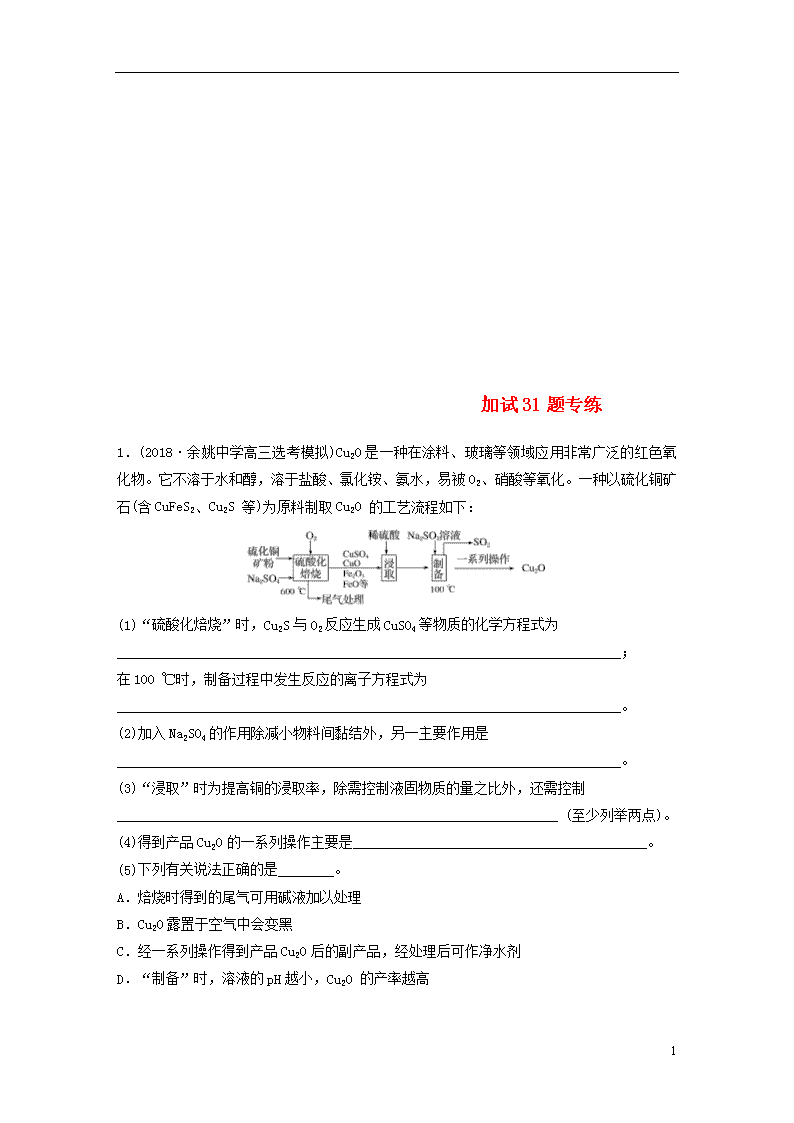
1.(2018·余姚中学高三选考模拟)Cu2O是一种在涂料、玻璃等领域应用非常广泛的红色氧化物。它不溶于水和醇,溶于盐酸、氯化铵、氨水,易被O2、 硝酸等氧化。一种以硫化铜矿石(含CuFeS2、Cu2S 等)为原料制取Cu2O 的工艺流程如下:
(1)“硫酸化焙烧”时,Cu2S与O2反应生成CuSO4等物质的化学方程式为
________________________________________________________________________;
在100 ℃时,制备过程中发生反应的离子方程式为
________________________________________________________________________。
(2)加入Na2SO4的作用除减小物料间黏结外,另一主要作用是________________________________________________________________________。
(3)“浸取”时为提高铜的浸取率,除需控制液固物质的量之比外,还需控制_______________________________________________________________ (至少列举两点)。
(4)得到产品Cu2O的一系列操作主要是__________________________________________。
(5)下列有关说法正确的是________。
A.焙烧时得到的尾气可用碱液加以处理
B.Cu2O露置于空气中会变黑
C.经一系列操作得到产品Cu2O后的副产品,经处理后可作净水剂
D.“制备”时,溶液的pH越小,Cu2O 的产率越高
5
答案 (1)2Cu2S+5O22CuSO4+2CuO 2Cu2++3SOCu2O↓+SO+2SO2↑
(2)提高焙烧产物中CuSO4的比例
(3)浸取温度、浸取时间、硫酸的浓度等(答出两点即可)
(4)抽滤、洗涤、干燥
(5)ABC
解析 (2)加入Na2SO4的作用除减小物料间黏结外,另一主要作用是提高焙烧产物中CuSO4的比例。
(3)“浸取”时为提高铜的浸取率,除需控制液固物质的量之比外,还需控制浸取温度、浸取时间、硫酸的浓度等。
(5)焙烧时得到的尾气为SO2,可用碱液加以处理,故A正确;Cu2O易被O2氧化,露置于空气中会被氧化为黑色CuO,故B正确;经一系列操作得到产品Cu2O后的副产品硫酸铁,水解产生Fe(OH)3,可用作净水剂,故C正确;Cu2O在酸溶液中会发生自身氧化还原反应生成Cu和Cu2+,故D错误。
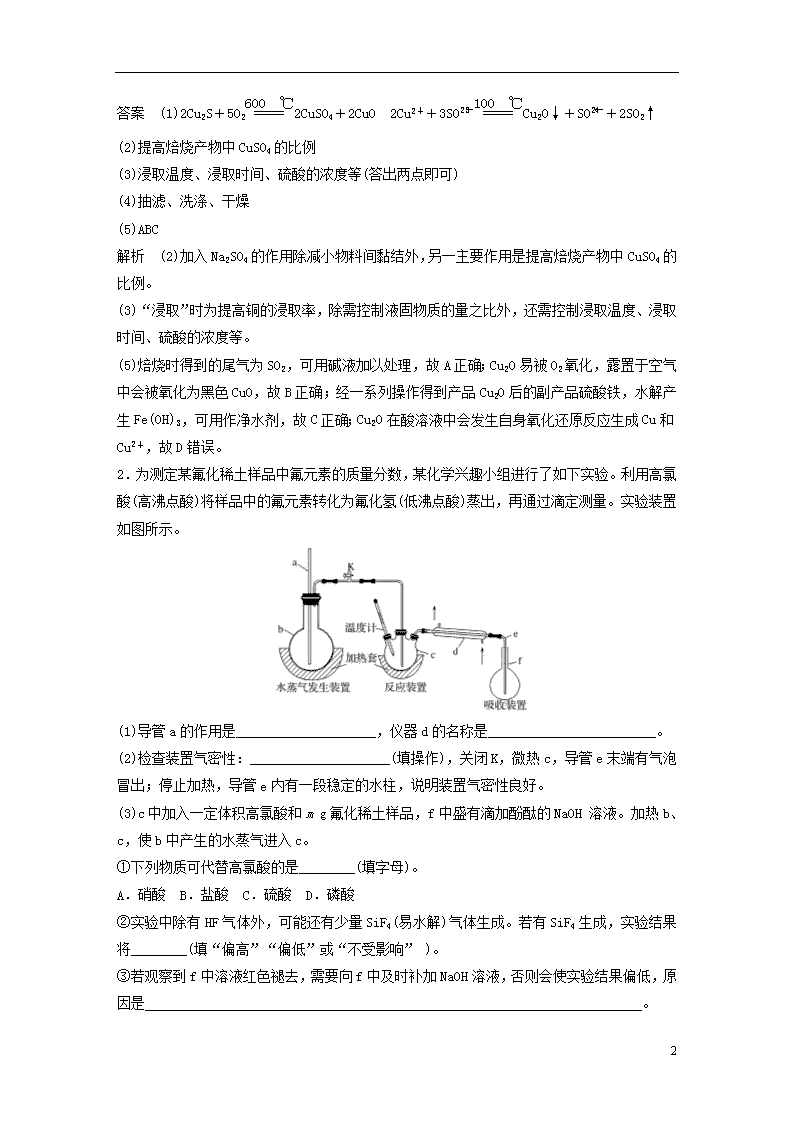
2.为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量。实验装置如图所示。
(1)导管a的作用是____________________,仪器d的名称是________________________。
(2)检查装置气密性:____________________(填操作),关闭K,微热c,导管e末端有气泡冒出;停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。
(3)c中加入一定体积高氯酸和m g氟化稀土样品,f中盛有滴加酚酞的NaOH 溶液。加热b、c,使b中产生的水蒸气进入c。
①下列物质可代替高氯酸的是________(填字母)。
A.硝酸 B.盐酸 C.硫酸 D.磷酸
②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成。若有SiF4生成,实验结果将________(填“偏高”“偏低”或“不受影响” )。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是_______________________________________________________________________。
5
(4)向馏出液中加入V1 mL c1 mol·L-1 La(NO3)3溶液,得到LaF3沉淀,再用c2 mol·L-1 EDTA标准溶液滴定剩余La3+(La3+与EDTA按1∶1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为____________________。
(5)用样品进行实验前,需要用0.084 g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次。该操作的目的是__________________。
答案 (1)平衡压强 直形冷凝管
(2) 在b和f中加水,水浸没导管a和e末端
(3)①CD ②不受影响 ③充分吸收HF气体,防止其挥发损失
(4)或%
(5)寻找最佳实验条件
解析 (1)a的作用是平衡压强,防止圆底烧瓶中压强过大,引起爆炸,d的名称是直形冷凝管。(3)①利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出;硝酸易挥发,故A项错误;盐酸易挥发,故B项错误;硫酸难挥发,沸点高,故C项正确;磷酸难挥发,沸点高,故D项正确;②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成实验结果将不受影响。(4)氟化稀土样品中氟的质量分数为=。(5)该操作的目的是通过做对比实验,寻找最佳实验条件。
3.(2017·杭州第二中学高三上学期选考)碘酸钙[Ca(IO3)2·6H2O]可以按照如下反应来制备:
I2+2KClO3+HCl===KIO3·HIO3+KCl+Cl2↑
KIO3·HIO3+KOH===2KIO3+H2O
CaCl2+2KIO3===Ca(IO3)2↓+2KCl
冷却结晶过程中得到的产物随温度不同会带不同数目的结晶水,如下表:
碘酸钙存在形式
Ca(IO3)2
Ca(IO3)2·H2O
Ca(IO3)2·6H2O
稳定温度
>57.5 ℃
32~57.5 ℃
<32 ℃
[实验步骤]
Ⅰ.碘酸钙的制备: 如图1接好装置,在圆底烧瓶中依次加入2.54 g 碘、2.50 g 氯酸钾和水,滴加盐酸。通电加热搅拌,水浴温度保持在 85 ℃左右,直至反应完全。将溶液转入烧杯中,滴加KOH溶液至pH≈10,逐渐加入CaCl2溶液,生成白色沉淀,不断搅拌至沉淀完全。反应混合物先用水冷却,再在冰水中静置 10 min,然后用双层滤纸抽滤,用少量冰水洗涤,再用少量无水乙醇洗涤,干燥后得产品3.78 g。
5
Ⅱ.产品纯度分析:
准确称取0.500 0 g 样品,置于烧杯中,加入高氯酸,微热溶解试样,冷却后移入250 mL 容量瓶中,加水稀释定容,摇匀。移取25.00 mL试液置于碘量瓶(如图2)中,加入1∶1高氯酸酸化, 一定量KI 固体,盖上瓶塞,在暗处放置反应3 min,加水,用0.040 00 mol·L-1硫代硫酸钠标准溶液滴至溶液呈浅黄色,加淀粉溶液 2 mL,继续滴定至终点,平行测定多次,实验数据记录如下:
1
2
3
4
滴定起始刻度/mL
0.20
1.52
0.84
1.16
滴定终止刻度/mL
31.53
31.50
30.84
31.18
Na2S2O3 溶液用量/mL
附:本题使用的摩尔质量(g·mol-1)
碘酸钙无水盐:389.88 一水合物:407.90 六水合物:497.99 碘酸钾:214.00 碘:253.80
请回答:
(1)本实验中C烧杯内装的溶液是____________,作用是________________。
(2)根据____________现象,可以判定碘与氯酸钾的反应已进行完全。
(3)加入CaCl2溶液后需检验沉淀是否完全,写出检验的步骤及方法________________________________________________________________________。
(4)在进行产品纯度分析的时候,发生了如下反应,请写出第一步的离子方程式:
第一步:________________________________________________________________________;
第二步:2Na2S2O3+I2===Na2S4O6+2NaI。
(5)该实验的产率为__________,产品的纯度为_____________________________________。
(6)下列操作说法中正确的是________。
A.制备过程水浴加热时,冷凝管下口出现固体未作处理会使产率偏低
B.制备过程未使用冰水浴,会使产率偏高
C.产品纯度分析时加入稍过量KI对实验没有影响
5
D.滴定完成后,仰视滴定管读数会使纯度偏高
答案 (1)氢氧化钠溶液 吸收尾气氯气
(2)反应至溶液无色
(3)取上层清液少许于试管中,加入少量CaCl2溶液,若不变浑浊,说明已沉淀完全
(4)IO+5I-+6H+===3I2+3H2O
(5)75.91% 99.60%
(6)ACD
解析 (5)4次滴定实验,每次消耗Na2S2O3的体积分别为
31.53 mL-0.20 mL=31.33 mL
31.50 mL-1.52 mL=29.98 mL
30.84 mL-0.84 mL=30.00 mL
31.18 mL-1.16 mL=30.02 mL
第1次舍去,平均消耗Na2S2O3的体积为30.00 mL
根据IO+5I-+6H+===3I2+3H2O;2Na2S2O3+I2===Na2S4O6+2NaI得
IO ~ 3I2 ~ 6Na2S2O3
2×10-4 mol 30.00×10-3×0.040 00
=1.2×10-3 mol
所以Ca(IO3)2·6H2O的质量为
×10 mol×497.99 g·mol-1=0.497 99 g
其纯度为×100%≈99.60%
n(I2)=≈0.01 mol
n(KClO3)=≈0.02 mol
所以Ca(IO3)2·6H2O的理论产量为
0.01 mol×497.99 g·mol-1=4.979 9 g
产率为×100%≈75.91%。
5
相关文档
- 2020版高中数学 第一章 统计 12021-05-132页
- 优化方案高中语文人教版必修三学案2021-05-134页
- 2020高中地理 第03天 城市内部空间2021-05-135页
- 新高考湘教版高中必修一地理复习知2021-05-1315页
- 高中地理必修一会考高考易错题2021-05-137页
- 新课标高中生物全套思维导图(适用22021-05-1319页
- 高中数学高考一轮复习正弦定理和余2021-05-135页
- 高中数学函数解题技巧方法总结高考2021-05-1318页
- 2013高中生物浙科版必修1单元检测 2021-05-136页
- 2020版高中数学 第一章 统计 12021-05-134页