- 425.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
强化练3 多重曲线的分析与应用
1.(2018·杭州市学军中学高三选考前适应性练习)常温下,现有 0.1 mol·L-1的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是( )
A.当溶液的 pH=9 时,溶液中存在下列关系:
c(NH)>c(HCO)>c(NH3 ·H2O)>c(CO)
B.NH4HCO3 溶液中存在下列守恒关系:
c(NH)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO)+c(H2CO3)
C.往该溶液中逐滴滴加氢氧化钠时,NH和 HCO浓度均逐渐减小
D.通过分析可知常温下Kb(NH3·H2O)大于 Ka1(H2CO3)
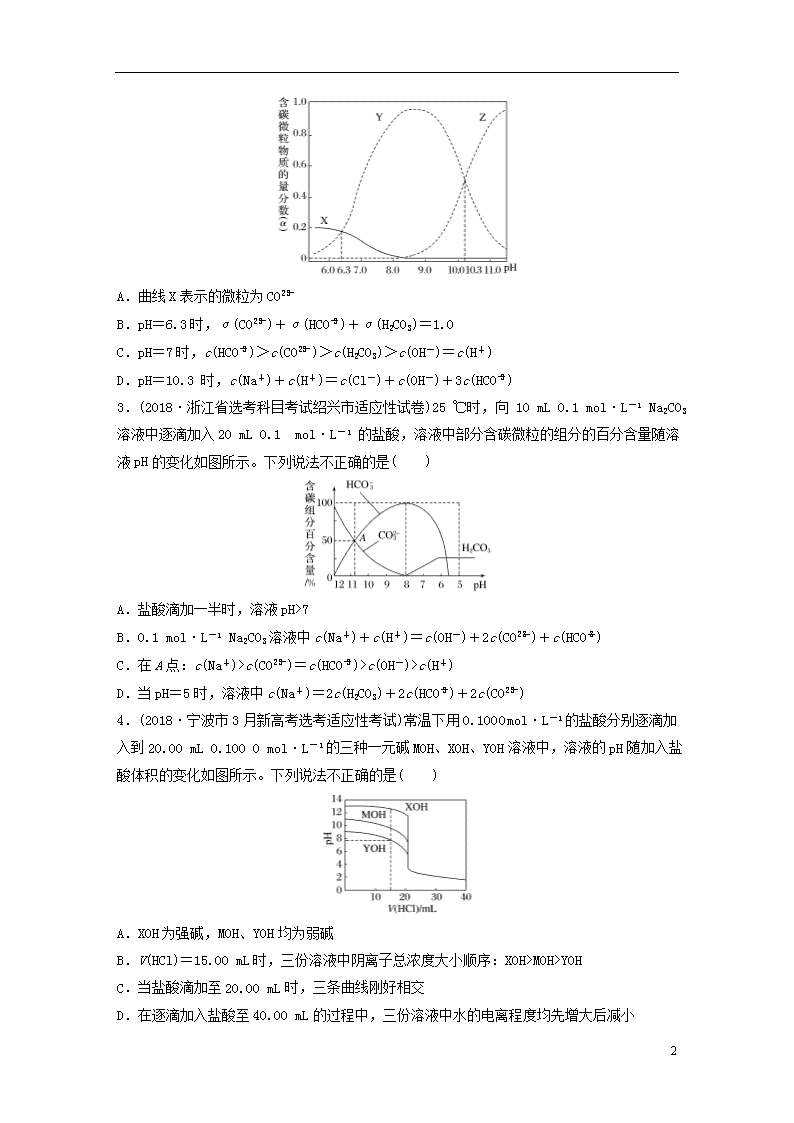
2.(2018·温州市高三选考适应性测试)25 ℃时,一定量的Na2CO3与盐酸混合所得溶液中,部分含碳微粒的物质的量分数(α)与pH的关系如图所示。下列说法正确的是( )
7
A.曲线X表示的微粒为CO
B.pH=6.3时,α(CO)+α(HCO)+α(H2CO3)=1.0
C.pH=7时,c(HCO)>c(CO)>c(H2CO3)>c(OH-)=c(H+)
D.pH=10.3 时,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO)
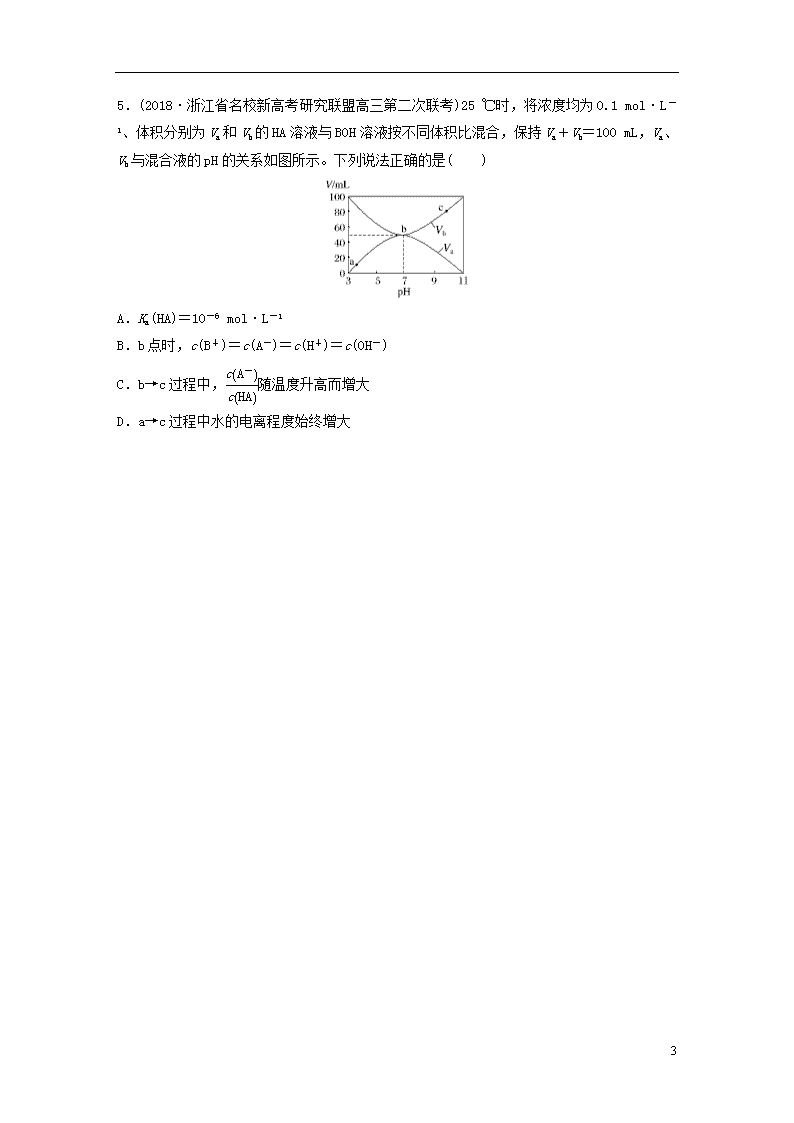
3.(2018·浙江省选考科目考试绍兴市适应性试卷)25 ℃时,向 10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入20 mL 0.1 mol·L-1 的盐酸,溶液中部分含碳微粒的组分的百分含量随溶液pH的变化如图所示。下列说法不正确的是( )
A.盐酸滴加一半时,溶液pH>7
B.0.1 mol·L-1 Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO)+c(HCO)
C.在A点:c(Na+)>c(CO)=c(HCO)>c(OH-)>c(H+)
D.当pH=5时,溶液中c(Na+)=2c(H2CO3)+2c(HCO)+2c(CO)
4.(2018·宁波市3月新高考选考适应性考试)常温下用0.100 0 mol·L-1的盐酸分别逐滴加入到20.00 mL 0.100 0 mol·L-1的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列说法不正确的是( )
A.XOH为强碱,MOH、YOH均为弱碱
B.V(HCl)=15.00 mL时,三份溶液中阴离子总浓度大小顺序:XOH>MOH>YOH
C.当盐酸滴加至20.00 mL时,三条曲线刚好相交
D.在逐滴加入盐酸至40.00 mL的过程中,三份溶液中水的电离程度均先增大后减小
7
5.(2018·浙江省名校新高考研究联盟高三第二次联考)25 ℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )
A.Ka(HA)=10-6 mol·L-1
B.b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C.b→c过程中,随温度升高而增大
D.a→c过程中水的电离程度始终增大
7
6.(2018·嘉兴市高三二模)25 ℃时,SO2与NaOH反应后的溶液中存在含硫微粒H2SO3、HSO和SO,三者中各自所占的物质的量分数随溶液pH变化的关系如图所示。下列说法正确的是( )
A.a表示SO物质的量分数随溶液pH变化的曲线
B.pH=8的溶液中:c(HSO)>c(SO)
C.pH=7的溶液中:c(Na+)=c(HSO)+2c(SO)
D.1 mol·L-1的NaHSO3溶液中存在:c(H2SO3)=c(H+)+c(OH-)+c(SO)
7.(2018·浙江省十校联盟选考3月适应性考试)25 ℃时,体积均为20 mL、浓度均为0.1 mol·L-1的两种酸HX、HY分别与0.1 mol·L-1 的NaOH 溶液反应,所加NaOH溶液体积与反应后溶液的pH关系如图所示。下列叙述正确的是( )
A.加入10 mL NaOH溶液时,a 点c(X-)c(CH3COO-)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)=c(CH3COO-),酸碱恰好完全反应
C.点③所示溶液中:c(OH-)-c(H+)=c(CH3COOH)
D.滴定过程中:c(CH3COO-)+c(CH3COOH)=0.10 mol·L-1
7
答案精析
1.D [A项,根据示意图可知,当溶液的pH=9时,溶液中存在下列关系:c(HCO)>c(NH)>c(NH3·H2O)>c(CO),错误;C项,根据图像可知pH<7.8时,往该溶液中逐滴滴加氢氧化钠,HCO浓度逐渐增大,错误;D项,因为0.1 mol·L-1的NH4HCO3溶液pH=7.8,说明HCO的水解程度大于NH的水解程度,根据越弱越水解的规律可得:Kb(NH3·H2O)>Ka1(H2CO3),正确。]
2.D [A项,X、Y、Z分别代表H2CO3 、HCO 、CO,错误;B项,根据图像可知,pH=6.3时有CO2生成,根据物料守恒可知α(CO)+α(HCO)+α(H2CO3)<1.0 ,错误;C项,pH=7时,由图可知碳酸分子多于碳酸根离子,c(HCO)>c(H2CO3)>c(CO)>c(OH-)=c(H+),错误;D项,pH=10.3 时,溶液中c(HCO)=c(CO),根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(HCO)+2c(CO),代入得c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO),正确。]
3.D [A项,盐酸滴加一半时,也就是10 mL,碳酸钠恰好与盐酸完全反应生成碳酸氢钠和氯化钠,其中碳酸氢钠水解溶液呈碱性,所以溶液的pH>7,正确;B项,Na2CO3溶液中存在电荷守恒,为c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),正确;C项,在A点:n(CO)=n(HCO)=0.000 5 mol时,得到等物质的量的碳酸钠和碳酸氢钠,两者水解溶液呈碱性,所以离子浓度大小为c(Na+)>c(CO)=c(HCO)>c(OH-)>c(H+),正确。]
4.C 5.C
6.C [A项,由图像可知,a表示HSO物质的量分数随溶液pH变化的曲线,错误;B项,a表示HSO物质的量分数随溶液pH变化的曲线,b表示SO物质的量分数随溶液pH变化的曲线,由图像可知,pH=8时的溶液中, c(HSO)b点c(Y-),故A错误;HX是强酸,HY是弱酸,所以酸性HX>HY,故B错误;根据物料守恒,加入40 mL NaOH溶液时,c(Na+)=2c(Y-)+2c(HY),故C错误;b点溶液中含有等浓度的HY和NaY,根据电荷守恒c(Na+)+c(H+)=c(Y-)+c(OH-),根据物料守恒2c(Na+)=c(Y-)+c(HY),所以c(Y-)+2c(OH-)=c(HY)+2c(H+),故D正确。]
8.B [由图可知,在pH=9.0时,c(NH)>c(HCO)>c(NH2COO-)>c(CO
7
),A正确;在氨水体系中不断通入CO2,还有中间产物NH2COO-生成,所以体系中始终存在电荷守恒关系:c(NH)+c(H+)=2c(CO)+c(HCO)+c(OH-)+c(NH2COO-),B错误;随着CO2的通入,NH浓度不断增加,温度不变,反应的平衡常数不变,所以不断减小,C正确;pH=7时,溶液为碳酸氢铵溶液,相互促进水解,水的电离程度最大,D正确。]
9.C [碳酸根的水解程度大于碳酸氢根,因此碳酸根的浓度越大,pH越大。二者浓度相等时,溶液的pH>10,因此pH=10的溶液中:c(HCO)>c(CO),A错误;根据物料守恒可知E点溶液中:c(Na+)>3c(CO),B错误;根据物料守恒c(HCO)+c(CO)+c(H2CO3)=0.100 mol·L-1和电荷守恒c(H+)+c(Na+)=c(OH-)+2c(CO)+ c(HCO)可知pH=11的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(CO)+0.100 mol·L-1,C正确;在E点溶液中加入等体积0.100 mol·L-1的NaOH溶液,碳酸氢钠转化为碳酸钠,溶液体积变大,根据物料守恒可知c(CO)与c(HCO)之和发生变化,D错误。]
10.C [A项,点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1∶1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)<c(CH3COO-),错误;B项,点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),若酸碱恰好完全反应则刚好生成CH3COONa,CH3COONa水解显碱性,所以酸碱不可能恰好完全反应,错误;C项,点③说明两溶液恰好完全反应生成CH3COONa,由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),由物料守恒可知c(CH3COO-)+c(CH3COOH)=c(Na+),电荷守恒和物料守恒相结合可得c(OH-)-c(H+)=c(CH3COOH),正确;D项,滴定过程中,c(CH3COO-)+c(CH3COOH)<0.10 mol·L-1,错误。]
7
相关文档
- 高考备战冲刺指导高中数学必修15知2021-05-138页
- 2016江苏普通高中学业水平测试小高2021-05-1310页
- 河南普通高中新课程高考适应性考试2021-05-1315页
- 2020版高中数学 第一章 统计 12021-05-132页
- 优化方案高中语文人教版必修三学案2021-05-134页
- 2020高中地理 第03天 城市内部空间2021-05-135页
- 新高考湘教版高中必修一地理复习知2021-05-1315页
- 高中地理必修一会考高考易错题2021-05-137页
- 新课标高中生物全套思维导图(适用22021-05-1319页
- 高中数学高考一轮复习正弦定理和余2021-05-135页