- 811.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2010年普通高等学校招生全国统一考试(广东卷)
理科综合(化学试题)
一、单项选择题
7、能在溶液中大量共存的一组离子是
A. NH4+ 、Ag+ 、PO43- 、Cl- B. Fe3+ 、H+ 、I- 、HCO3-
C. K+、Na+、NO3- 、MnO4- D.Al3+ 、Mg2+ 、SO42- 、CO32-
8、设NA 为阿伏加德罗常数的数值,下列说法正确的是
A.16g CH4中含有4 NA个C-H键
B.1mol·L-1 NaCl溶液含有NA个Na+
C.1mol Cu和足量稀硝酸反应产生NA个NO分子
D.常温常压下,22.4LCO2中含有NA个CO2分子
9、在298K、100kPa时,已知:2H2O(g) = O2(g) + 2H2(g) △H1
Cl2(g) + H2(g) = 2HCl(g) △H2
2Cl2(g) + 2H2O(g) = 4HCl(g) + O2(g) △H3
则△H3与△H1和△H2间的关系正确的是
A .△H3 = △H1 + 2△H2 B △H3 = △H1 + △H2
C. △H3 = △H1 - 2△H2 D. △H3 = △H1 - △H2
10、短周期金属元素甲~戊在元素周期表中的相对位置如右表所示:下面判断正确的是
A.原子半径:丙<丁<戊 B金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
11、下列说法正确的是
A.乙烯和乙烷都能发生加聚反应 B.蛋白质水解的最终产物是多肽
C.米酒变酸的过程涉及了氧化反应 D.石油裂解和油脂皂化都有高分子生成小分子的过程
12、HA为酸性略强与醋酸的一元弱酸.在0.1mol·L-1 NaA溶液中,离子浓度关系正确的是
A. c(Na+) > c(A-) > c(H+) > c(OH-) B. c(Na+) > c(OH-) > c(A-) > c(H+)
C. c(Na+) + c(OH-) = c(A-) + c(H+) D. c(Na+) + c(H+) = c(A-) + c(OH-)
二、双项选择题
22、对实验Ⅰ~Ⅳ的实验现象预测正确的是
第6页
A 实验Ⅰ:液体分层,下层呈无色
B 实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液颜色变为红色
D 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
23、铜锌原电池(如右图)工作时,下列叙述正确的是
A 正极反应为:Zn—2e-=Zn2+
B 电池反应为:Zn+Cu2+=Zn2+ +Cu
C 在外电路中,电子从负极流向正极
D 盐桥中的K+移向ZnSO4溶液
三、非选择题
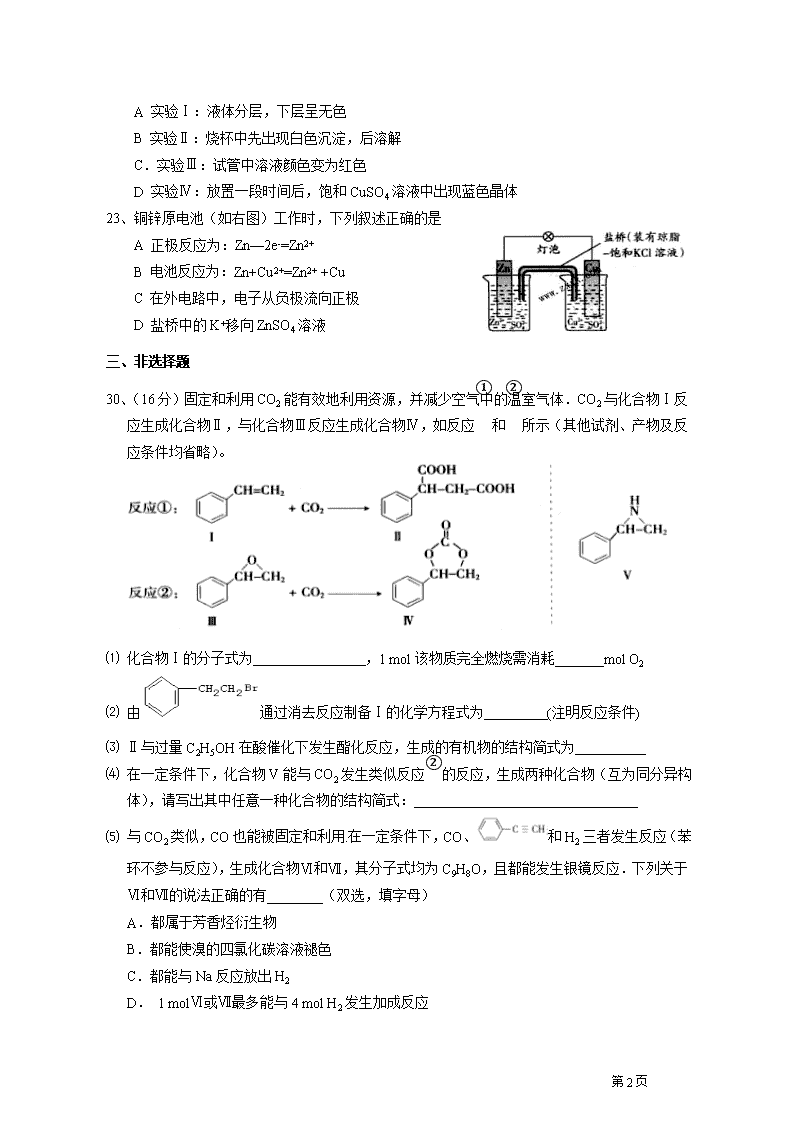
30、(16分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物Ⅲ反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。
⑴ 化合物Ⅰ的分子式为 ,1 mol该物质完全燃烧需消耗_______mol O2
⑵ 由通过消去反应制备Ⅰ的化学方程式为 (注明反应条件)
⑶ Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为
⑷ 在一定条件下,化合物V能与CO2发生类似反应②的反应,生成两种化合物(互为同分异构体),请写出其中任意一种化合物的结构简式:
⑸ 与CO2类似,CO也能被固定和利用.在一定条件下,CO、和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有________(双选,填字母)
A.都属于芳香烃衍生物
B.都能使溴的四氯化碳溶液褪色
C.都能与Na反应放出H2
D. 1 molⅥ或Ⅶ最多能与4 mol H2发生加成反应
第6页
31、(16分)硼酸(H3BO3)在食品、医药领域应用广泛.
⑴ 请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O = 2H3BO3 +
⑵ 在其他条件相同时,反应H3BO3 +3CH3OHB(OCH3)3 +3H2O中,H3BO 3的转化率(α)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
① 温度对应该反应的反应速率和平衡移动的影响是:
。
② 该反应的_____0(填“<”、“=”或“>”)。
⑶ H3BO 3溶液中存在如下反应:
H3BO3 (aq) + H2O (l) ⇌ [B(OH)4]- (aq) + H+ (aq),已知
0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平
衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈ c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
32、(16分)碳酸锂广泛应用于陶瓷和医药等领域。
已β-锂辉石(主要成分为Li2O - Al2O3 - 4SiO2)为原材料制备Li2CO3的工艺流程如下:
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g
⑴ 步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是
⑵ 步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
⑶ 步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有
⑷ 步骤Ⅲ中,生成沉淀的离子方程式为
⑸ 从母液中可回收的主要物质是
第6页
33、(16分)某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
⑴ 请完成SO2与过量NaOH溶液反应的化学方程式:SO2 + 2NaOH = _______________
⑵ 反应Cl2 + Na2SO3 + 2NaOH = 2NaCl + Na2SO4 + H2O中的还原剂为
⑶ 吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:____________
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。
限选实验试剂:3moLL-1H2SO4、1moLL-1NaOH、0.01molL-1KMnO4、淀粉-KI溶液、
紫色石蕊试液。
实验步骤
预期现象和结论
步骤1:取少量吸收液于试管中,滴加3 moLL-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中.
步骤2:
步骤3:
第6页
2010年广东高考理综(化学)参考答案
7、C。A选项Ag+和PO43—、Cl—不能大量共存。B选项Fe3+和I—、HCO3—不能大量共存;H+和HCO3—也不能大量共存;D选项Al3+、Mg2+和CO32—不能大量共存
8、A。A选项16gCH4为1mol,根据甲烷的结构式可知含有4 NA个C-H键。B选项.体积未知。C选项 根据电子守恒可知产生2nA/3个NO分子。D选项 条件应该为标准状况。
9、A。根据盖斯定律可知为A
10、C。A选项 同周期从左往右原子半径逐渐减小,应该为丙>丁>戊。B选项 同主族从上往下金属性逐渐增强 应该为甲<丙。C选项因为金属性丙>丁>戊,故正确。D选项应该为甲<乙。
11、C。A答案乙烷不能发生加聚反应。B答案蛋白质水解的最终产物是氨基酸。C答案米酒部分氧化为乙酸。D答案裂解指把长链的分子烃断裂成各种短链的气态烃和少量液态烃。油脂皂化是指油脂在碱性条件下发生水解,不属于高分子。
12、D。NaA属于强碱弱酸盐,水溶液显碱性,根据电荷守恒可知D答案正确
22、CD。A选项 CCl4密度比水大,在下层,上层为水层呈无色。B选项 沉淀不会溶解。C选项 Fe3+与KSCN结合为血红色。D选项 因为CaO有吸水性。
23、BC。A答案应为负极。D答案盐桥中的K+移向CuSO4溶液
30、(1)C8H8 ,10mol
(2)
(3)
(4)或 利用逆向思维,反应②产物有两种断键方式:则可以得到和CO2。故答案为以上两种。
第6页
(5)AB。化合物Ⅵ和Ⅶ,分子式均为C9H8O,且都能发生银镜反应,反应时苯环不参与反应。结合不饱和度可知:化合物Ⅵ和Ⅶ含有苯环,醛基,碳碳双键。
31、
(1)根据原子守恒可知为:6H2↑
(2)①温度越高反应速度越快,升温平衡向正方向移动;温度越低反应速度越慢,降温平衡向逆方向移动。②反应为吸热:>
(3)根据平衡常数的公式可知:K=5.7×10-10 mol·L-1(可以不写单位)
32、
(1)增加接触面积使反应充分同时加快反应速度。
(2)石灰石。石灰石与酸作用,才可调节溶液的PH值。调节溶液的PH到6.0~6.5,沉淀部分杂质离子,此时Al3+、Fe3+已除去。
(3)Fe2+ ,Mg2+、Ca2+ 。加入适量的H2O2溶液、石灰乳为了把Fe2+ ,Mg2+除去,加入适量Na2CO3溶液为了除去Ca2+ ,过滤后,滤液为LiOH和Li2SO4。蒸发浓缩滤液和加入饱和碳酸钠溶液有利于得到Li2CO3沉淀。
(4)2Li++CO32-=Li2CO3↓ ⑸NaOH、Na2SO4
33、
(1)SO2+2NaOH =Na2SO3+H2O
(2)Na2SO3
(3)只存在ClO— 。步骤2:在A试管中滴加0.01molL-1KMnO4溶液1~2滴,振荡 预期现象和结论:如果溶液颜色褪去,说明有SO32-,则假设1成立,反之则说明没有SO32-,则假设1不成立。步骤3:在B试管中滴加淀粉-KI溶液1~2滴,振荡 预期现象和结论:如果溶液颜色变蓝色,说明有ClO—,则假设3成立。反之则说明没有ClO—,则假设3不成立
第6页
相关文档
- 2020年高考天津卷数学真题试卷(含答2021-05-1310页
- 高考地理一轮复习课时跟踪检测二十2021-05-137页
- 高考地理一轮全程复习方略高效演练2021-05-133页
- 2020版高考地理一轮复习 第5章 第12021-05-136页
- 高考英语全国I卷试题及答案附听力2021-05-1315页
- 高考理综物理新课标全国卷高清2021-05-1312页
- (新课标)天津市2020年高考数学二轮复2021-05-139页
- 高考语文一轮复习对点训练 文言文2021-05-136页
- 2020年高考生物模拟试题精编(一)2021-05-138页
- 2014年版高考生物专题目三细胞的生2021-05-136页