- 776.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
提升训练 11 电化学原理及其应用
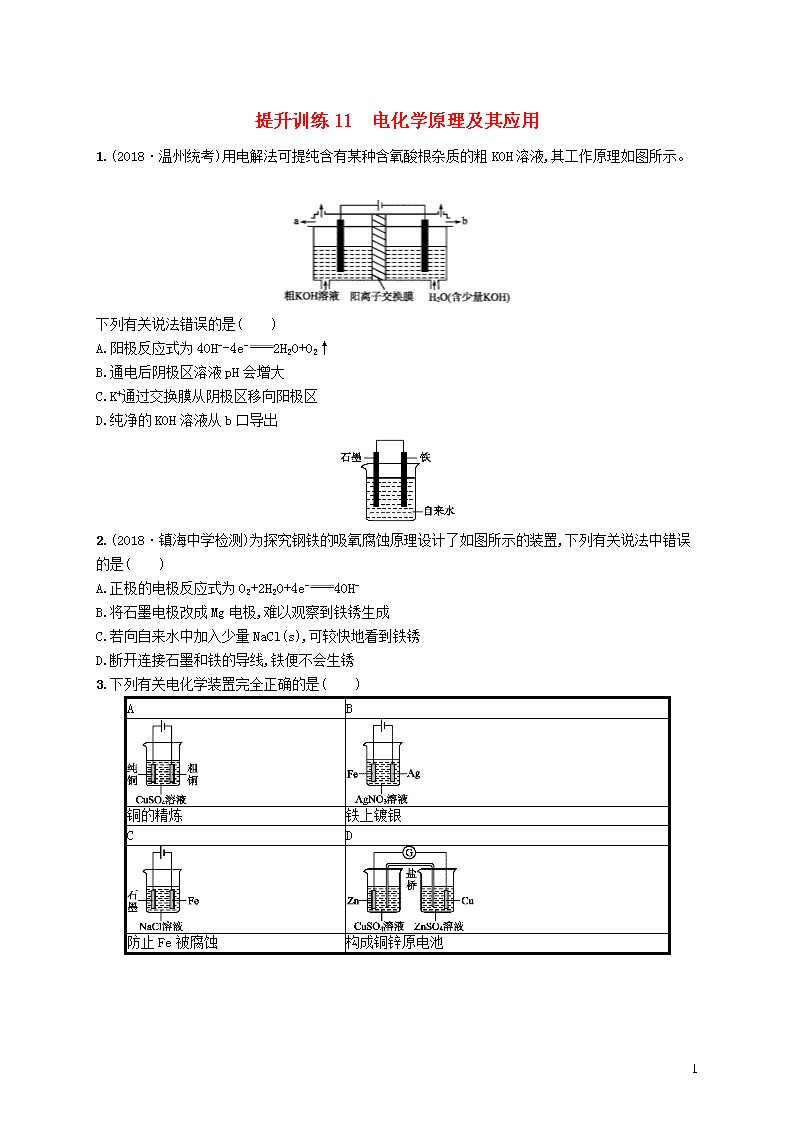
1.(2018·温州统考)用电解法可提纯含有某种含氧酸根杂质的粗 KOH 溶液,其工作原理如图所示。
下列有关说法错误的是( )
A.阳极反应式为 4OH--4e- 2H2O+O2↑
B.通电后阴极区溶液 pH 会增大
C.K+通过交换膜从阴极区移向阳极区
D.纯净的 KOH 溶液从 b 口导出
2.(2018·镇海中学检测)为探究钢铁的吸氧腐蚀原理设计了如图所示的装置,下列有关说法中错误
的是( )
A.正极的电极反应式为 O2+2H2O+4e- 4OH-
B.将石墨电极改成 Mg 电极,难以观察到铁锈生成
C.若向自来水中加入少量 NaCl(s),可较快地看到铁锈
D.断开连接石墨和铁的导线,铁便不会生锈
3.下列有关电化学装置完全正确的是( )
A B
铜的精炼 铁上镀银
C D
防止 Fe 被腐蚀 构成铜锌原电池
2
4.(2018·严州中学模拟)高铁酸盐在能源、环保等方面有着广泛的用途。高铁酸钾(K2FeO4)不仅是
一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置,下列说
法不正确的是( )
A.该电池放电时正极的电极反应式为 Fe +4H2O+3e- Fe(OH)3+5OH-
B.若维持电流强度为 1 A,电池工作 10 min,理论上消耗 0.2 g Zn(已知 F=96 500 C· mol-1)
C.盐桥中盛有饱和 KCl 溶液,此盐桥中氯离子向右池移动
D.若用阳离子交换膜代替盐桥,则钾离子向右移动
5.下列各组中,每种电解质溶液在惰性电极条件下电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2 B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2 D.NaBr、H2SO4、Ba(OH)2
6.(2018·普陀中学检测)用 NaOH 溶液吸收烟气中的 SO2,将所得的 Na2SO3 溶液进行电解,可循环再
生 NaOH,同时得到 H2SO4,其原理如图所示(电极材料为石墨),下列说法不正确的是( )
A.图中 a 极要连接电源的负极
B.C 口流出的物质是硫酸
C.S 放电的电极反应式为 S -2e-+H2O S +2H+
D.B 口附近溶液的碱性减弱
7.(2018·浙江十校联考)最近一家瑞典公司发明了一种新型充电器“PowerTrekk”,仅仅需要一勺
水,它便可以产生维持 10 小时手机使用的电量。其反应原理为 Na4Si+5H2O 2NaOH+Na2SiO3+4H2↑,
则下列说法正确的是( )
A.该电池可用晶体硅作电极材料
B.Na4Si 在电池的负极发生还原反应,生成 Na2SiO3
C.电池正极发生的反应为 2H2O+2e- H2↑+2OH-
D.当电池转移 0.2 mol 电子时,可生成标准状况下 1.12 L H2
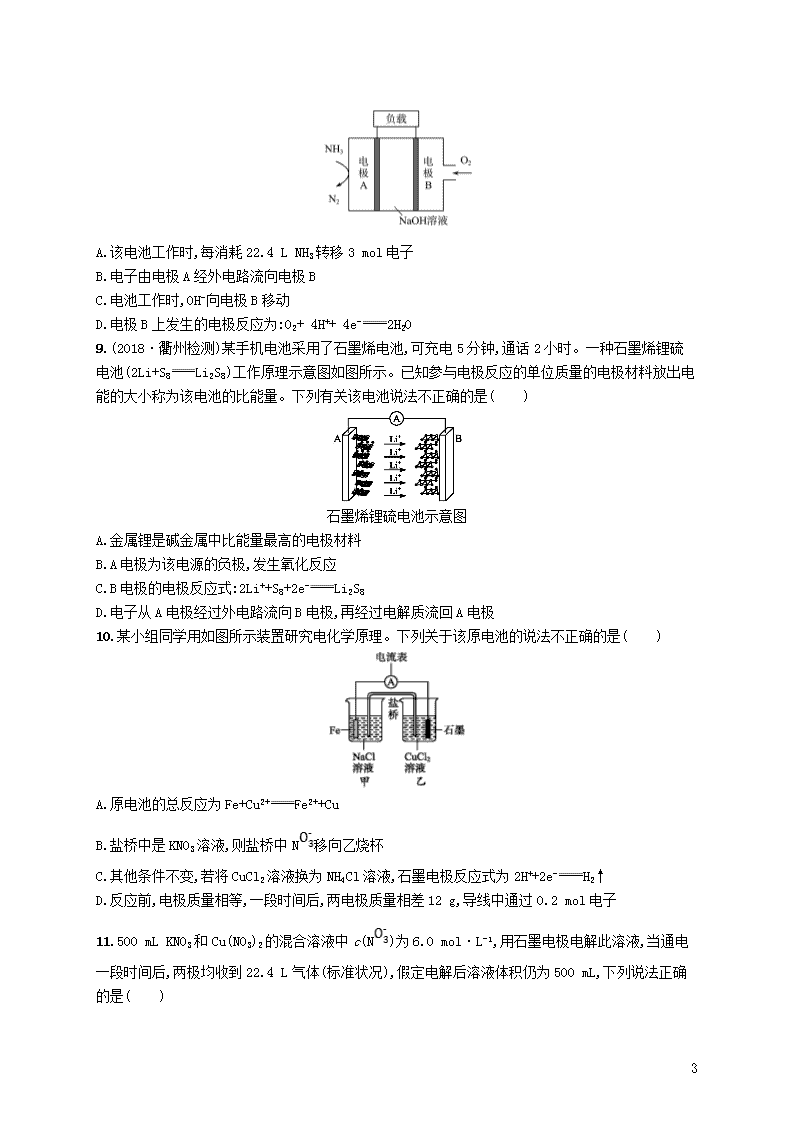
8.一种用于驱动潜艇的液氨—液氧燃料电池的工作原理示意如图,下列有关该电池说法正确的是
( )
3
A.该电池工作时,每消耗 22.4 L NH3 转移 3 mol 电子
B.电子由电极 A 经外电路流向电极 B
C.电池工作时,OH-向电极 B 移动
D.电极 B 上发生的电极反应为:O2+ 4H++ 4e- 2H2O
9.(2018·衢州检测)某手机电池采用了石墨烯电池,可充电 5 分钟,通话 2 小时。一种石墨烯锂硫
电池(2Li+S8 Li2S8)工作原理示意图如图所示。已知参与电极反应的单位质量的电极材料放出电
能的大小称为该电池的比能量。下列有关该电池说法不正确的是( )
石墨烯锂硫电池示意图
A.金属锂是碱金属中比能量最高的电极材料
B.A 电极为该电源的负极,发生氧化反应
C.B 电极的电极反应式:2Li++S8+2e- Li2S8
D.电子从 A 电极经过外电路流向 B 电极,再经过电解质流回 A 电极
10.某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是( )
A.原电池的总反应为 Fe+Cu2+ Fe2++Cu
B.盐桥中是 KNO3 溶液,则盐桥中 N 移向乙烧杯
C.其他条件不变,若将 CuCl2 溶液换为 NH4Cl 溶液,石墨电极反应式为 2H++2e- H2↑
D.反应前,电极质量相等,一段时间后,两电极质量相差 12 g,导线中通过 0.2 mol 电子
11.500 mL KNO3 和 Cu(NO3)2 的混合溶液中 c(N )为 6.0 mol·L-1,用石墨电极电解此溶液,当通电
一段时间后,两极均收到 22.4 L 气体(标准状况),假定电解后溶液体积仍为 500 mL,下列说法正确
的是( )
4
A.原混合溶液中 c(K+)为 4 mol·L-1
B.电解后加入 1 mol Cu(OH)2 可使溶液复原
C.电解后溶液中 c(H+)为 8 mol·L-1
D.原溶液中 c(Cu2+)为 1 mol·L-1
12.CH4 可用于设计燃料电池,甲烷燃料电池的工作原理如图所示:原电池工作过程中 OH-的作用
是 ;负极电极反应式为 。
若电路中转移电子数为 0.8NA,左侧溶液 pH (填“增大”“减小”或“不变”)(忽略溶液体
积的变化),右侧的 OH-物质的量变化量为 。
13.Ⅰ.钢铁的电化学腐蚀原理,在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀。
(1)写出图中石墨电极的电极反应式: 。
(2)将该装置作简单修改即可成为钢铁电化学防护的装置,请在图中虚线框内所示位置作出修改,并
用箭头标出导线中电子移动方向。
Ⅱ.电化学原理在化学工业中有广泛的应用,请根据如图回答问题。
(1)装置 A 中的 Y 电极为 极,X 电极的电极反应式为 ,工作一段时
间后,电解质溶液的 pH 将 (填“增大”“减小”或“不变”)。
(2)若装置 B 中 a 为石墨电极、b 为铁电极,W 为饱和食盐水(滴有几滴酚酞溶液),则铁电极的电极
反应式为
。
电解一段时间后若要恢复原溶液的成分和浓度,应该采用 的办法。
(3)若利用装置 B 进行铜的精炼,则 a 电极的材料为 ,工作一段时间后装置 B 电解液中
c(Cu2+)将 (填“增大”“减小”或“不变”)。
(4)若装置 B 中 a 为 Ag 棒,b 为铜棒,W 为 AgNO3 溶液,工作一段时间后发现铜棒增重 2.16 g,则流经
电路的电子的物质的量为 。
5
参考答案
提升训练 11 电化学原理及其应用
1.C A 项,阳极 OH-放电,正确;B 项,阴极电极反应式为 2H++2e- H2↑,故 c(OH-)增大,pH 增大,
正确;C 项,电解时阳离子移向阴极,错误;D 项,阳极区的 K+透过阳离子交换膜移向阴极区,与阴极区
的 OH-结合成 KOH,正确。
2.D A 项,吸氧腐蚀的正极反应式为 O2+4e-+2H2O 4OH-,正确;B 项,若把石墨电极改为 Mg 电
极,此时 Mg 作负极,铁不会失电子,不会有铁锈生成,正确;C 项,若向自来水中加入少量 NaCl(s),溶
液中离子浓度增大,腐蚀变快,正确;D 项,若断开连接石墨和铁的导线,因铁中含有杂质,仍会发生腐
蚀,错误。
3.C A 项,电解精炼铜时,应该用粗铜作阳极,纯铜作阴极,错误;B 项,铁上镀银时,应该用银作
阳极,铁作阴极,错误;C 项,该项是外加电流的阴极保护法,正确;D 项,铜锌原电池中,锌应插入
ZnSO4 溶液中,铜应插入 CuSO4 溶液中,错误。
4.D A 项,根据电池装置,Zn 作负极,C 为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还
原反应生成 Fe(OH)3,正极电极反应式为 Fe +4H2O+3e- Fe(OH)3+5OH-,正确;B 项,若维持电
流强度为 1 A,电池工作 10 min,通过电子为 ,则理论上消耗 Zn 的质量为
×65 g· mol-1≈0.2 g,正确;C 项,盐桥中阴离子向负极移动,盐桥起的作
用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷、构成闭合回路的作用,放电
时盐桥中氯离子向右池移动,正确;D 项,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向
左移动,错误。
5.C 电解 HCl 溶液生成氢气和氯气,电解 CuCl2 溶液生成 Cu 和氯气,电解 Ba(OH)2 溶液生成氢
气和氧气,故 A 不选;电解 NaOH 溶液生成氢气和氧气,电解 CuSO4 溶液生成 Cu、氧气、硫酸,电解
H2SO4 溶液生成氢气和氧气,故 B 不选;电解 NaOH 溶液、H2SO4 溶液、Ba(OH)2 溶液,均只生成氢气和
氧气,故 C 选;电解 NaBr 溶液生成溴、氢气、NaOH,电解 H2SO4 溶液生成氢气和氧气,电解 Ba(OH)2 溶
液生成氢气和氧气,故 D 不选。
6.D 根据 Na+、S 的移向判断阴、阳极。Na+移向阴极区,a 极应接电源负极,b 极应接
电源正极,其电极反应式分别为
阳极:S -2e-+H2O S +2H+
阴极:2H2O+2e- H2↑+2OH-
6
所以从 C 口流出的是 H2SO4,在阴极区由于水中的 H+放电,破坏水的电离平衡,c(H+)减小,c(OH-)
增大,生成 NaOH,碱性增强,从 B 口流出的是浓度较大的 NaOH 溶液。
7.C 该电池工作时生成氢氧化钠溶液,而硅可以与氢氧化钠反应,所以不能用晶体硅作电极材
料,A 不正确;Na4Si 在电池的负极发生氧化反应,B 不正确;电池正极的电极反应式为 2H2O+2e-
H2↑+2OH-,C 正确;当电池转移 0.2 mol 电子时,可生成标准状况下 2.24 L H2,D 不正确。
8.B 温度、压强未知,无法计算 22.4 L NH3 的物质的量,A 错误;该电池中通入氧气的电极 B
为正极,电极 A 为负极,电子由电极 A 经外电路流向电极 B,B 正确;电池工作时,OH-向负极移动,C 错
误;该电池电解质溶液显碱性,电极 B 上发生的电极反应为 O2+ 2H2O+ 4e- 4OH-,D 错误。
9.D 石墨烯锂硫电池的电极总反应式为 2Li+S8 Li2S8,Li 失电子发生氧化反应,Li 是负极材
料。A 项,金属锂的摩尔质量小,单位质量的 Li 放出电能明显比其他碱金属大,正确;B 项,电池内部
阳离子向正极移动,则 A 电极为该电源的负极,发生氧化反应,正确;C 项,B 为电源的正极,发生的电
极反应式为 2Li++S8+2e- Li2S8,正确;D 项,原电池的外电路中有电子转移,而电池的内部只有阴、
阳离子的移动,没有电子的移动,错误。
10.B A 项,根据图示可知,在该原电池中,负极是 Fe,电极反应式为 Fe-2e- Fe2+,石墨为正极,
正极上的电极反应式为 Cu2++2e- Cu,正、负极电极反应式相加得 Fe+Cu2+ Fe2++Cu,正确;B 项,
盐桥中是 KNO3 溶液,则根据同种电荷相互排斥,异种电荷相互吸引的原则,盐桥中 N 移向正
电荷较多的甲烧杯,错误;C 项,其他条件不变,若将 CuCl2 溶液换为 NH4Cl 溶液,由于溶液中阳离子获
得电子的能力:H+>N ,石墨电极上的正极反应式为 2H++2e- H2↑,正确;D 项,反应前,电极
质量相等,由于阳极发生反应 Fe-2e- Fe2+,每转移 2 mol 电子,负极减少质量 56 g,在正极发生反
应 Cu2++2e- Cu,质量增加 64 g,两个电极质量相差 120 g,则电解一段时间后,两电极质量相差 12
g,则导线中通过电子的物质的量为(12÷120)×2 mol=0.2 mol,正确。
11.B 电解 KNO3 和 Cu(NO3)2 的混合溶液,阳极上的电极反应式:4OH--4e 2H2O+O2↑,当产生
22.4 L 即 1 mol(标准状况)氧气时,转移电子 4 mol,阴极上先发生电极反应:Cu2++2e- Cu,然后
是:2H++2e- H2↑,在阴极上生成 1 mol 氢气时,转移电子是 2 mol,所以铜离子共得到 2 mol 电子,
所以铜离子的物质的量为 1 mol,c(Cu2+)=2 mol·L-1。根据 c(Cu2+)=2 mol·L-1,可知 Cu(NO3)2 的浓
度是 2 mol·L-1,其中的 c(N )=4.0 mol·L-1,又因原混合溶液中 c(N )=6.0 mol·L-1,
所以原混合溶液中硝酸钾的浓度是 2 mol·L-1,所以 c(K+)为 2 mol·L-1,A 错误;根据出来什么补什
么的原则,电解产物是 1 mol Cu、1 mol O2 和 1 mol H2,相当于 1 mol Cu(OH)2 的组成,电解后加入
1 mol Cu(OH)2 可使溶液复原,B 正确;阳极上的电极反应式:4OH--4e- 2H2O+O2↑,当产生 22.4 L
即 1 mol(标准状况)氧气时,转移电子 4 mol,消耗氢氧根离子 4 mol,阴极上发生了电极反应
2H++2e- H2↑,在阴极上生成 1 mol 氢气时,转移电子 2 mol,消耗氢离子 2 mol,所以电解后溶液中,
如果忽略体积变化,则 c(H+)= =4 mol·L-1,C 错误;结合分析可知原溶液里 c(Cu2+)=2
mol·L-1,D 错误。
7
12.答案: 参与电极反应,定向移动形成电流 CH4-8e-+10OH- C +7H2O 不变 0.2
mol
解析: 甲烷失去电子转化为 CO2,CO2 结合氢氧根生成碳酸根,则氢氧根的作用是参与电极反应,
定向移动形成电流;负极通入甲烷,电极反应式为 CH4-8e-+10OH- C +7H2O。若电路中转移
电子数为 0.8NA,正极消耗氧气 0.2 mol,生成氢氧根 0.8 mol,由于生成的氢氧根向负极移动,所以
左侧溶液 pH 不变。根据负极电极反应式可知右侧甲烷消耗 1 mol 氢氧根,所以右侧的 OH-物质的量
变化量为 1 mol-0.8 mol=0.2 mol。
13.答案: Ⅰ.(1)O2+2H2O+4e- 4OH-
(2)
Ⅱ.(1)正 H2+2OH--2e- 2H2O 减小
(2)2H++2e- H2↑ 通入适量 HCl
(3)粗铜 减小
(4)0.02 mol
解析: Ⅰ.(1)电解质溶液为 NaCl 溶液,呈中性,钢铁发生吸氧腐蚀。负极上铁失电子发生氧化
反应,正极上氧气得电子发生还原反应,电极反应式为 O2+2H2O+4e- 4OH-。
(2)Fe 作电解池的阴极可被保护,所以给该装置加外接电源,应使负极与铁相连,电子从电源的
负极流向铁,其图为 。
Ⅱ.(1)装置 A 为氢氧燃料电池,燃料在负极发生氧化反应:H2+2OH--2e- 2H2O;因反应消耗 OH-
且生成水,导致电解质溶液 pH 减小。(2)根据图知,Y 是正极,b 是阴极,电解饱和食盐水时,阴极上
氢离子放电生成氢气:2H++2e- H2↑,因为电解过程中放出氢气和氯气,所以要恢复原溶液的成分和
浓度,应通入适量的 HCl。
(3)电解法精炼铜时,粗铜为阳极,精铜为阴极,所以阳极材料是粗铜;阳极上失电子变成离子进
入溶液,因作阳极的粗铜中的铜和比铜活泼的金属都失去电子进入溶液,阴极溶液中 Cu2+得到电子沉
积在阴极上,所以,电解一段时间后,溶液中铜离子浓度减小。(4)构成的装置为电镀装置,铜棒增重
2.16 g,为析出 Ag 的质量,则 n(Ag)= =0.02 mol,故流经电路的电子的物质的量为
0.02 mol。
相关文档
- 2020高考地理 选考 区域地理 第6课2021-05-135页
- 2019高考语文模拟冲刺卷2021-05-138页
- 2019高考物理一轮复习 第六章 第12021-05-132页
- 高考物理 模拟新题精选分类解析第2021-05-139页
- 高考病句典型归类练习题2021-05-1329页
- 2020版高考地理一轮复习第8章第202021-05-136页
- 2020版高考政治一轮复习(A版)专题十 2021-05-134页
- 高考高三物理实验计算试题每日一练2021-05-135页
- 2014年版高考生物坐标曲线与直方图2021-05-136页
- 2020版高考地理一轮复习第10章第242021-05-132页