- 113.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019高考化学一轮复习模拟试卷3
化 学
注意事项:
1.答卷前,考生务必检查试卷、答题卡是否完整。
2.本卷共100分,考试时间60分钟。
3.考试结束后,将本试卷和答题卡一并交回。
第Ⅰ卷
Be:9 C:12 N:14 O:16 F:19 Na:23 Mn:55 Ba:137
一、选择题:本题共7个小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活、环境、科技等密切相关。下列说法不正确的是 ( )
A. 温室效应导致海水的酸度增加,贝壳类生物的生存将会受到威胁
B. 油脂的主要成分是高级脂肪酸甘油酯,长时间放置的油脂会因水解而变质
C. 石墨烯弹性气凝胶制成的轻质“碳海绵”可用作处理海上原油泄漏的吸油材料
D. 具有吸水性的植物纤维加工后可用作食品干燥剂
8.NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 在0.1mol/L碳酸钠溶液中阴离子总数大于0.1NA
B. 在铜与硫的反应中,1mol铜失去电子数2NA
C. 31g白磷分子中,含有的共价单键数目是NA
D. 向含0.1mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀恰好完全溶解,消耗的0H- 数为0.5NA
9.以物质a为原料,制备物质d (金刚烷)的合成路线如下图所示
关于以上有机物说法中错误的是( )
A. 物质b的分子式为C10H12 B. 物质a最多有10个原子共平面
C. 物质c与物质d互为同分异构体 D. 物质d的一氯代物有2种
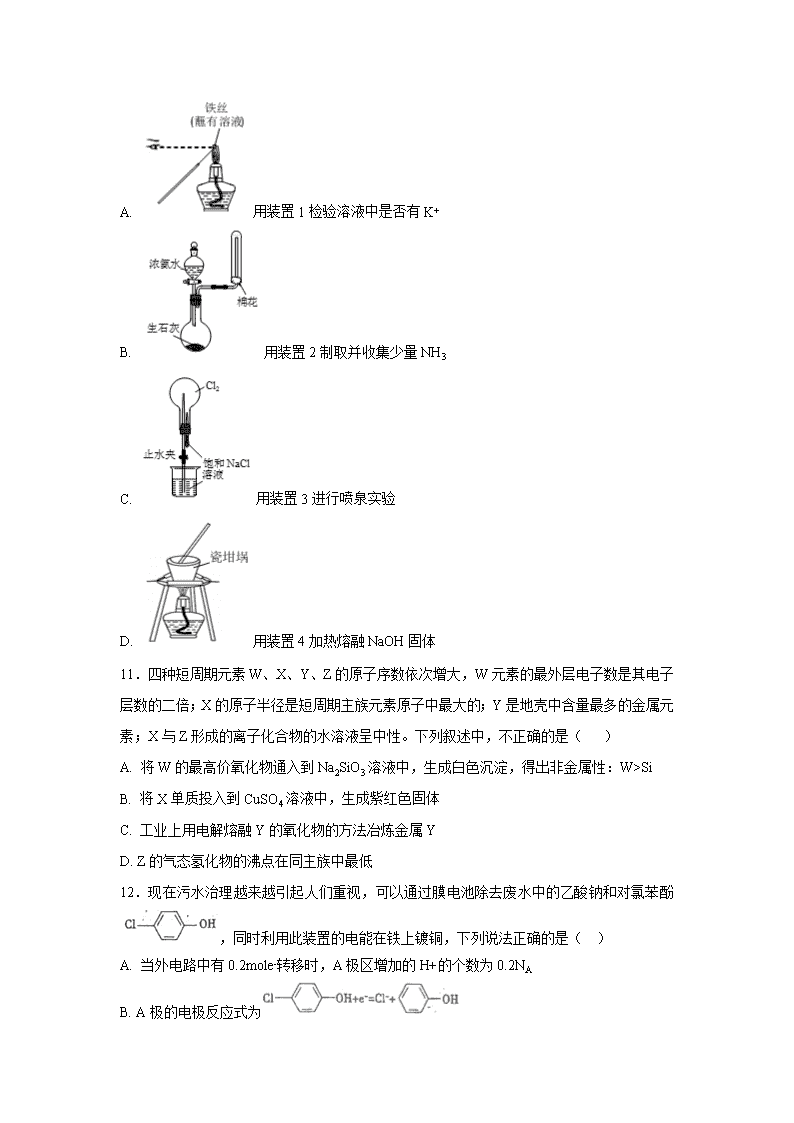
10.用下列实验装置进行相应实验。能达到实验目的是(夹持装置未画出) ( )
A. 用装置1检验溶液中是否有K+
B. 用装置2制取并收集少量NH3
C. 用装置3进行喷泉实验
D. 用装置4加热熔融NaOH固体
11.四种短周期元素W、X、Y、Z的原子序数依次增大,W元素的最外层电子数是其电子层数的二倍;X的原子半径是短周期主族元素原子中最大的;Y是地壳中含量最多的金属元素;X与Z形成的离子化合物的水溶液呈中性。下列叙述中,不正确的是( )
A. 将W的最高价氧化物通入到Na2SiO3溶液中,生成白色沉淀,得出非金属性:W>Si
B. 将X单质投入到CuSO4溶液中,生成紫红色固体
C. 工业上用电解熔融Y的氧化物的方法冶炼金属Y
D. Z的气态氢化物的沸点在同主族中最低
12.现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
A. 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.2NA
B. A极的电极反应式为
C. 铁电极应与Y相连接
D. 反应过程中甲中右边区域溶液pH逐渐升高
13.25℃,向20mL 0.1mol·L—1MOH溶液中滴加0.1mol·L—1 CH3COOH溶液, 所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是( )
A. MOH是弱碱,其Kb =1.0×10—21
B. b点溶液中,c(CH3COO—)+ c(CH3COOH)=0.1 mol·L—1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO—)>c(M+)>c(H+)>c(OH—)
第Ⅱ卷
二、非选择题:本卷包括必考题和选考题两部分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。
26.为了测定含氰废水中CN-的含量,某化学小组利用如图所示装置进行实验。关闭活塞a,将100 mL含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应后,打开活塞b,滴入稀硫酸,然后关闭活塞b。
已知装置B中发生的主要反应为:CN-+ClO-===CNO-+Cl-、2CNO-+2H++3ClO-===N2↑+2CO2↑+3Cl-+H2O;副反应为:Cl-+ClO-+2H+===Cl2↑+H2O。
(1)装置D的作用是_________________________________________________________。
(2)反应过程中,装置C中的实验现象为______________________________________。
(3)待装置B中反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是___________。
(4)反应结束后,装置C中生成59.1 mg沉淀,则废水中c(CN-)=________mol·L-1。
(5)对上述实验装置进行合理改进后,可通过直接测量装置C反应前后的质量变化,测定废水中CN-的含量。合理改进的实验方案为____________________。(仪器自选;可供选择的试剂:浓硫酸、NaOH溶液、饱和食盐水、饱和NaHCO3溶液、CCl4)
(6)利用如图所示装置可以除去废水中的CN-,控制溶液pH为5.2~6.8时,CN-转化为C2O和NH。
①NH的电子式为__________。
②气体a为____________(填化学式)。
③阳极的电极反应式为_________________________________________________。
27.一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作 。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为 。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1.准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2.然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是___________;
产品中MnO2的质量分数为ω(MnO2)= (列出计算的表达式即可)。
28.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1则CO还原Fe2O3(s)的热化学方程式为_________ 。
分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2(g) +3H2(g)CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见下图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器
甲
乙
反应物投入量
1 mol CO2、3 mol H2
a mol CO2、b mol H2
c mol CH3OH(g)、c mol H2O(g)
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________。
35.【化学-选修3:物质结构与性质】(15分)
稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____区,基态原子价电子排布图为 。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为______, lmol CH2=CH2中含有的σ键数目为______。常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是
(4)与N3-互为等电子体的分子有________________(写两个化学式)。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为 ,列式表示Ce(铈)单质的密度: g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
36.【化学一选修5:有机化学基础】(15分)
以芳香化合物A和有机物D为原料,制备异戊酸薄荷醇酯(M)和高聚物(N)的一种合成路线如下:
已知:I.A→B的原子利用率为100%。
Ⅱ.(R1、R2表示氢原子或烃基)
请回答下列问题:
(1)A的结构简式为___________。
(2)D的化学名称为___________。
(3)G的核磁共振氢谱中有___________组吸收峰。
(4)F→H的反应类型为_______________________。
(5)C+G→M的化学方程式为_____________________________________________。
(6)同时满足下列条件的B的同分异构体有___________种(不考虑立体异构)。
①苯环上连有两个取代基
②能发生银镜反应
(7)参照上述合成路线和信息,以乙烯为原料(无机试剂任选),设计制备的合成路线:_____________________________________________________________________。
2019高考化学一轮复习模拟试卷3
7.B
8.D
9.B
10.B
11.B
12.C
13.D
26.(1)防止空气中的CO2进入装置C
(2)有白色沉淀生成,溶液的红色逐渐褪去
(3)将反应产生的CO2全部排入装置C并被Ba(OH)2溶液完全吸收
(4)0.003
(5)在装置B、C之间依次连接盛有CCl4和浓硫酸的洗气瓶
(6)①略②H2③2CN-+4H2O-2e-===C2O+2NH
27. (1)4mol 2MnO2+4NaOH+O22Na2MnO4+2H2O
(2) 煅烧后固体进行粉碎,适量增大水的量 适当提高浸取温度,充分搅拌
(3) MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH
(2) 2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去
(5) ×100%
28.(1)Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H =-28.5 kJ·mol-1
(2)CO + 4OH-― 2e-=CO32-+ 2H2O
(3)①> ②0.4<c≤1
(4)II>III>I
(5)①300℃~400℃ ②3Cu2Al2O4+32H++2NO3-=6Cu2++ 6Al3++2NO↑+16 H2O
35. d 共价键和配位键 sp3 3.01×1024或5NA 二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高 N2O、CO2、CS2、BeF2等 12 或
36. 2-甲基丙醛 4 取代反应(或酯化反应) +H2O 15 CH2=CH2CH3CH2OHCH3CHO
相关文档
- 志鸿优化系列赢在高考高考地理一轮2021-05-138页
- 2020版高考地理一轮复习 专题五 人2021-05-1311页
- 2020版高考地理一轮复习 专题一 地2021-05-134页
- 高考数学文一轮复习单元测试配高考2021-05-136页
- 2019高考英语词汇综合检测072021-05-137页
- 2011年高考大纲词汇表2021-05-13159页
- 2020版高考物理二轮复习 选考题152021-05-134页
- 2017高考物理精做33电磁感应与动力2021-05-1322页
- 2020高考化学第一轮复习 专题 化学2021-05-135页
- 2019高考语文复习题点八语言文字运2021-05-134页