- 868.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考总复习 《氯》
【考纲要求】
1.了解Cl2的分子结构和物理性质,掌握Cl2的制备和用途。
2.掌握Cl2与金属、非金属、水、碱等发生的反应。
3.掌握氯水的成分和性质,知道次氯酸及其盐的性质和用途。
4.以卤素为例了解在周期表中同一主族元素性质的递变规律。
5.通过实验掌握Cl―的检验方法。
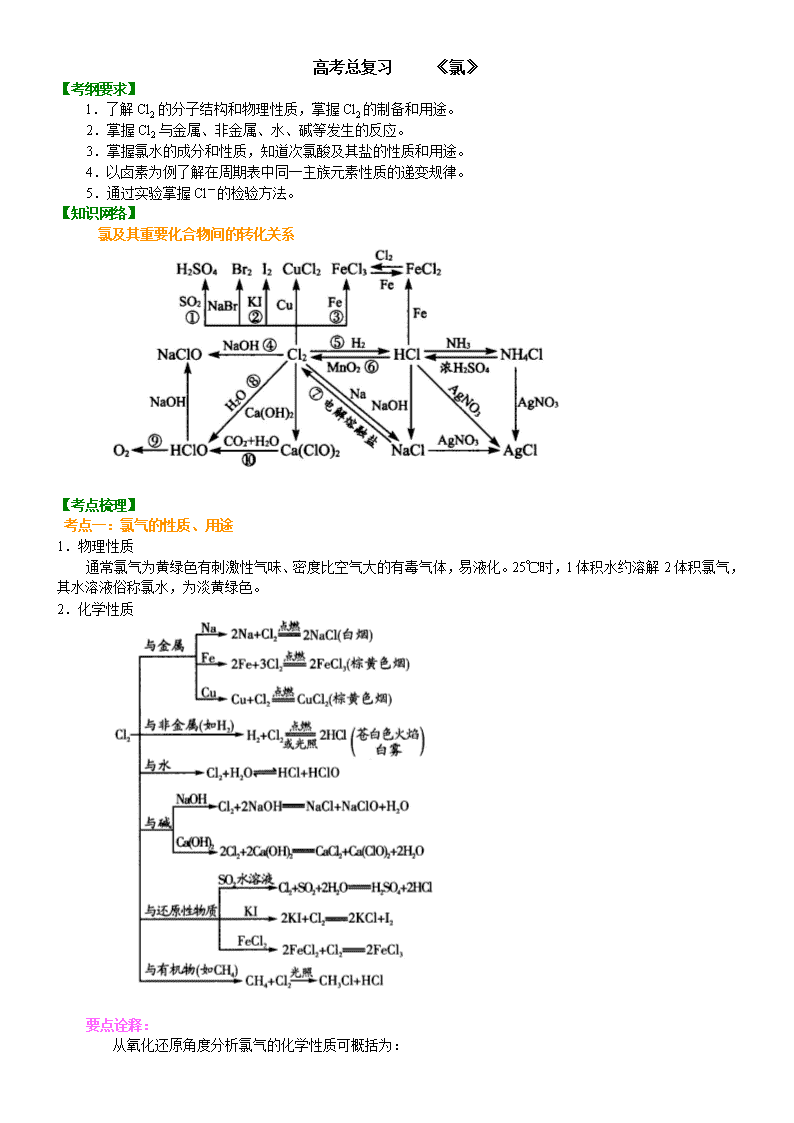
【知识网络】
氯及其重要化合物间的转化关系
【考点梳理】
考点一:氯气的性质、用途
1.物理性质
通常氯气为黄绿色有刺激性气味、密度比空气大的有毒气体,易液化。25℃时,1体积水约溶解2体积氯气,其水溶液俗称氯水,为淡黄绿色。
2.化学性质
要点诠释:
从氧化还原角度分析氯气的化学性质可概括为:
① 化性:0→—1
②氧化还原性(歧化反应):-1←0→+1
3.氯气的用途:自来水的消毒,制盐酸,漂白粉,农药,氯仿等。
4.Cl―的检验
检验溶液中的Cl―应先加稀硝酸酸化,再加入AgNO3溶液,有白色沉淀产生,证明有Cl―存在。
考点二:氯离子的检验
1.试剂:稀硝酸、AgNO3溶液。
2.操作:取待测液2mL加入试管中,先滴入少量稀硝酸,然后再滴入AgNO3溶液。
3.现象及结论:产生白色沉淀,该溶液中含有Cl-。
4.原理:Ag++Cl-==AgCl↓。
要点诠释:
(1)加稀硝酸的目的是排除CO32-的干扰,因为Ag2CO3是可以溶于稀硝酸的白色不溶物。因此,鉴定时可以将加试剂的顺序颠倒,即可以先加AgNO3,再加稀硝酸。若生成不溶于稀硝酸的白色沉淀,同样可以证明溶液中有Cl-。
(2)不用稀盐酸、稀硫酸酸化,否则引入Cl-、SO42-产生干扰。
考点三:氯水的成分和性质
1.氯水的成分
Cl2溶于水:Cl2+H2OH++Cl―+HClO
2.性质
成分
表现的性质
反应实例
Cl2
①强氧化性
②氯水呈黄绿色
③加成反应
Cl2+2KI==2KCl+I2
Cl2+H2SO3+H2O==H2SO4+2HCl
Cl2+CH2=CH2—→CH2Cl—CH2Cl
H+
强酸性
2H++CaCO3==Ca2++CO2↑+H2O
滴入紫色石蕊试液先变红,后褪色
HClO
①弱酸性
②强氧化性
HClO+OH―==ClO―+H2O
漂白、杀菌、消毒
Cl―
沉淀反应
Cl―+Ag+==AgCl↓
2.分析平衡: Cl2+H2OH++Cl―+HClO
向氯水中加入的物质
浓度变化
平衡移动的方向
应用
可溶性氯化物
c (Cl―)增大
左移
①用饱和食盐水除Cl2中的HCl
②用排饱和食盐水法收集Cl2
盐酸
c (H+)和c (Cl―)增大
左移
浓氯酸与浓盐酸反应制Cl2
NaOH
c (H+)减小
右移
用NaOH吸收多余的Cl2
光照
c (HClO)减小
右移
氯水应避光保存或现用现配
要点诠释:
氯水久置,会因HClO的分解导致其中的Cl2全部与H2O反应,HClO完全分解成盐酸和O2,使溶液酸性增强,失去强氧化性而变质(久置氯水实为极稀的盐酸)。
考点四:几种重要的含氯化合物
1.次氯酸
(1)弱酸性:Ca(ClO)2+CO2+H2O= CaCO3+2HClO;酸性:碳酸强于次氯酸。
(2)不稳定性:反应方程式:2HClO2HCl↑+O2↑。
(3)强氧化性:氧化性比Cl2强,可用于自来水的杀菌消毒,还可以用作漂白剂。
2.次氯酸盐
(1)强氧化性:ClO―有强氧化性,与还原性离子(S2―、I―、Fe2+、SO32―等)不能共存。
(2)ClO-的水解:其离子方程式为:ClO―+H2OHClO+OH―,与Fe3+、Al3+不能共存。
(3)漂白粉:有效成分为Ca(ClO)2。
①制备试剂:氯气和石灰乳
②漂白原理:Ca(ClO)2+H2O+CO2= CaCO3+2HClO,故应密封并储存于阴凉处。
3.盐酸:具有酸的通性和Cl-的性质
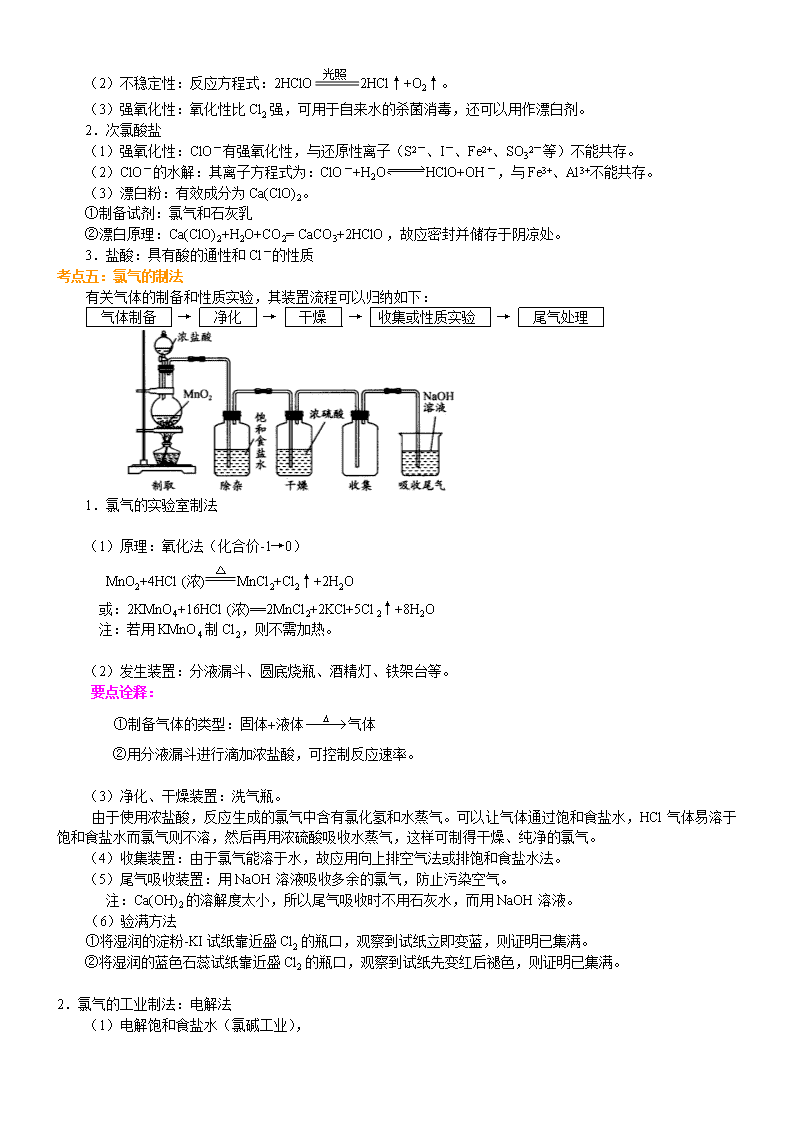
考点五:氯气的制法
有关气体的制备和性质实验,其装置流程可以归纳如下:
气体制备 → 净化 → 干燥 → 收集或性质实验 → 尾气处理
1.氯气的实验室制法
(1)原理:氧化法(化合价-1→0)
MnO2+4HCl (浓)MnCl2+Cl2↑+2H2O
或:2KMnO4+16HCl (浓)==2MnCl2+2KCl+5Cl2↑+8H2O
注:若用KMnO4制Cl2,则不需加热。
(2)发生装置:分液漏斗、圆底烧瓶、酒精灯、铁架台等。
要点诠释:
①制备气体的类型:固体+液体气体
②用分液漏斗进行滴加浓盐酸,可控制反应速率。
(3)净化、干燥装置:洗气瓶。
由于使用浓盐酸,反应生成的氯气中含有氯化氢和水蒸气。可以让气体通过饱和食盐水,HCl气体易溶于饱和食盐水而氯气则不溶,然后再用浓硫酸吸收水蒸气,这样可制得干燥、纯净的氯气。
(4)收集装置:由于氯气能溶于水,故应用向上排空气法或排饱和食盐水法。
(5)尾气吸收装置:用NaOH溶液吸收多余的氯气,防止污染空气。
注:Ca(OH)2的溶解度太小,所以尾气吸收时不用石灰水,而用NaOH溶液。
(6)验满方法
①将湿润的淀粉-KI试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
②将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸先变红后褪色,则证明已集满。
2.氯气的工业制法:电解法
(1)电解饱和食盐水(氯碱工业),
2NaCl+2H2O2NaOH+Cl2↑+H2↑
(2)电解熔融氯化钠(可制得Na)
2NaCl (熔融)2Na+Cl2↑
考点六:卤素及其化合物的递变规律及特性
1.卤素的原子结构
在元素周期表中,与氯元素处于同一纵行——第ⅦA族的元素还有氟(F)、溴(Br)、碘(I)、砹(At,人工合成元素)。与氯元素一样,这些元素原子的最外电子层都有7个电子,都是典型的非金属元素。由于第ⅦA族元素都能与Na、K、Ca、Mg等金属化合生成盐,所以统称为卤素(成盐元素)。
2.物理性质
F2
Cl2
Br2
I2
颜色
淡黄绿色
黄绿色
深红棕色
紫黑色
状态
气态
气态
液态
固态
水中溶解性
反应
可溶
可溶
微溶
熔沸点
Cl2、Br2、I2易溶于苯、CCl4、汽油等有机溶剂。
注意:从溴水中萃取出Br2,可向其中加入苯,振荡、静置,溶液分两层,上层橙红色,下层为水层,近乎无色;从碘水中萃取I2,可向其中加入CCl4,振荡、静置,溶液分两层,上层(水层)近乎无色,下层为紫红色(已知苯的密度小于水的密度,CCl4的密度大于水的密度,且二者均不溶于水)。
3.卤素及其化合物的递变规律
(1)单质氧化性:F2>Cl2>Br2>I2
(2)离子还原性:I->Br->Cl->F-
(3)HX的稳定性:HF>HCl>HBr>HI
(4)HX的熔沸点:HF(含氢键)>HI>HBr>HCl
(5)最高价含氧酸的酸性:HClO4>HBrO4>HIO4
4.卤素中的某些特性及相关应用
(1)氟
①无正价和含氧酸,非金属性最强。
②2F2+2H2O==4HF+O2,与H2反应在暗处即爆炸。
③HF是弱酸,能腐蚀玻璃,保存在铅皿或塑料瓶中;有毒,在HX中沸点最高。
④AgF易溶于水。
(2)溴
①Br2是深红棕色液体,易挥发。
②Br2易溶于有机溶剂。
③盛溴的试剂瓶中加水,进行水封,保存液溴不能用橡胶塞。
(3)碘
①I2遇淀粉变蓝色。
②I2加热时易升华。
③I2易溶于有机溶剂。
④食用盐中加入KIO3可防治甲状腺肿大。
5.卤素离子(X―)的检验
由于在AgX中,除AgF可溶于水,AgCl、AgBr、AgI都是既难溶于水也不溶于稀硝酸的沉淀,所以可用稀硝酸酸化的AgNO3溶液检验X―的存在。其中稀硝酸的作用主要是排除CO32―的干扰。
反应原理:
Ag++Cl―==AgCl↓(白色) Ag++Br―==AgBr↓(淡黄色) Ag++I―==AgI↓(黄色)
【典型例题】
类型一、氯气的性质和应用
例1、(2015 吉林一中期末考)下列关于氯气的叙述正确的是( )。
A.氯气是一种黄绿色、有毒的气体
B.氯元素在自然界中既可以以化合态存在,也可以以游离态存在
C.氯气不能溶解于水,所以可用排水法收集氯气
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
【思路点拨】氯气的物理性质:氯气是一种黄绿色、具有刺激性气味的有毒气体,密度大于空气,在水中溶解性不大,易液化。
【答案】A
【解析】氯气是一种黄绿色、具有刺激性气味的有毒气体,所以A正确;氯元素在自然界中以化合态存在,B错误;氯气可以溶于水,收集氯气用向上排空气法或排饱和食盐水法,C错误;氯气在低温和加压时会变为液体,称为液氯,是一种纯净物,氯水是混合物,D错误。
【总结升华】对于氯气的物理性质,不仅要记住,还要会应用,如颜色、气味、状态、密度、溶解性等性质在氯气制取中收集方法的选择上的应用。
【变式1】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
①
②
③
④
A
黄绿色
橙色
蓝色
白色
B
无色
橙色
紫色
白色
C
黄绿色
橙色
蓝色
无色
D
黄绿色
无色
紫色
白色
【答案】A
【解析】各处的反应原理分别为:
①KClO3+6HCl (浓)==KCl+3Cl2↑+3H2O,产生黄绿色的气体。
②2NaBr+Cl2==2NaCl+Br2,Br2溶于水显橙(黄色)。
③2KI+Cl2==2KCl+I2,I2遇淀粉变蓝。
④Cl2+2NaOH==NaCl+NaCl+NaClO+H2O。两种盐的水溶液都无颜色,故棉球显白色。
【变式2】已知:①向KMnO4固体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸变蓝。下列判断正确的是
A.上述实验证明氧化性:MnO4¯> Cl2 > Fe3+ > I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
【答案】A
类型二、氯水的成分和性质
例2、下列关于氯水的叙述,正确的是( )。
A.氯水久置后,pH增大
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.新制氯水中只含Cl2和H2O分子
【思路点拨】从Cl2和H2O反应的化学平衡及其移动入手分析。
【答案】B
【解析】在新制的氯水中溶有大量Cl2分子,其中小部分Cl2与水发生反应生成:HCl和HClO,HCl完全电离产生H+和Cl-,HClO部分电离产生H+、ClO-。所以氯水中有三种分子H2O、Cl2、HClO和四种离子H+、Cl-、ClO-、OH-。HClO有强氧化性、漂白性,见光易分解放出O2
。氯水放置数天后HClO分解接近完全,转化为盐酸,酸性增强。
【总结升华】解题的关键是明确氯水的各种组成成分,这些组成成分决定了其性质的多样性。
举一反三:
【变式1】新制氯水中存在H2O、Cl2、HClO、HCl,其中能起杀菌消毒作用的是________,能与锌反应生成氢气的是________,能与硝酸酸化的硝酸银溶液作用生成白色沉淀的是________,能使染料和有机物质褪色的是________,能与FeCl2反应的是________。
【答案】HClO HCl HCl HClO Cl2
【解析】HClO具有强氧化性,可杀菌消毒和漂白有机色质;HCl具有强酸性,能与活泼金属反应生成H2,并且HCl电离产生的Cl-可与硝酸酸化的硝酸银溶液反应,生成白色沉淀;Cl2具有强氧化性,可与具有还原性的物质反应。
【变式2】(2016 上海模拟)在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )。
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl﹣存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
【答案】B
【解析】A、次氯酸有强氧化性能使有色布条褪色,向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有HClO存在,故A错误;B、氯气是黄绿色气体,且有刺激性气味,如果氯水溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在,故B正确;C、盐酸中含有氯离子,向氯水中加入盐酸后再加入硝酸银溶液生成氯化银白色沉淀,不能说明氯水中含有氯离子,故C错误;D、Cl2+H2O⇌HCl+HClO,该反应是可逆反应,向氯水中加入氢氧化钠溶液,氯水黄绿色消失,说明氯水溶液呈酸性,不能证明含有次氯酸,故D错误。
类型三、 氯气的制取
例3、实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4==ZnSO4+H2↑
MnO2+4HCl (浓)MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
【思路点拨】从反应物的状态及反应条件来选择发生装置,从生成物的性质选择干燥、除杂及收集方法。
【答案】e d
【解析】根据制取H2的反应原理:Zn+H2SO4==ZnSO4+H2↑,确定制取H2的实验装置,生成的H2
可用排水集气法或向下排空气法收集,故选e。依据实验室制取Cl2的反应原理:MnO2+4HCl (浓)MnCl2+Cl2↑+2H2O确定其实验装置,生成的Cl2可用向上排空气法或排饱和食盐水法收集,但由于Cl2有毒,浓盐酸具有挥发性,故制出Cl2后要用饱和食盐水除去Cl2中的HCl气体,用盛有浓H2SO4的洗气瓶除去Cl2中的H2O (g),最后用NaOH溶液吸收多余的Cl2,以防污染环境。
【总结升华】从发生装置、干燥、除杂、收集、尾气处理等角度来把握气体的制法。
举一反三:
【变式1】某学生设计如下实验装置用于制备纯净的Cl2。
(1)装置中有五处错误,请指出①________,②________,③________,④________,⑤________。
(2)在更正后的装置图中,洗气瓶(净化气体)中的饱和食盐水、浓硫酸、氢氧化钠溶液的作用分别是:
①饱和食盐水的作用:________;②浓硫酸的作用:________;③氢氧化钠的作用:________。
【答案】(1)①用长颈漏斗错误,应用分液漏斗 ②不能用稀盐酸,应用浓盐酸 ③没有用酒精灯,应用酒精灯加热 ④盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒,应予更换位置 ⑤盛饱和食盐水洗气瓶中的进气导管未插入液面下,出气导管插入液面,应进气导管插入液面下,出气导管不插入液面下
(2)①除去氯气中混有的HCl ②除去氯气中混有的水蒸气 ③吸收多余的氯气,防止污染环境
类型四、Cl-的检验
例4、检验溶液中的离子,实验步骤和结论均正确的是( )
A.加入AgNO3溶液,有白色沉淀生成,证明一定含有Cl-离子。
B.加入HNO3酸化的Ba(NO3)2溶液有白色沉淀生成,证明一定含有SO42—离子。
C.加入HCl后产生气体,该气体能使品红溶液褪色,加热后又变成红色,证明一定含有SO32—离子。
D.加入BaCl2溶液,有白色沉淀,证明一定含有SO32—离子。
【思路点拨】本题涉及的白色沉淀可能有:AgCl、AgSO4、AgCO3;BaSO4、BaSO3、BaCO3等。
【答案】C
【解析】(A)加AgNO3出现白色沉淀,不一定含有Cl-,也可能有SO42—、SO32—等。
(B)加入HNO3酸化的Ba(NO3)2,有白色沉淀生成此沉淀肯定为BaSO4。但不能证明原溶液中一定有SO42—离子,因为SO42—离子的来源可能是原溶液中有的,也可能是SO32-被硝酸氧化生成的。
(D)加入BaCl2出现白色沉淀,可能含有SO42—、SO32-、Ag+等。
【总结升华】离子的检验要注意排除干扰。
举一反三:
【变式1】下列说法正确的是( )。
A.Cl-和Cl2都有毒
B.将AgNO3溶液滴入甲溶液中,若出现白色沉淀,则说明甲溶液中含有Cl-
C.将NaCl溶液滴入AgNO3溶液中或将Cl2通入AgNO3溶液中均会出现白色沉淀
D.含Cl-的溶液和氯水一样均呈浅黄绿色
【答案】C
类型五、卤素单质
例5、下列关于卤素(用X表示)的叙述正确的是(
)
A.单质都能与大多数金属反应,生成高价态金属卤化物
B.单质都能与H2反应,且从F2→I2逐渐变难
C.单质都能与H2O反应,通式X2+H2O==HX+HXO
D.单质的还原性顺序为:F2>Cl2>Br2>I2
【思路点拨】从卤素单质的相似性、递变性及特性角度分析。
【答案】B
【解析】单质都能跟金属反应,但I2与金属反应生成低价态的金属碘化物,A错误;随着单质的氧化性顺序:F2>Cl2>Br2>I2,单质与H2化合也逐渐变难,所以B正确,D错误; F2与H2O反应时,2F2+2H2O==4HF+O2,所以C错误。
【总结升华】卤素单质的性质既存在相似性,也存在差异性,对特别的性质需要特别记忆。
举一反三:
【变式1】关于卤素的下列叙述正确的是( )。
A.卤素只以化合态存在于自然界中
B.随着核电荷数的增加,卤素单质的熔、沸点升高
C.随着核电荷数的增加,单质的氧化性增强
D.单质与水反应,均可用通式:X2+H2O=HX+HXO表示
【答案】AB
【变式2】已知氧化性顺序:Cl2>Br2>I2,判断下列反应中不能发生的是( )
A.Cl2+2KBr==2KCl+Br2 B.Br2+2KI==2KBr+I2
C.Cl2+2KI==2KCl+I2 D.I2+2KCl==2KI+Cl2
【答案】D
【巩固练习】
一、选择题(每题只有一个选项符合题意)
1.下列实验现象的描述不正确的是( )
A.氢气在氯气中燃烧生成白色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.红热的铜丝在氯气中燃烧,产生棕黄色烟
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
2.现有盐酸、氯化钠、氢氧化钠和氯水四种溶液,可用来区别它们的一种试剂是( )
A.AgNO3溶液 B.酚酞溶液 C.紫色石蕊试液 D.饱和食盐水
3.检验氯化氢气体中是否混有氯气,可采用的方法是( )
A.用干燥的蓝色石蕊试纸 B.用干燥的红布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
4.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液
A.①②③ B.①②③⑥ C.③⑥ D.③④⑥
5.下列关于物质的保存不正确的是( )
A.AgNO3溶液应保存在棕色瓶中 B.氯水保存在棕色细口瓶中
C.液氯可以保存在干燥的钢瓶中 D.漂白粉可露置于空气中保存
6.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A、7.1克Cl2与4.6克钠完全反应,Cl2失去电子数为0.2NA
B、7.1克Cl2常温下与足量水完全反应,Cl2的电子转移0.2NA
C、1 mol Cl2作为氧化剂时得到的电子数为2NA
D、1mol Cl2参加氧化还原反应,转移的电子数一定为2NA
7.下列叙述正确的是( )
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性
C.Li、Na、K的原子半径和密度随原子序数的增加而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强
8.NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是( )
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.上图所示转化反应都是氧化还原反应
9.(2015 江苏徐州期末)下列关于氯气的叙述中不正确的是( )。
A.可用向上排空气法收集少量的氯气
B.与水反应生成的次氯酸是一种弱酸
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.与氢氧化钠溶液反应时,Cl2既被还原,同时又被氧化
10.(2016·沈阳模拟)海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
【答案与解析】
一、选择题
1.A
【解析】H2在Cl2中燃烧应生成白雾即氯化氢气体的酸雾(烟是固体颗粒、雾是液体液滴)。
2.C
【解析】盐酸能使紫色石蕊试液变红;氯化钠不能使紫色石蕊试液变色;氢氧化钠使紫色石蕊试液变蓝;氯水使紫色石蕊试液先变红后褪色。
3.D
4.C
5.D
【解析】AgNO3、氯水中的HClO见光容易分解,所以保存在棕色试剂瓶中;漂白粉露置在空气中容易与CO2作用,所以应密封保存。
6.C
【解析】A项中氯元素均变为-1价,应是Cl2得到电子数为0.2NA;B项中氯元素发生歧化反应,变为-1价和+1价,Cl2的电子转移0.1NA; C项1 mol Cl2作为氧化剂得到的电子数一定为2NA;D项Cl2
参加氧化还原反应化合价变化有多种情况。
7.D
【解析】A项,所得产生分别为FeCl3、FeCl2,B项,过量的K与水反应生成KOH,C项,Na的密度比K大。
8.B
【解析】石灰乳与Cl2的反应中氯气发生歧化反应,Cl2既是氧化剂,又是还原剂。常温下干燥的Cl2能用钢瓶贮存仅代表常温Cl2不与铁反应,加热、高温时可以反应;在候氏制碱法中不涉及氧化还原反应。
9.C
【解析】氯气的密度比空气大,可用向上排空气法收集,A项正确;次氯酸是弱酸,B项正确:常温下铁与氯气不反应,在加热条件下氯气与铁反应生成FeCl3,C项错误;氯气与NaOH溶液反应生成NaCl、NaClO,Cl2既被还原,同时又被氧化,D项正确。
10.C
【解析】A项,向苦卤中通入Cl2 时发生反应Cl2+2Br-===2Cl-+Br2,故其目的是为了提取溴,正确;B项,可将粗盐溶解、过滤除去难溶性杂质,然后向滤液中加入沉淀剂,过滤后调节滤液pH以除去可溶性杂质,最后重结晶可得精盐,正确;C项,工业生产常选用廉价的Ca(OH)2作为沉淀剂,错误;D项,由于通入Cl2后所得溶液中Br2的浓度很小,因此利用Br2的挥发性,可先用空气和水蒸气吹出Br2,再用SO2将其还原为HBr进行富集,正确。