- 5.86 MB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014高考真题理科综合全国新课标1卷化学试题及答案
一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7. 下列化合物中同分异构体数目最少的是( )
A. 戊烷 B. 戊醇 C. 戊烯 D. 乙酸乙酯
8. 化学与社会、生活密切相关。对下列现象或事实的解释正确的是
9. 已知分解 1 mol H2O2 放出热量 98 kJ,在含少量 I−的溶液中,H2O2 分解的机理为:
H2O2 + I− H2O + IO− 慢
H2O2 + IO− H2O + O2+ I− 快
下列有关该反应的说法正确的是( )
A. 反应的速率与 I− 的浓度有关 B. IO− 也是该反应的催化剂
C. 反应活化能等于 98 kJ·mol−1 D. υ(H2O2)=υ(H2O) =υ(O2)
10. W、X、Y、Z 均是短周期元素,X、Y 处于同一周期,X、Z 的最低价离子分别为 X2−和
Z−,Y+和 Z−离子具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z B. 单质沸点:X>Y>Z
C. 离子半径:X2−>Y+>Z− D. 原子序数:X>Y>Z
11.溴酸银(AgBr O3)溶解度随温度变化曲线如图所示,下列说法错误的是
A.溴酸银的溶解是放热过程
B.温度升高时澳酸银溶解速度加快
C. 60 ℃ 时溴酸银的Ksp约等于 6×l0−4
D.若硝酸钾中含有少量溴酸银,可用重
结晶方法提纯
12.下列有关仪器使用方法或实验操作正确的是
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
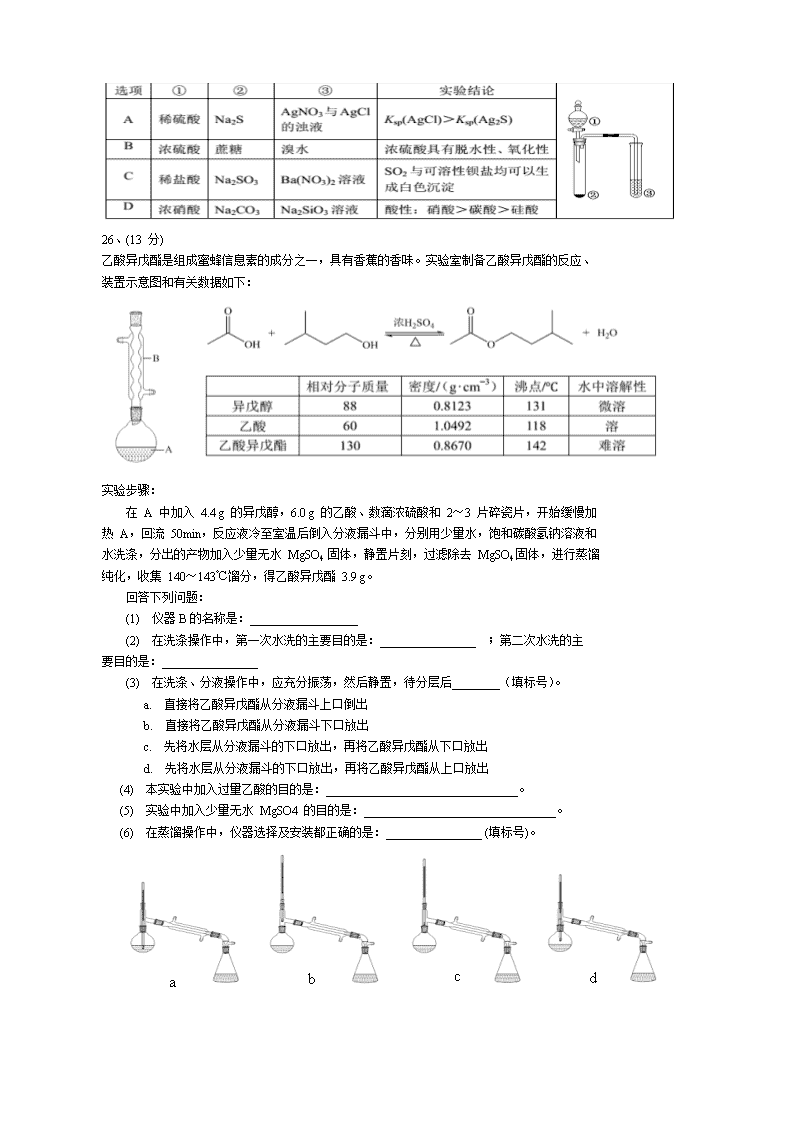
13. 利用右图所示装置进行下列实验,能得出相应实验结论的是( )
26、(13 分)
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、
装置示意图和有关数据如下:
实验步骤:
在 A 中加入 4.4 g 的异戊醇,6.0 g 的乙酸、数滴浓硫酸和 2~3 片碎瓷片,开始缓慢加
热 A,回流 50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和
水洗涤,分出的产物加入少量无水 MgSO4 固体,静置片刻,过滤除去 MgSO4固体,进行蒸馏
纯化,收集 140~143℃馏分,得乙酸异戊酯 3.9 g。
回答下列问题:
(1) 仪器B的名称是:__________________
(2) 在洗涤操作中,第一次水洗的主要目的是:________________ ;第二次水洗的主
要目的是:________________
(3) 在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a. 直接将乙酸异戊酯从分液漏斗上口倒出
b. 直接将乙酸异戊酯从分液漏斗下口放出
c. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4) 本实验中加入过量乙酸的目的是:________________________________。
(5) 实验中加入少量无水 MgSO4 的目的是:________________________________。
(6) 在蒸馏操作中,仪器选择及安装都正确的是:________________ (填标号)。
a
b
c
d
(7) 本实验的产率是:________________(填标号)。
a. 30% b. 40% c. 50% d. 60%
(8) 在进行蒸馏操作时,若从 130℃便开始收集馏分,会使实验的产率偏______ (填“高”
或“低”),其原因是________________________________。
27、(15 分)
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1) H3PO2是一元中强酸,写出其电离方程式: 。
(2) H3PO2及 NaH2PO2均可将溶液中的 Ag+还原为银,从而可用于化学镀银。
① H3PO2 中,磷元素的化合价为 。
②利用 H3PO22进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4:1,则氧化产
物为 (填化学式)。
③ NaH2PO2 为 (填“正盐”或“酸式盐”),其溶液显 (填“弱
酸性”、“中性”或“弱碱性”)
(3) H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成 PH3气体和 Ba(H2PO3) 2,后者再与 H2SO4反应。写出白磷与氢氧化钡溶液反应的化学方程式: 。
(4) H3PO2也可用电渗析法制备。 “四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
① 写出阳极的电极反应式 。
② 分析产品室可得到H3PO2的原因 。
③ 早期采用“三室电渗析法”制备H3PO2将
“四室电渗析法”中阳极室的稀硫酸用 H3PO2
稀溶液代替,并撤去阳极室与产品室之间的阳
膜,从而合并了阳极室与产品室。 其缺点是产
品中混有 杂质。该杂质产生的原因
是: 。
28、(15 分)
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1) 间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成
乙醇。写出相应反应的化学方程式 。
(2)已知:
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系 ( 其中
除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
38.【化学—选修 5: 有机化学基础】(15 分)
席夫碱类化合物 G 在催化、药物、新材料等方面有广泛应用。合成 G 的一种路线如下:
已知以下信息
② 1mol B 经上述反应可生成 2mol C,且 C 不能发生银镜反应
③ D 属于单取代芳烃,其相对分子质量为 106
④ 核磁共振氢谱显示 F 苯环上有两种化学环境的氢
回答下列问题:(1) 由 A 生成 B 的化学方程式为 ,反应类型为 。
(2) D 的化学名称是 ,由 D 生成 E 的化学方程式为: 。
(3) G 的结构简式为 。
(4) F 的同分异构体中含有苯环的还有 种(不考虑立体异构),其中核磁共振
氢谱为 4 组峰,且面积比为 6:2:2:1 的是 (写出其中一种的结构简式)。
(5) 由苯及化合物 C 经如下步骤可合成 N−异丙基苯胺:
反应条件 1 所用的试剂为 ,反应条件2 所用的试剂为 ,
I 的结构简式为 。
选择题答案:
7—13 ACAD ABB
【26题答案】(13分)
(1)球形冷凝管 (2)洗掉大部分硫酸和醋酸 洗掉碳酸氢钠 (3)d
(4)提高醇的转化率 (5)干燥 (6)b (7) c (8) 高 会收集少量未反应的异戊醇
【27题答案】(15分)
(1)(2)+1 H3PO4 正盐 弱碱性
(3)
(4)
【28题答案】(15分)
(1)
(2) —45.5 污染小,腐蚀性小等
(3)①
②反映分子数减少,相同温度下,压强升高乙烯转化率提高
③将产物乙醇移去,增加
【38.选修5题答案】(15分)
消去反应
(1)
(5) 浓硝酸、浓硫酸; 铁粉/稀盐酸(其它合理还原条件也给分);
2015年普通高等学校招生全国统一考试(新课标1卷) 理科综合化学部分
7.我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )
A.氨水 B. 硝酸 C.醋 D.卤水
8.NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol/L亚硫酸溶液中含有的H+两种数为2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
9.乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
A.1:1 B.2:3 C.3:2 D.2:1
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A.
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B.
将铜粉加1.0mol·L-1Fe2(SO4)3溶液中
金属铁比铜活泼
溶液变蓝、有黑色固体出现
C.
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液
先有白色沉淀生成后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
11.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
12.W、X、Y、Z均为的短周期元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:A>Z
C.氧化物的水化物的酸性:Y