- 328.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2016年浙江高考理科综合(化学)试题
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na -23 Mg -24 Al -27 S -32 Cl -35.5 K- 39 Ca- 40 Fe- 56 Zn-65 Br- 80 Ag -108
7.下列说法不正确的是
A.储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量
B.Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
C.Ba2+浓度较高时危害健康,但BaSO4可服人体内,作为造影剂用于X-射线检查肠胃道疾病
D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
8.下列叙述不正确的是
A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线
9.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4。W−的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:X<Y,Z>W
C.化合物Z2Y和ZWY3都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
10.下列说法正确的是
A.的一溴代物和的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物的名称是2,3,4-三甲基-2-乙基戊烷
D.与都是α-氨基酸且互为同系物
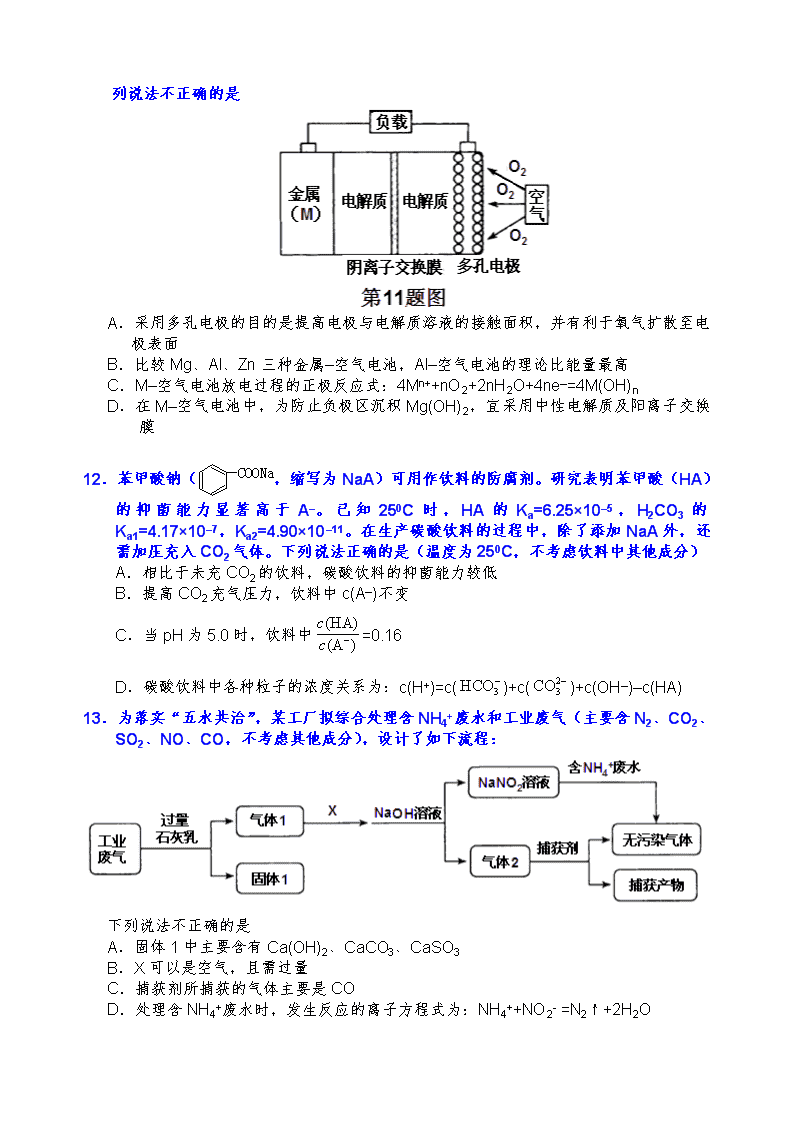
11.金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电总反应方程式为:4M+nO2+2nH2O=4M(OH) n
已知:电池的“理论比能量”
指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电
极表面
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
12.苯甲酸钠(,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知250C时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为250C,不考虑饮料中其他成分)
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A–)不变
C.当pH为5.0时,饮料中=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c()+c()+c(OH–)–c(HA)
13.为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2- =N2↑+2H2O
26.(10分)化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z:
已知:①化合物A的结构中有2个甲基
②
请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是_______ ___,反应类型是___________。
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)____。
27.Ⅰ.(6分)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)427H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.(12分)磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体的电子式为_ _。写出该反应的离子方程式_ __。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
28.(15分)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1= -53.7kJ·mol-1 I
CO2(g)+H2(g)CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
(4)在右图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在 极,该电极反应式是 。
29.(15分)无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至00C,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至00C,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至1600C分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用00C的苯
C.加热至1600C的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2+ + Y4- =Mg Y2-
①滴定前润洗滴定管的操作方法是_______ ___。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是___ (以质量分数表示)。
2016年浙江高考理科综合(化学)试题答案
7.D 8.B 9.D 10.A 11.C 12.C 13.B
26.(1)CH2=CH2;羟基
(2)
;
取代反应
(4)取适量试样于试管中,先用NaOH中和,再加入新制氢氧化铜悬浊液,加热,若产生砖红色沉淀,则有B存在。
27. Ⅰ.(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气
(2)Al2O3 +2OH− =2AlO2− +H2O
(3)MgO+2NH4Cl+H2O = MgCl2+2 NH3·H2O
或NH4Cl+H2O NH3·H2O+HCl,MgO+2HCl=MgCl2+H2O
Ⅱ. (1)S、Fe;
Fe3S4
(2)制印刷电路板
(3);
Fe3S4+6H+ =3H2S↑+3Fe2+ +S
(4)H2SO3+I2+H2O =H2SO4+2HI;
取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42−;过滤后取滤液,滴加H2O2溶液,若再产生白色沉淀,则有H2SO3。
28.(1);
+41.2
(2)CD
(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
(4)
(5)阴 ;
CO2+6H++6e- =CH3OH+H2O
29.(1)干燥管;防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应
(2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患
(3)镁屑
(4)BD
(5)①从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次
②97.5%