- 324.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点五十七 电化学定量计算
聚焦与凝萃
1.掌握利用守恒关系计算转移电子数及产物的用量计算;
2.掌握串联电路中计算方法。
解读与打通
常规考点
与电解有关的计算
(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、相同电量等类型的计算,其依据是
电路中转移的电子数相等。
(2)根据总反应式计算:凡是总反应式中反映出的物质的量关系都可以列比例式计算。
(3)根据关系计算:由得失电子守恒定律关系建立已知量与未知量之间的桥梁,建立计算所需
的关系式,
如以通过 4 mol e-为桥梁可构建如下关系式:
(式中 M 为金属,n 为其离子的化合价数值)该关系式具有总揽电化学计算的作用和价值,
熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。
(4)在电化学计算中,还常利用 Q=I·t 和 Q=n(e-)×NA×1.60×10-19C 来计算电路中通过的
电量。
隐性考点
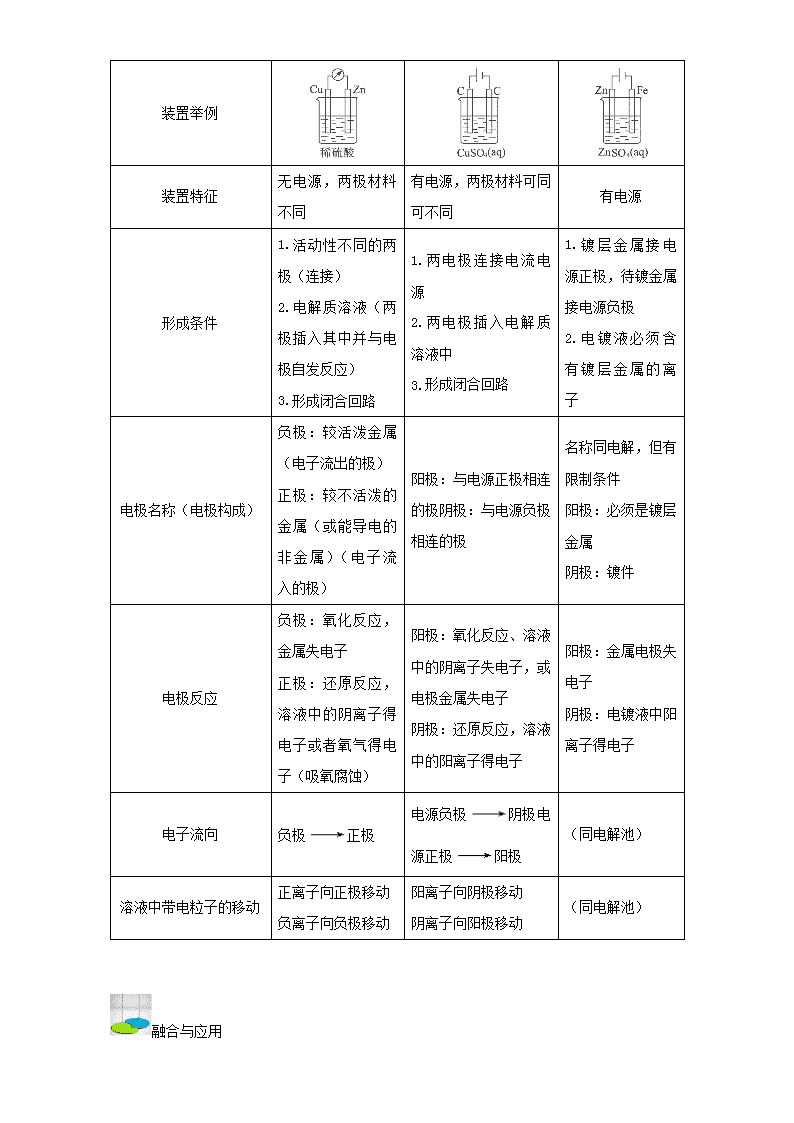
原电池、电解池、电镀池的比较:
类别
性质
原电池 电解池 电镀池
定义(装置特点)
将化学能转变成电
能的装置
将电能转变成化学能
的装置
应 用 电 解 原 理 在
某 些 金 属 表 面 镀
上 一 层 其 他 金 属
的装置
反应特征 自发反应 非自发反应 非自发反应
装置举例
装置特征
无电源,两极材料
不同
有电源,两极材料可同
可不同
有电源
形成条件
1.活动性不同的两
极(连接)
2.电解质溶液(两
极插入其中并与电
极自发反应)
3.形成闭合回路
1.两电极连接电流电
源
2.两电极插入电解质
溶液中
3.形成闭合回路
1. 镀 层 金 属 接 电
源正极,待镀金属
接电源负极
2. 电 镀 液 必 须 含
有 镀 层 金 属 的 离
子
电极名称(电极构成)
负极:较活泼金属
(电子流出的极)
正极:较不活泼的
金属(或能导电的
非金属)(电子流入
的极)
阳极:与电源正极相连
的极阴极:与电源负极
相连的极
名称同电解,但有
限制条件
阳极:必须是镀层
金属
阴极:镀件
电极反应
负极:氧化反应,
金属失电子
正极:还原反应,
溶液中的阴离子得
电子或者氧气得电
子(吸氧腐蚀)
阳极:氧化反应、溶液
中的阴离子失电子,或
电极金属失电子
阴极:还原反应,溶液
中的阳离子得电子
阳极:金属电极失
电子
阴极:电镀液中阳
离子得电子
电子流向 负极 正极
电源负极 阴极电
源正极 阳极
(同电解池)
溶液中带电粒子的移动
正离子向正极移动
负离子向负极移动
阳离子向阴极移动
阴离子向阳极移动
(同电解池)
融合与应用
例 1.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电
一段时间后,析出钾、镁、铝的物质的量之比为
( )
A.6∶3∶2 B.6∶3∶1 C.1∶2∶3 D.3∶2∶1
解析:串联电路通过各电解池的电子总数相等。
答案:A
例 2.在 0 ℃和 1×105Pa 下,用铂电极电解硫酸铜溶液,当阴极产生 6.4 g 铜时,阳极放
出 ( )
A.1.12 L 氢气 B.1.12 L 氧气 C.2.24 L 氢气 D.2.24 L 氧气
解析:电解池中,阳极失去的电子数等于阴极得到的电子数。
答案:B
例 3.用 Pt 做电极,电解含 c(Cu2+)∶c(Na+)∶c(Cl-)=1∶2∶4 的混合溶液,在任何情况
下,阴、阳两极下不可能...同时发生的反应是
( )
A.阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑
B.阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑
C.阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2↑
D.阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑
答案:C
扫描与矫正
【正误判断】(正确的打“√”,错误的打“×”)(每个判断 2 分,共 40 分)
( )1.用石墨作电极电解氯化钠稀溶液,阴、阳两极收集到的气体物质的量之比一定为 1∶
1
( )2.用石墨作电极电解足量氯化钠溶液一段时间后,加入盐酸就能使溶液复原
( )3.根据得失电子守恒可知电解精炼铜时,阳极减少的质量和阴极增加的质量相等
( )4.电解精炼铜时,若阳极质量减少 6.4 g,则电路中转移电子数为 0.2NA
( )5.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电
一段时间后,析出钾、镁、铝的物质的量之比为 6∶3∶2
( )6.用惰性电极电解 M(NO3)x 的水溶液,当阴极上增重 a g 时,在阳极上同时产生 b L(标
准状况)氧气,从而可知 M 的相对原子质量是5.6 ax
b
( )7.在 0℃和 1×105Pa 下,用铂电极电解硫酸铜溶液,当阴极产生 6.4 g 铜时,阳极放出
1.12 L 氧气
( )8.用石墨作电极电解 CuSO4 溶液。通电一段时间后,欲使电解液恢复到起始状态,应
向溶液中加入适量的 CuO (2011·大纲全国卷,10 C)
( )9.某种氢氧燃料电池的电解液为 KOH 溶液,用该电池电解 CuCl2 溶液,产生 2.24 L Cl2(标
准状况)时,有 0.1 mol 电子转移
( )10.用惰性电极电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为 1∶2
( )11.用惰性电极电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为 1∶1
( )12.在铁片上镀铜时,若铁片增重 3.2g,则电路中通过的电子的物质的量为 0.5mol
( )13.用石墨作电极电解氯化钠稀溶液,阴、阳两极收集到的气体物质的量之比一定为 1∶
1
( )14.用石墨作电极电解足量氯化钠溶液一段时间后,加入盐酸就能使溶液复原
( )15.电解精炼铜时,若阴极得到 2 mol 电子,则阳极质量减少 64 g
( )16.需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀
( )17.某溶液中含有两种溶质 NaCl 和 H2SO4,它们的物质的量之比为 3︰1,用石墨电极电
解该混合液。溶液 pH 不断增大,最后为 7
( )18.在 100mlH2SO4 与 CuSO4 的混合液中,用石墨作电极电解一段时间,两极上均收集到
2.24L 气体(标准状况),则原溶液中 Cu2+物质的量浓度为 1molL-1
( )19.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入
0.1mol 碱式碳酸铜 Cu2(OH)2CO3]后恰好恢复到电解前的浓度和 pH(不考虑 CO2 的溶
解)。则电解过程中共转移电子的物质的量是 0.6 mol
( )20.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定
的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 充电 放电
3Zn(OH)2 + 2Fe(OH)3
+ 4KOH,放电时每转移 3 mol 电子,则正极有 1mol K2FeO4 被氧化
实训与超越
【7+1 模式】
一、单选(7×6 分=42 分)
1.两个惰性电极插入 500 mL AgNO3 溶液中,通电电解。当电解液的 pH 从 6.0 变为 3.0 时(设
电解过程中阴极没有 H2 放出,且电解液在电解前后体积变化可以忽略不计),电极上析出银的
质量最大为 ( )
A.27 mg B.54 mg C.106 mg D.216 mg
2.将两个铂电极插入 500 mL CuSO4 溶液中进行电解,通电一定时间后,某一电极增重 0.064 g(设
电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
( )
A.4×10-3 mol·L-1 B.2×10-3 mol·L-1 C.1×10-3 mol·L-1 D.1×10-7 mol·L
-1
3.500 mL KNO3 和 Cu(NO3)2 的混合溶液中 c(NO-
3 )=0.6 mol·L-1,用石墨作电极电解此溶液,当
通电一段时间后,两极均收集到 2.24 L 气体(标准状况下),假定电解后溶液体积仍为 500 mL,
下列说法正确的是 ( )
A.原混合溶液中 c(K+)为 0.2 mol·L-1
B.上述电解过程中共转移 0.2 mol 电子
C.电解得到的 Cu 的物质的量为 0.05 mol
D.电解后溶液中 c(H+)为 0.2 mol·L-1
4.用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集 B 和 C
逸出的气体。1 min 后测得 B 口的气体体积为 C 口处的一半,下列说法不正确的是
( )
A.电源左侧为正极
B.电解槽左侧的电极反应方程式为 2H2O-4e-=O2+4H+
C.D 口导出的溶液为 KOH 溶液,且浓度比刚加入电解槽右侧时的浓度大
D.在标准状况下,若 1 min 后从 C 口处收集到的气体比 B 口处收集到的气体多 2.24 L,则
有 0.1NA 个 SO 2-
4 通过阴离子膜
5.用惰性电极电解 100 mL 4 mol·L-1 的 CuSO4 溶液,一定时间后在阳极收集到 1.12 L 气体,向
电解后的溶液中加入足量的铁粉,充分作用后溶液中的 Fe2+浓度为(设溶液的体积不变,反应前
后均为标准状况)( )
A.2.7 mol·L-1 B.3 mol·L-1 C.4 mol·L-1 D.1 mol·L-1
6.【2013·天津,6】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以 Al 作阳极、Pb 作阴极,
电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+
2H2SO4(aq)=2PbSO4(s)+ 2H2O(l) 电解池:2Al+3H2O=====
电解
Al2O3+3H2↑ 电解过程中,以下判
断正确的是 ( )
电池 电解池
A H+移向 Pb 电极 H+移向 Pb 电极
B 每消耗 3 mol Pb 生成 2 mol Al2O3
C 正极:PbO2+4H++2e-=Pb2++2H2O 阳极:2Al+3H2O-6e-=Al2O3+6H+
D
7.用酸性氢氧燃料电池电解苦卤水(含 Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b 为石墨电
极)。下列说法中,正确的是
( )
A.电池工作时,正极反应式为:O2+2H2O+4e-=4OH-
B.电解时,a 电极周围首先放电的是 Br-而不是 Cl-,说明当其他条件相同时前者的还原性
强于后者
C.电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗 0.02 g H2 时,a 极周围会产生 0.71 g Cl2
二、填空(18 分)
8.如图表示一个电解池,装有电解液 a;X、Y 是两块电极板,通过导线与直流电源相连。请回
答以下问题:
(1)若 X、Y 是惰性电极,a 是饱和 NaCl 溶液,实验开始时,同时在两边各滴入几滴酚酞,
则:
①电解池中 X 极上的电极反应式是 ,X 极附近观察到的现象
是 。
②Y 电极上的电极反应式是 ,检验该电极反应产物的方法
是 。
(2)若用电解方法精炼粗铜,电解液 a 选用 CuSO4 溶液,则:
①X 电极的材料是 ,电极反应式是 。
②Y 电极的材料是 ,电极反应式是 (说明:杂质发生的电极反应
不必写出)。
③当电路中有 0.04 mol 电子通过时,阴极增重 g。
考点五十七 电化学定量计算
【正误判断】
题号 正误 解析
1 ×
电解氯化钠稀溶液开始 2NaCl+2H2O=====电解Cl2↑+H2↑+2NaOH,后来
2H2O=====电解2H2↑+O2↑,故阴、阳两极收集到的气体物质的量之比不一定为 1∶1。
2 ×
电解饱和食盐水时从溶液中析出的是氢气和氯气,且物质的量之比是 1∶1,故可
向溶液中通入氯化氢气体,但不能加盐酸,如果加入一定浓度的盐酸,可能使浓
度复原,但是溶液的体积不能“复原”。
3 ×
电解精炼铜时,阴极析出的只有 Cu,而阳极减少的有活泼的 Zn、Fe、Ni 等形成
阳离子存在于溶液中,不活泼的 Ag、Au 等形成阳极泥沉在底部,故两极的质量
变化不相等。
4 ×
错误电解精炼铜时,阳极除了铜被电解,Fe、Ni 等也被电解,所以转移电子数无
法判断
5 × 串联电路通过各电解池的电子总数相等
6 √
7 √ 略
8 √ 依据 2CuSO4+2H2O 2Cu+O2↑+2H2SO4,欲使电解质溶液恢复到起始状态,应向
溶液中加入适量的 CuO。
9 √ 略
10 ×
电解 Na2SO4 溶液时,在阳极发生反应:4OH--4e-→H2O+O2↑,在阴极发生反应:
4H++4e-→2H2↑,由于两电极通过的电量相等,故析出 H2 与 O2 的物质的量之比
为 2∶1,C 不正确;
11 √
电解 CuCl2 溶液时,阴极反应为 Cu2++2e-→Cu,阳极反应为 2Cl--2e-→Cl2↑,
两极通过电量相等时,Cu 和 Cl2 的物质的量之比为 1∶1。
12 × 在铁片上镀铜时,若铁片增重 3.2g,则电路中通过的电子的物质的量为 0.1mol
13 ×
电解氯化钠稀溶液开始 2NaCl+2H2O=====电解Cl2↑+H2↑+2NaOH,后来
2H2O=====电解2H2↑+O2↑,故阴、阳两极收集到的气体物质的量之比不一定为 1∶1。
【7+1 模式】
题号 答案 解 析
1 B
首先结合离子放电顺序,弄清楚两极的反应:阳极 4OH-
-4e-=O2↑+2H2O;阴极 4Ag++4e-=4Ag,电解的总反应式
为 4AgNO3+2H2O=====电解4Ag+O2↑+4HNO3。由电解的总反应
式可知,电解过程中生成的 n(Ag)=n(HNO3)=n(H+)=(10
-3 mol·L-1-10-6 mol·L-1)×0.5 L≈5×10-4 mol,m(Ag)
=5×10-4 mol×108 g·mol-1=0.054 g=54 mg。
2 A
根据 2CuSO4+2H2O=====电解2Cu+2H2SO4+O2↑,得:n(H+)=
2n(H2SO4)=2n(Cu)=2× 0.064 g
64 g·mol-1=0.002 mol,c(H+)
14 ×
电解饱和食盐水时从溶液中析出的是氢气和氯气,且物质的量之比是 1∶1,故可
向溶液中通入氯化氢气体,但不能加盐酸,如果加入一定浓度的盐酸,可能使浓
度复原,但是溶液的体积不能“复原”。
15 ×
精炼铜时,阳极失电子的有 Zn、Fe、Cu 等,当转移 2 mol 电子时,阳极消耗的
质量不一定为 64 g。
16 × 电离和电化学腐蚀不需要通电就可进行。
17 ×
电解质溶液中 n(Na+):n(Cl-):n(H+):n(SO4
2-)=3:3:2:1,电解过程明显分为三个阶
段:
第一阶段相当于电解盐酸:2HCl=====电解Cl2↑+H2↑
第二阶段相当于电解氯化钠溶液:2NaCl+2H2O=====电解Cl2↑+H2↑+2NaOH
第三阶段相当于电解水:2H2O=====电解2H2↑+O2↑,可见不正确。
18 √
阳极电极反应式为:4OH- - 4e- = 2H2O + O2↑
阴极电极反应式为:(开始)Cu2+ + 2e- = Cu (最后)2H+ + 2e- = H2↑
根据电子得失守恒: 21.0)(2
4.22
24.24
4.22
24.2 2
11
LCuc
Lmol
L
Lmol
L
12 1)( molLCuc 。
19 √
加入 0.1 mol 碱式碳酸铜 Cu2(OH) 2CO3]恢复原状,可将 0.1 molCu2(OH) 2CO3]分
解成 0.2 mol CuO、0.1 mol H2O、0.1 mol CO2(因它可从溶液中跑掉,可忽略),
由此说明有 0.2 mol 硫酸铜电解完成后,又有 0.1 mol H2O 发生电解,故电子转
移的物质的量应为电解 CuSO4 和电解水电子转移的量之和:0.4 mol+0.2 mol=0.6
mol。
20 × K2FeO4 被还原。
=0.002 mol
0.5 L
=4×10-3 mol·L-1。
3 A
石墨作电极电解 KNO3 和 Cu(NO3)2 的混合溶液,阳极反应式
为 4OH--4e-=2H2O+O2↑,阴极先后发生两个反应:Cu2+
+2e-=Cu,2H++2e-=H2↑。从收集到 O2 为 2.24 L 这个事
实可推知上述电解过程中共转移 0.4 mol 电子,而在生
成 2.24 L H2 的过程中转移 0.2 mol 电子,所以 Cu2+共得
到 0.4 mol-0.2 mol=0.2 mol 电子,电解前 Cu2+的物质
的量和电解得到的 Cu 的物质的量都为 0.1 mol。电解前
后分别有以下守恒关系:c(K+)+2c(Cu2+)=c(NO-
3 ),c(K+)
+c(H+)=c(NO-
3 ),不难算出:电解前 c(K+)=0.2 mol·L
-1,电解后 c(H+)=0.4 mol·L-1。
4 D
5 C
惰性电极电解硫酸铜,生成物是氧气、硫酸和铜。加入铁
粉后发生氧化还原反应,生成硫酸亚铁,所以根据 S 原子
守恒可知,硫酸亚铁的物质的量浓度与原硫酸铜的物质的
量浓度应该是相等的,所以反应后溶液中 Fe2+浓度为 4
mol·L-1。
6 D
原电池中,Pb 为负极:Pb-2e-+SO2-
4 =PbSO4,PbO2 为正极:
PbO2+2e-+SO2-
4 +4H+=PbSO4+2H2O,所以 H+向 PbO2 极移动。
电解池中,Pb 为阴极:2H++2e-=H2↑,Al 为阳极:3H2O
+2Al-6e-=Al2O3+6H+,所以 H+向 Pb 电极移动,A 错。每
消耗 3 mol Pb 时转移 6 mol e-,每生成 2 mol Al2O3 时,
转移 12 mol e-,B 错。根据 A 项分析,可知电池的正极
反应式书写错误,C 错。原电池中随时间增长,Pb 变为
PbSO4,质量增加,电解池中 Pb 极产生 H2,Pb 电极质量不
变,D 正确。
7 B A 项忽视了在酸性环境中不可能生成 OH-;电解时阳极发
生失电子氧化反应,还原性强的离子优先失电子,a 极产
物应首先得到 Br2,其次才能得到 Cl2,故 B 项正确,而 D
项错误;电解时,电子不是通过溶液转移,而是通过溶液
中的离子放电(阴离子失电子或阳离子得电子)转移的,C
项错误。
8
(1)①2H++2e-=H2↑ 有气
泡产生,溶液变红色
②2Cl--2e-=Cl2↑ 将湿润
的 KI淀粉试纸置于 c 口处,
试纸变蓝
(2)
①纯铜 Cu2++2e-=Cu
②粗铜 Cu-2e-=Cu2+
③1.28