- 181.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014年高考全国新课标I卷
理综化学试题
7.下列化合物中同分异构体数目最少的是( )
A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯
8.化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
用热的烧碱溶液洗去油污
Na2CO3可直接和油污反应
B
漂白粉在空气中久置变质
漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3
C
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
D
FeCl3溶液可用于铜质印刷线路板制作
FeCl3能从含有Cu2+的溶液中置换出铜
9.已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2 + I- →H2O + IO- 慢
H2O2 + IO-→H2O + O2 + I- 快
下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
10.X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z B. 单质沸点:X>Y>Z
C. 离子半径:X2->Y+>Z- D. 原子序数:X>Y>Z
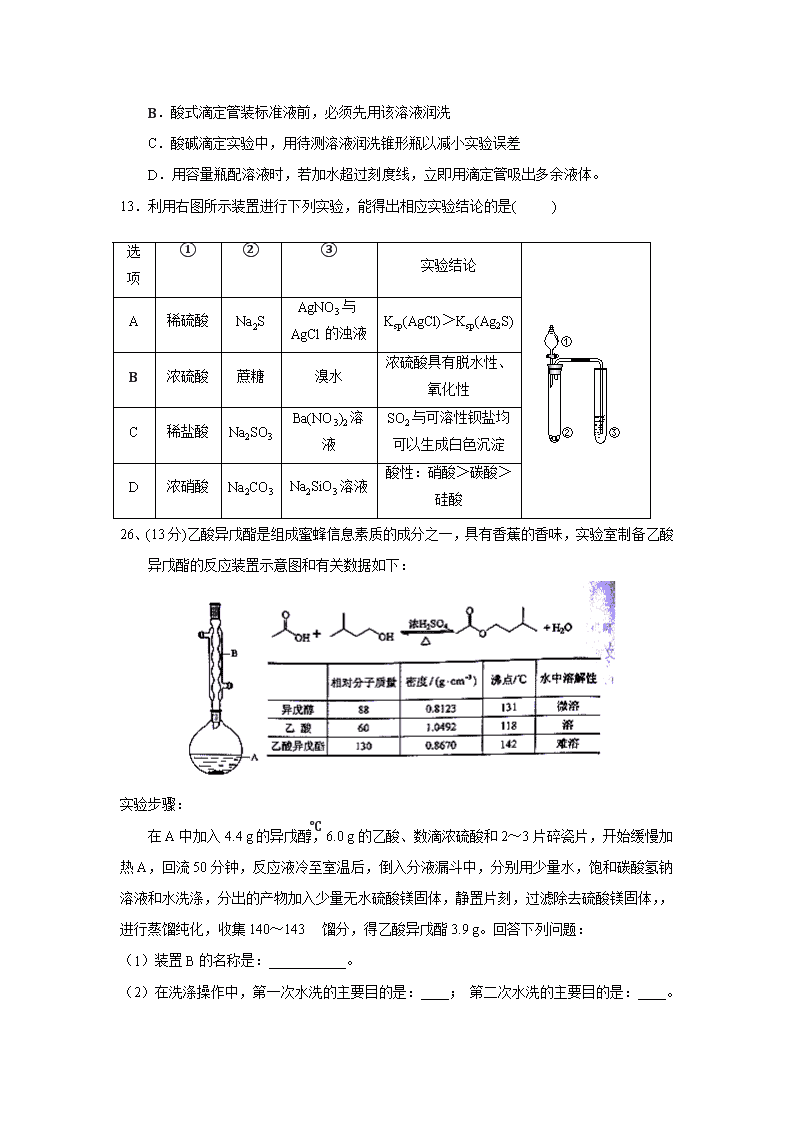
11.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
0.0
0.2
0.4
0.6
0.8
1.0
1.4
1.2
20
40
60
80
100
t /℃
s /(g/100g H2O)
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
12.下列有关仪器的使用方法或实验操作正确的是( )
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴定管吸出多余液体。
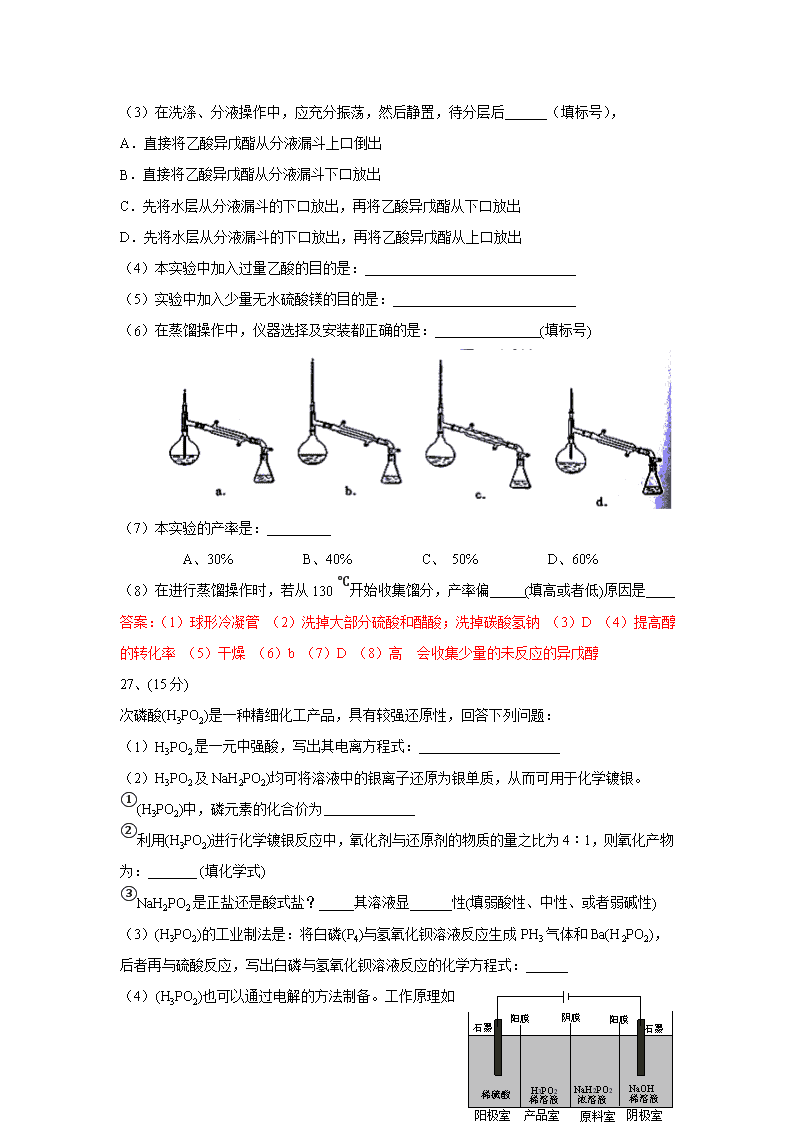
13.利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
①
②
③
A
稀硫酸
Na2S
AgNO3与AgCl的浊液
Ksp(AgCl)>Ksp(Ag2S)
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可以生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
26、(13分)乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)装置B的名称是:___________。
(2)在洗涤操作中,第一次水洗的主要目的是:____; 第二次水洗的主要目的是:____。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后______(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:
(5)实验中加入少量无水硫酸镁的目的是:
(6)在蒸馏操作中,仪器选择及安装都正确的是: (填标号)
(7)本实验的产率是:
A、30℅ B、40℅ C、 50℅ D、60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏 (填高或者低)原因是
答案:(1)球形冷凝管 (2)洗掉大部分硫酸和醋酸;洗掉碳酸氢钠 (3)D (4)提高醇的转化率 (5)干燥 (6)b (7)D (8)高 会收集少量的未反应的异戊醇
27、(15分)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:_______ (填化学式)
③NaH2PO2是正盐还是酸式盐?_____其溶液显______性(填弱酸性、中性、或者弱碱性)
(3)(H3PO2)的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2),后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:______
阳极室
阴极室
产品室
原料室
石墨
石墨
阳膜
阳膜
阴膜
稀硫酸
稀溶液
稀溶液
浓溶液
NaOH
H3PO2
NaH2PO2
(4)(H3PO2
)也可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是 杂质。该杂质产生的原因是:
答案:(1)H3PO2H+ + H2PO2-;(2)① +1; ② H3PO4; ③ 正盐 弱碱性
(3)2P4 + 3Ba(OH)2 + 6H2O === 3Ba(H2PO2)2 + 2PH3↑(4)① 2H2O-4e- = O2↑+ 4H+ ②阳极室的H+穿过阳膜扩散至产品室,而二者反应生成H3PO2,或原料室的H2PO2-穿过阴膜扩散至产品室,而二者反应生成H3PO2 ③ PO43- H2PO2-或H3PO2被氧化
28、(15分)乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式___________
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)D△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)D △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))D △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的D△H=_______kJ·mol-1
与间接水合法相比,气相直接水合法的优点是__________。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1:1)
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为:_______,理由是:________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6:1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 ____ 。
答案:(1)C2H4 + H2SO4=C2H5OSO3H、 C2H5OSO3H + H2O=C2H5OH + H2SO4 (2)-45.5 污染小、腐蚀性小等(3)①Kp====0.07(MPa)-1 ② p1<p2<p3<p4 反应分子数减少,相同温度下,压强升高乙烯转化率提高 ③ 将产物乙醇液化移去 增加n(H2O): n(C2H4)比
37、〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有______个未成对电子,三价铁离子的电子排布式为:______可用硫氰化钾奉验三价铁离子,形成配合物的颜色为______
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为_____;一摩尔乙醛分子中含有的σ键的数目为:______。乙酸的沸点明显高于乙醛,其主要原因是:______。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为____。列式表示铝单质的密度_______g·cm-3(不必计算出结果)
答案:(1)X-射线衍射 (2)4 1s22s22p63s23p63d5 血红色 (3)sp3、sp2 6NA CH3COOH存在分子间氢键 16 (4)12
38、〔化学—选修5:有机化学基础〕(15分)
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
A(C6H13Cl)
F(C8H11N)
B
C
D
E
G
1) O3
2)Zn/H2O
NaOH/乙醇
△
浓HNO3
浓H2SO4△
Fe/稀HCl
还原
一定条件下
已知以下信息:
O=C
R2
R3
1) O3
2)Zn/H2O
R1CHO +
①
C=C
R2
R3
R1
H
②一摩尔B经上述反应可生居二摩尔C,且C不能发生银镜反应。
③D属于单取代芳烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的
RNH2
+
O=C
R”
R’(H)
一定条件下
+ H2O
R-N=C
R”
R’(H)
⑤
回答下列问题:
(1)由A生成B的化学方程式为 ,反应类型为
(2)D的化学名称是 ,由D生成E的化学方程式为:
(3)G的结构简式为
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是_______。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
反应条件1
反应条件2
还原
C
一定条件下
I
H
J
N
N-异丙基苯胺
反应条件1所选择的试剂为____;反应条件2所选择的试剂为_____;I的结构简式____。
C2H5OH
△
答案:(1)(CH3)2CClCH(CH3)2 + NaOH (CH3)2C=C(CH3)2 + NaCl + H2O 消去反应
-CH2CH3
+ HNO3
浓H2SO4
△
-CH2CH3
O2N-
+ H2O
(2)乙苯
N
(3)
NH2
NH2
N
(4)19 或 或
NH2
(5)浓硝酸、浓硫酸 铁粉/稀盐酸