- 348.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题10 水溶液中的离子平衡
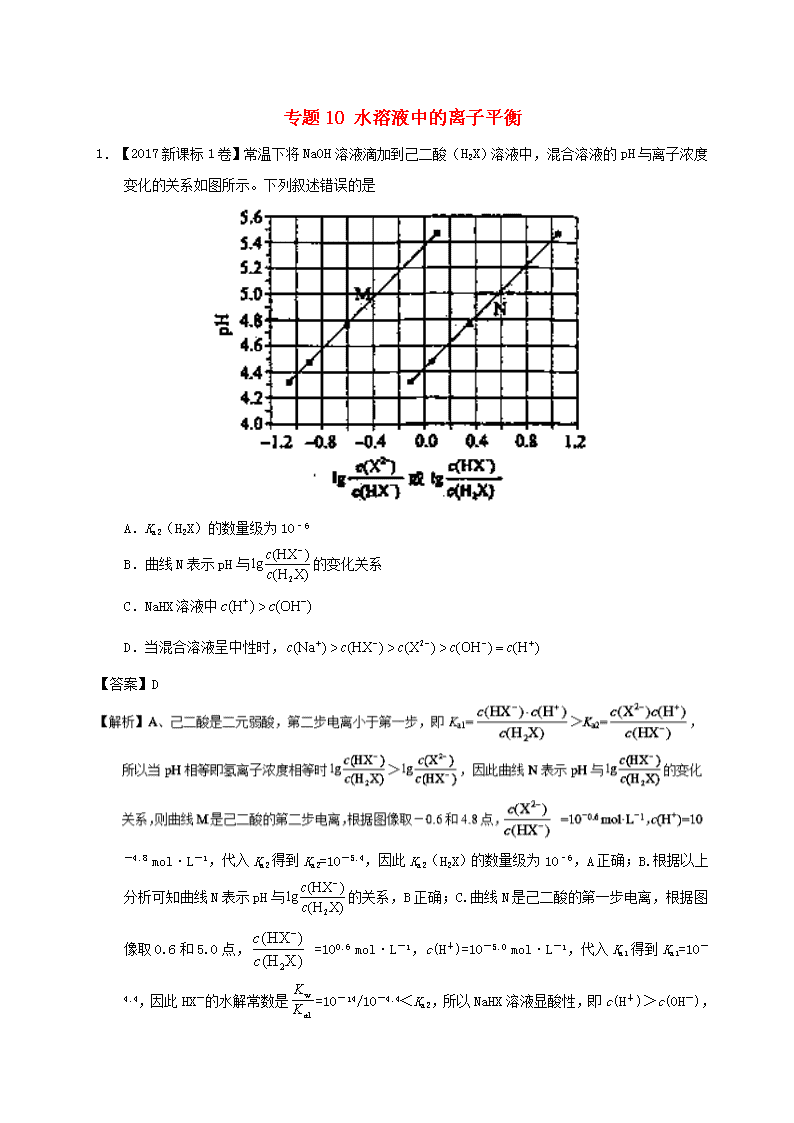
1.【2017新课标1卷】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A.Ka2(H2X)的数量级为10–6
B.曲线N表示pH与的变化关系
C.NaHX溶液中
D.当混合溶液呈中性时,
【答案】D
-4.8 mol·L-1,代入Ka2得到Ka2=10-5.4,因此Ka2(H2X)的数量级为10–6,A正确;B.根据以上分析可知曲线N表示pH与的关系,B正确;C. 曲线N是己二酸的第一步电离,根据图像取0.6和5.0点, =100.6 mol·L-1,c(H+)=10-5.0 mol·L-1,代入Ka1得到Ka1=10-4.4,因此HX-的水解常数是=10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-
),C正确;D.根据图像可知当=0时溶液显酸性,因此当混合溶液呈中性时,>0,即c(X2–)>c(HX–),D错误;答案选D。
【名师点睛】该题综合性强,该题解答时注意分清楚反应的过程,搞清楚M和N曲线表示的含义,答题的关键是明确二元弱酸的电离特点。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,甚至还要用到“守恒”来求解。
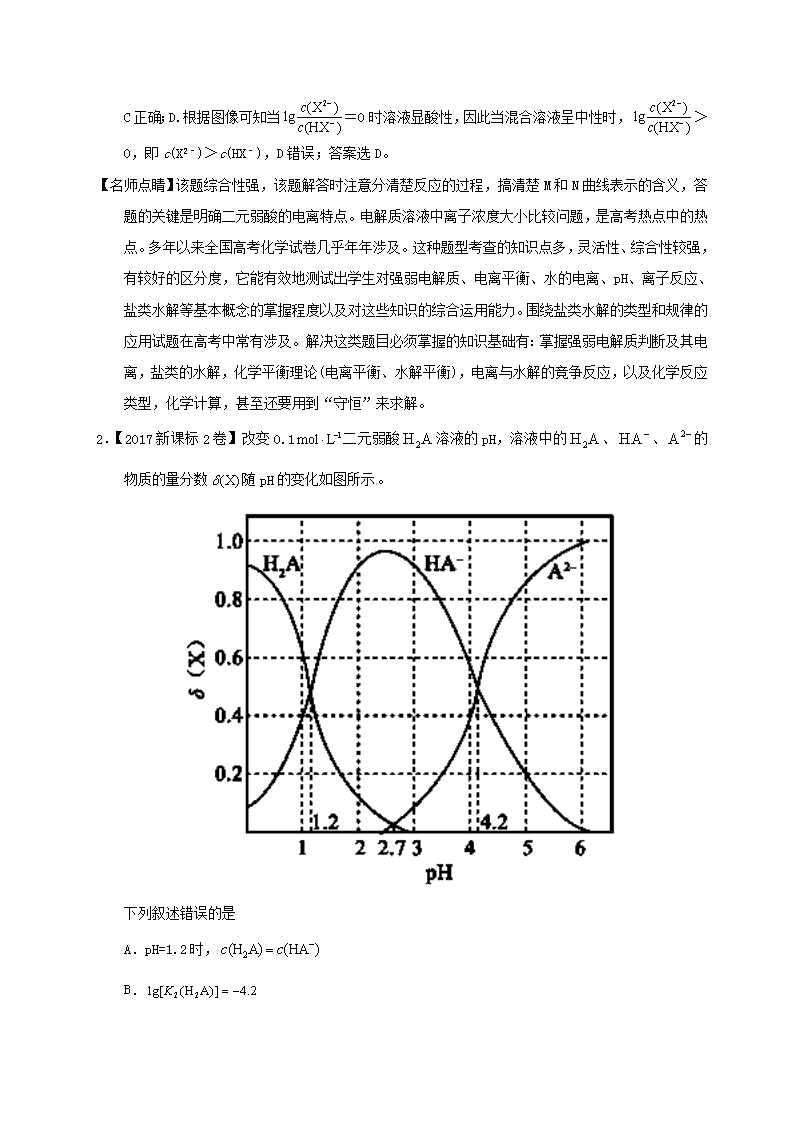
2.【2017新课标2卷】改变0.1二元弱酸溶液的pH,溶液中的、、的物质的量分数随pH的变化如图所示。
下列叙述错误的是
A.pH=1.2时,
B.
C.pH=2.7时,
D.pH=4.2时,
【答案】D
【名师点睛】该题综合性强,该题解答时注意利用守恒的思想解决问题。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,甚至还要用到“守恒”来求解。
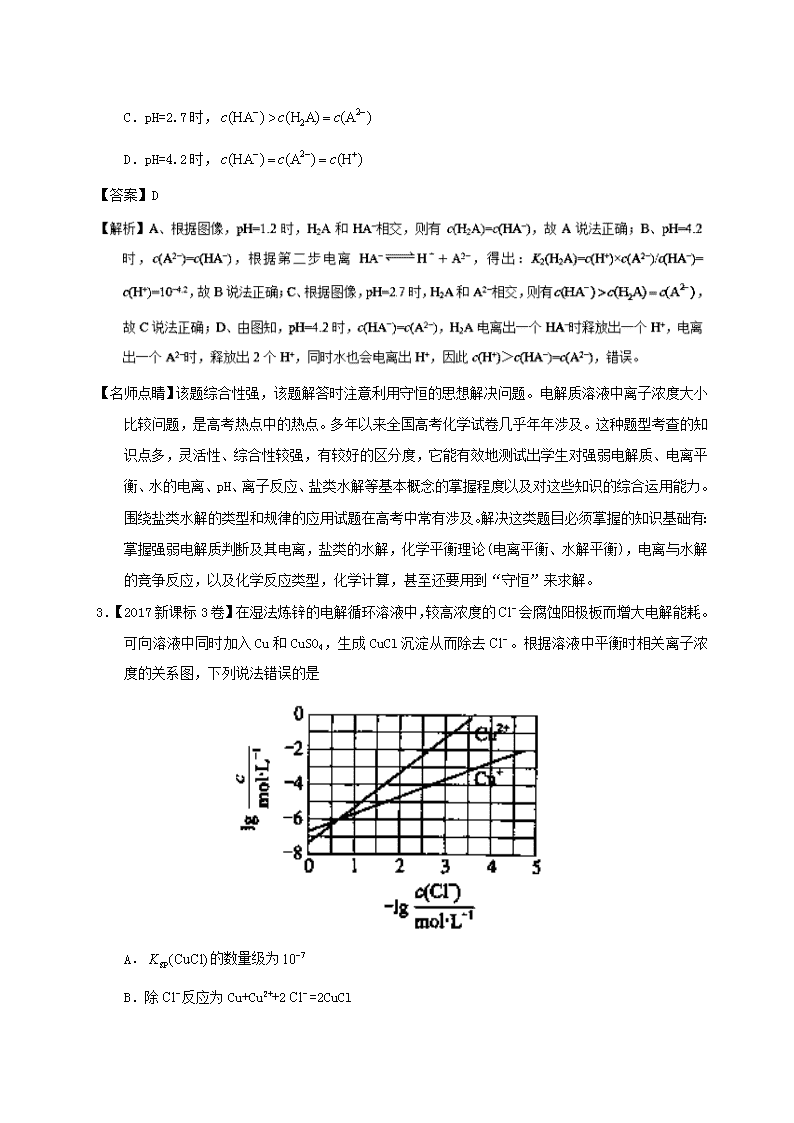
3.【2017新课标3卷】在湿法炼锌的电解循环溶液中,较高浓度的会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
A.的数量级为
B.除反应为Cu+Cu2++2=2CuCl
C.加入Cu越多,Cu+浓度越高,除效果越好
D.2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
【答案】C
【解析】A.Ksp(CuCl)=c(Cu+)·c(Cl-),在横坐标为1时,纵坐标大于-6,小于-5,所以Ksp(CuCl)的数量级是10-7,A正确;B.除去Cl-反应应该是Cu+Cu2++2Cl-=2CuCl,B正确;C.溶液中存在平衡:Cu++Cl-CuCl、2Cu+Cu2++Cu,加入纯固态物质Cu对平衡无影响,故C错误;D.在没有Cl-存在的情况下,反应2Cu+Cu2++Cu的平衡常数约为,平衡常数很大,反应趋于完全,D正确。答案选C。
【名师点睛】本题考查溶度积常数的计算及平衡的移动,难点是对溶液中平衡时相关离子浓度的关系图的理解,通过图示可以提取出Ksp(CuCl),2Cu+Cu2++Cu的平衡常数,并且要注意在化学平衡中纯物质对反应无影响。
4.【2017江苏卷】常温下,Ka(HCOOH)=1.77×10−4,Ka(CH3COOH)=1.75×10−5,Kb(NH3·H2O) =1.76×10−5,下列说法正确的是
A.浓度均为0.1 mol·L−1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol·L−1 HCOOH与0.1 mol·L−1 NaOH 等体积混合后的溶液中:c(HCOO−) + c(OH−) = c(HCOOH) + c(H+)
D.0.2 mol·L−1 CH3COONa 与 0.1 mol·L−1盐酸等体积混合后的溶液中(pH<7):c(CH3COO−) > c(Cl− ) > c(CH3COOH) > c(H+)
【答案】AD
量浓度较大的是乙酸,等体积的两溶液中,乙酸的物质的量较大,用同浓度的氢氧化钠溶液中和这两种溶液,乙酸消耗的氢氧化钠溶液较多,B错误;C.两溶液等体积混合后得到甲酸和甲酸钠的混合液,由电荷守恒得c(H+)+c(Na+)=c(OH−)+c(HCOO−),由物料守恒得2c(Na+)=c(HCOOH)+c(HCOO−),联立两式可得2c(H+)+c(HCOOH)=2c(OH−)+c(HCOO−),C错误;D.两溶液等体积混合后,得到物质的量浓度相同的乙酸、乙酸钠和氯化钠的混合液,由于溶液pH<7,所以溶液中乙酸的电离程度大于乙酸根的水解程度,氯离子不水解,乙酸的电离程度很小,所以c(CH3COO−)>c(Cl−)>c(CH3COOH)>c(H+),D正确。
【名师点睛】本题以3种弱电解质及其盐的电离、反应为载体,考查了酸碱中和滴定和溶液中离子浓度的大小比较。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。高考试题常围绕盐类水解的类型和规律的应用出题。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,弱电解质的电离平衡常数的意义及其重要应用,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,要用到三个“守恒”(物料守恒、电荷守恒、质子守恒)来求解。很多大小关系要巧妙运用守恒关系才能判断其是否成立。
5.【河南省2017届诊断卷(A)】一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是
A. 该温度下,Ksp(MnS)大于1.0×10-35
B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出
D. 该温度下,溶解度:CuS>MnS>FeS>ZnS
【答案】D
粉末后c(Fe2+)×c(S2-)大于10-20,所以有FeS沉淀析出,C正确;D、依据此图可知,CuS的Ksp最小,其次是MnS、FeS和ZnS,所以该温度下,溶解度:CuS<MnS<FeS<ZnS,D错误,答案选D。
6.【湖南省2017年冲刺预测卷】20mL 0.1000 mol•L-1氨水用0.1000 mol•L-1的盐酸滴定,滴定曲线入右下图,下列说法正确的是
A. 该中和滴定适宜用酚酞作指示剂
B. 两者恰好中和时,溶液的pH=7
C. 达到滴定终点时,溶液中:c(H+)= c(OH-)+ c(NH3·H2O)
D. 当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)-)+c(Cl-)
【答案】C
7.【武昌区2017届5月调研】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
A. I表示的是滴定醋酸的曲线
B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【答案】C
【解析】A. 0.100mol·L-1的HCl溶液和醋酸溶液,醋酸难电离,所以起点pH较小 的I表示的是滴定盐酸的曲线,故A错误;B. 当醋酸与氢氧化钠恰好完全反应时,形成醋酸钠溶液,醋酸钠水解使溶液pH>7,所以pH =7时,滴定醋酸消耗的V(NaOH)<20.00mL,故B错误;C. V(NaOH)= 20.00mL时,酸碱恰好完全反应,因为CH3COO-水解而消耗,所以两份溶液中c(Cl-)>c(CH3COO-),故C正确;D. V(NaOH)=10.00mL时,生成的醋酸钠与剩余醋酸浓度相等,由于醋酸的电离程度大于醋酸钠的水解程度,所以溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误。故选C。
点睛:等物质的量浓度的醋酸与醋酸钠的混合溶液,醋酸的电离程度大于醋酸钠的水解程度。
8.【徐州市2017届考前模拟冲刺打靶卷】20℃时,向20 mL 0.1 mol·L-1的Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸(忽略H2CO3的分解和CO2的挥发),溶液pH随盐酸加入的体积变化曲线如图。下列说法正确的是
A. 点①所示溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B. 点②所示溶液中:c(CO32-)>c(Cl-)>c(HCO3-)>c(OH-)
C. 点③所示溶液中:c(OH-)﹣c(H+)=c(H2CO3)﹣c(CO32-)
D. 点④所示溶液中:c(Cl-)=2c(H2CO3) + c(HCO3-)
【答案】CD
9.【虎林市2017届摸底考试(最后冲刺)】下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-l
D. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,将减小
【答案】D
C错误;D.溶液中=×=,常温下向10 mL0.1 mol•L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,反应生成醋酸氨,溶液中氢离子浓度减小,氢氧根离子浓度增大,Kb不变,则比值减小,故D正确;故选D。
10.【淄博市2017届仿真模拟(打靶卷)】某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1 mol•L-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图。下列说法不正确的是
A. A、B、C三点所表示的溶液中水的电离程度依次增大
B. 加入1 mol NaOH后,溶液中c(Na+)=c(R-)
C. 通入HCl, R-的水解程度增大,HR的电离常数减小
D. 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR)
【答案】C
【解析】A、A点H+浓度最大,对水的电离程度抑制作用最强,C点pH=7,对水的电离程度无抑制作用,所以A、B、C三点所表示的溶液中水的电离程度依次增大,选项A正确;B、根据图像,加入1 mol NaOH后,溶液的pH=7,则c(H+)=c(OH‾),根据电荷守恒可得c(H+)+c(Na+)=c(OH‾)+c(R-),所以c(Na+)=c(R-),选项B正确;C、B、温度不变,HR的电离常数不变,选项C不正确;D、未加HCl和NaOH时,溶质为HR和NaR,有图像可知pH<7,溶液显酸性,HR的电离程度大于NaR的水解程度,所以c(R-)>c(Na+)>c(HR),选项D正确。答案选C。
点睛:本题考查了据图分析数据进行电离平衡常数的计算、电离程度与水解程度大小判断以及电荷守恒的应用。
11.【东台市2017届5月模拟】下列装置图或曲线图与对应的叙述相符的是
A. 如图1所示,用0.1mol/LNaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
B. 某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2—)代表S2—浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+
C. 如图3所示,用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO—)>c(OH—)=c(H+)
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5.5左右
【答案】C
钠,溶液呈中性,溶液中存在电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(H+)=c(OH-),则c(CH3COO-)=c(Na+),得到当pH=7时:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故C正确;D.分析图象可知铁离子完全沉淀的pH为3.7,加入氧化铜会调节溶液pH,到pH=5.5时铜离子会沉淀,应调节溶液pH小于5.5,故D错误;故选C。
点睛:溶液中离子浓度大小比较,应从溶液的酸碱性及溶液中各微粒之间守恒关系考虑,最常见的守恒为电荷守恒和物料守恒,如0.1molNaHCO3溶液,因(HCO3-的水解大于其电离,溶液显碱性,同时溶液中除溶剂水外,还存在着Na+、H+、HCO3-、CO32-、OH-及H2CO3,其中电荷守恒式为c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),物料守恒式为c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),至于其它等式关系可以通过电荷守恒和物料守恒利用等量替换得到。
12.【沈阳市2017届第三次模拟】常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如下,则下列说法不正确的是
A. 溶液的pH比较:x>y>z
B. 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
C. 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点
D. 该温度下,CH3COONa的Ka=10-4.75
【答案】B
13.【潍坊市2017届第三次模拟】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ ,滴定曲线如图所示。下列说法错误的是
A. HZ是强酸,HX、HY是弱酸
B. 根据滴定曲线,可得Ka(HY)≈10-5
C. 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D. 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)+c(Z-)+c(Y-)
【答案】C
14.【石家庄市2017届冲刺模考】25℃时,用 0.10 mol·L-1的氨水滴定10.0mL a mol • L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是
A. a=0.10
B. N、P两点溶液中水的电离程度:N
C. M、N两点溶液中NH4+的物质的量之比大于1:2
D. Q 点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
【答案】B
【解析】A. 加入10mL氨水时溶液显酸性,溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O),这说明二者恰好反应生成氯化铵,铵根水解,溶液显酸性,因此a=0.10,A正确;B. N点铵根水解,P点氨水过量,所以溶液中水的电离程度:N>P,B错误;C. M点盐酸过量,抑制铵根水解,则M、N两点溶液中NH4+的物质的量之比大于1:2,C正确;D. Q 点溶液是等浓度的氯化铵和氨水的混合溶液,根据电荷守恒c(OH-)+c(Cl-)=c(NH4+)+c(H+)和物料守恒2c(Cl-)=c(NH4+)+c(NH3·H2O)可知溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O),D正确,答案选B。
点睛:在判断溶液中微粒浓度大小的比较时,要重点从三个守恒关系出发分析思考。①电荷守恒:电荷守恒是指溶液必须保持电中性,即溶液中所有阳离子的电荷总浓度等于所有阴离子的电荷总浓度。例如,NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)。②物料守恒:物料守恒也就是原子守恒,变化前后某种元素的原子个数守恒。例如,0.1 mol·L-1 NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1。③质子守恒:由水电离出的c(H+)等于由水电离出的c(OH-),在碱性盐溶液中OH-守恒,在酸性盐溶液中H+守恒。例如,纯碱溶液中c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。解答本题时,能依据N点物料守恒得出a值是解题的关键。
15.【汕头市2017届第三次模拟】常温下,向20ml0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示。则下列说法正确的是
A. b、d两点为恰好完全反应点
B. c点溶液中c(NH4+) =c(Cl-)
C. a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
D. 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L
【答案】D
荷守恒得c(Cl-)<c(NH4+),故C错误;常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)= mol/L=0.001mol/L,Ka=mol/L=1×10-5mol/L,故D正确。
16.【宁德市2017届第三次质量检查】向0. 10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f与混合液pH的关系如图所示。下列说法正确的是
A. f=0时,溶液中:c(Na+)=2c(CO32-)
B. f=0.5时,溶液中:c(HCO3-)>c(CO32-)
C. f= 1时,溶液中:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-)+c(OH-)
D. f=2时,溶液中:1/2c(Na+)=c(CO32-)+c( HCO3-)+c(H2CO3)
【答案】B
17.【衡阳市2017年十校高考调研冲刺预测卷(五)】如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol·L-1,温度为T1时Ca(OH)2的Ksp = 4×10-6, ≈1.6]。下列说法正确的是
A. 温度: TlT2,故A错误;B、P点属于过饱和溶液,即悬浊液,因此分散质粒子直径大于100nm,故B错误;C、根据Ksp=c(Ca2+)×c2(OH-),4×10-6=4a×(2a)2,解得a=6.25×10-3,因此c(OH-)=2×6.25×10-3mol·L-1=0.0125mol·L-1,故C正确;D、加水稀释,c(Ca2+)和c(OH-)都减小,故D错误。
18.【安徽省江南十校2017届5月冲刺联考(二模)】关于小苏打溶液的表述错误的是
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
C. HCO3-的电离程度小于其水解程度
D. c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
【答案】D
点睛:本题考查离子浓度比较以及三大守恒定律,注意多元弱酸酸式根离子可电离也可水解。HSO3-、H2PO4-等以电离为主;HCO3-、HS-等以水解为主。
19.【龙岩市2017届5月综合能力测试(二)】一种测定水样中溴离子的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2mol·L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL 。
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-= AgSCN(白色)↓,Ksp(AgSCN)=1×10-12)下列说法不正确的是
A. 滴定终点时,溶液变为红色
B. 该滴定法需在碱性条件下进行
C. AgBr(s)+SCN-AgSCN(s)+Br-(aq)的平衡常数K=0.77
D. 该水样中溴离子浓度为:c(Br-)=(c1V1-c2V2)/25.00mol/L
【答案】B
【解析】KSCN与硝酸银生成AgSCN沉淀后,再与Fe3+反应生成Fe(SCN)3,溶液变为红色,故A正确;在碱性条件下Fe3+生成氢氧化铁沉淀,故B错误;AgBr(s)+SCN-AgSCN(s)+Br-(aq)的平衡常数K= 0.77,故C正确;水样中溴离子浓度为:c(Br-)=(c1V1-c2V2)/25.00mol/L,故D正确。
20.【聊城市2017届第三次模拟】向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示。下列说法正确的是
A. b点溶液中只存在H2O的电离平衡和BaSO4的沉淀溶解平衡
B. c 点滚液中:c(H+)+c(NH4+)=c(NH3·H2O)+c(OH-)
C. ab段反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. bc段之间存在某点,其溶液中:c(NH4+)=2c(SO42-)
【答案】D
相关文档
- 2020-2021年高考英语一轮复习考点2021-05-1415页
- 高考英语一轮巩固达标练Unit1Great2021-05-148页
- 辽宁高考数学试题及答案理科2021-05-1410页
- 杭州外国语学校高考英语集训阅读理2021-05-146页
- 高考语文文言文120实词与18虚词 22021-05-1410页
- 历年湖北高考现代文阅读详解2021-05-1417页
- (浙江选考)2020版高考地理大二轮复习2021-05-149页
- 高考数学文二轮复习配套作业解析专2021-05-145页
- 高考复习现在进行时 过去进行时 将2021-05-1419页
- 高考语文试题分类汇编文言文答案及2021-05-1422页