- 379.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电化学基础训练题
李仕才
一、选择题
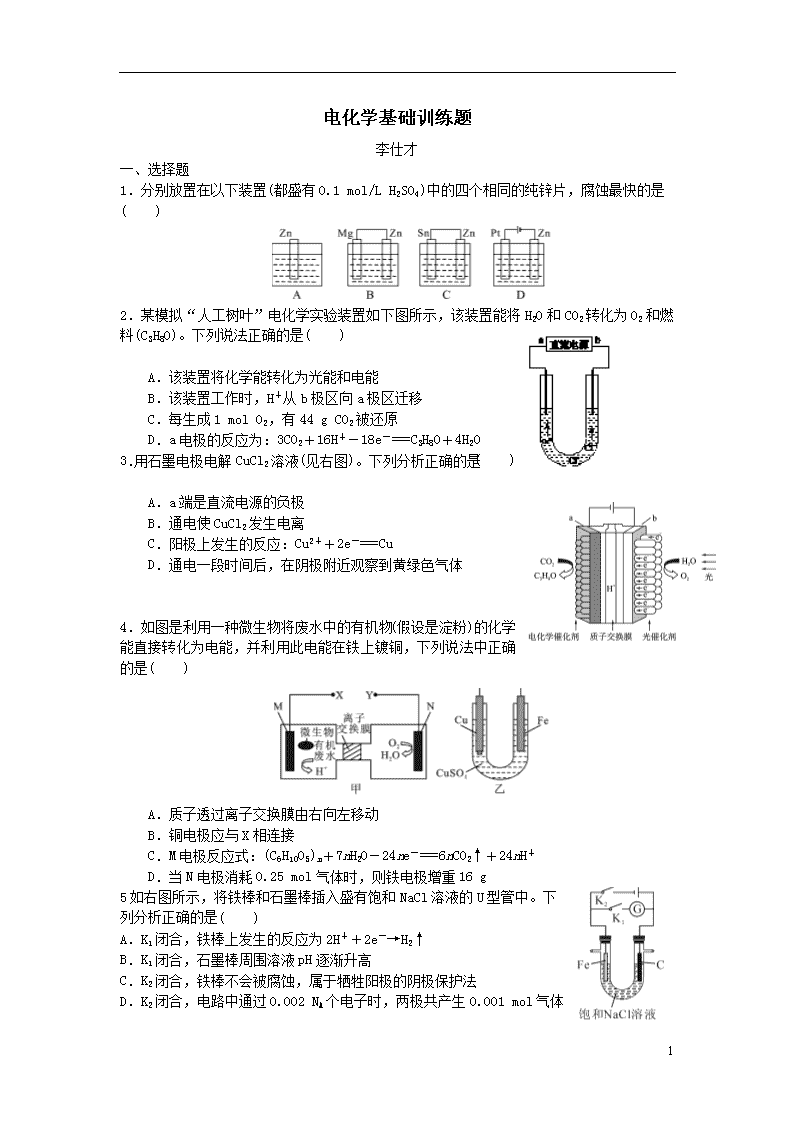
1.分别放置在以下装置(都盛有0.1 mol/L H2SO4)中的四个相同的纯锌片,腐蚀最快的是( )
2.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为:3CO2+16H+-18e-===C3H8O+4H2O
3.用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是( )
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-===Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
4.如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( )
A.质子透过离子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D.当N电极消耗0.25 mol气体时,则铁电极增重16 g
5如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )
A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
5
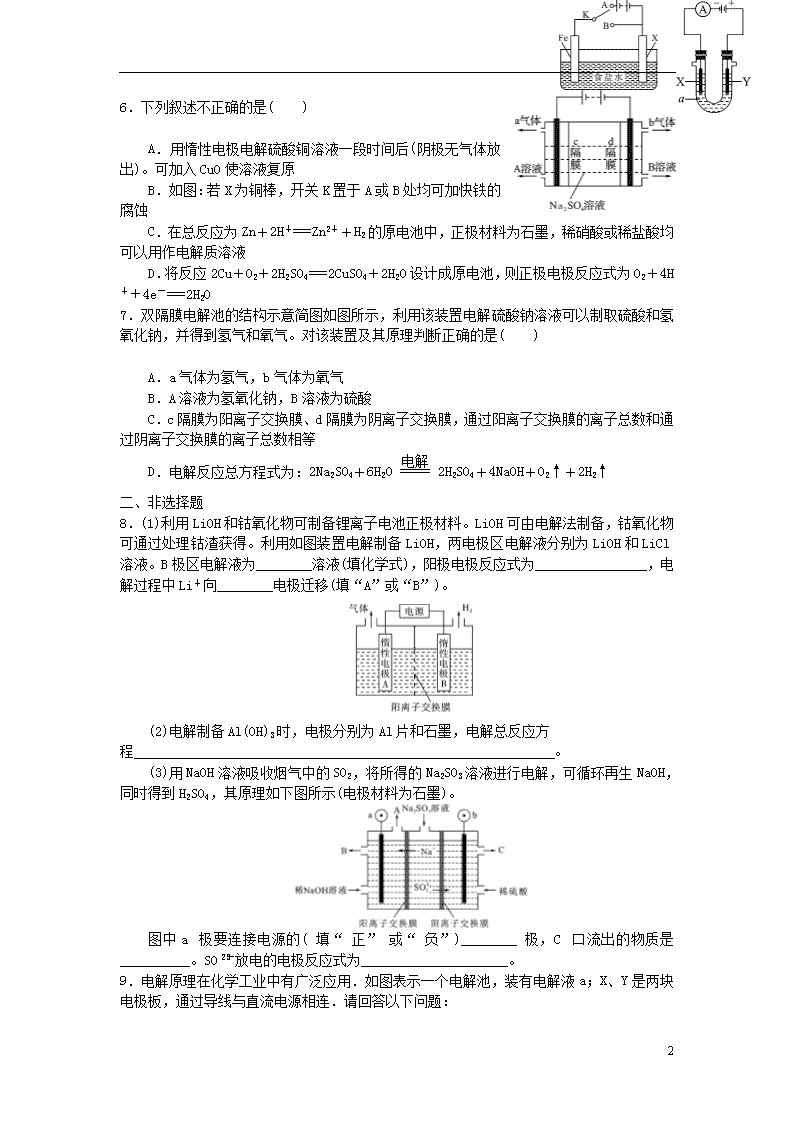
6.下列叙述不正确的是( )
A.用惰性电极电解硫酸铜溶液一段时间后(阴极无气体放出)。可加入CuO使溶液复原
B.如图:若X为铜棒,开关K置于A或B处均可加快铁的腐蚀
C.在总反应为Zn+2H+===Zn2++H2的原电池中,正极材料为石墨,稀硝酸或稀盐酸均可以用作电解质溶液
D.将反应2Cu+O2+2H2SO4===2CuSO4+2H2O设计成原电池,则正极电极反应式为O2+4H++4e-===2H2O
7.双隔膜电解池的结构示意简图如图所示,利用该装置电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是( )
A.a气体为氢气,b气体为氧气
B.A溶液为氢氧化钠,B溶液为硫酸
C.c隔膜为阳离子交换膜、d隔膜为阴离子交换膜,通过阳离子交换膜的离子总数和通过阴离子交换膜的离子总数相等
D.电解反应总方程式为:2Na2SO4+6H2O2H2SO4+4NaOH+O2↑+2H2↑
二、非选择题
8.(1)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为________溶液(填化学式),阳极电极反应式为________________,电解过程中Li+向________电极迁移(填“A”或“B”)。
(2)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程 。
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是__________。SO放电的电极反应式为_____________________。
9.电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
5
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中阴极上的电极反应式为:________________ ,在X极附近观察到的现象是溶液呈________。
②阳极上的电极反应式为____________,检验该电极反应产物的方法是__________________________________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是纯铜 ,电极反应是____________。
②Y电极的材料是粗铜 ,电极反应式是________。(说明:杂质发生的电极反应不必写出)
(3)如果要在铁上银镀,则Y极物质为________。
10.(1) MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是____________________________。
(2)下图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为________________。
(3) 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点,其中电解法是一种重要方法,其原理是电解尿素[CO(NH2)2]的碱性溶液,制氢的装置示意图如下(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
11.某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是________,转移的电子数为____________。
答案解析
1.解析:A项中Zn为化学腐蚀;B项中Mg比Zn活泼,Mg作负极腐蚀,保护了Zn;C项中Zn比Sn活泼,Zn作负极腐蚀;D项中Zn作阴极被保护。所以,C装置中Zn腐蚀最快。
答案:C
5
2.解析:A选项:根据图示可知,该装置将电能和光能转化为化学能。B选项:根据外接电源的正负极,可以确定外电路的电子流动方向,从而可以确定内电路的离子流动方向。C选项:该反应的总方程式是:6CO2+8H2O===2C3H8O+9O2。根据反应方程式可知,每生成1 mol O2,有2/3mol CO2被还原,其质量是88/3 g。D选项:根据图示可知与电源负极连接的a 电极为阴极,发生还原反应,电极的反应式为:3CO2+18H++18e-===C3H8O+5H2O。
答案:B
3.解析:阳离子向阴极移动、阴离子向阳极移动,可知a为负极、b为正极,A项正确;阳极发生失电子的反应生成Cl2、阴极发生得电子的反应生成Cu,C、D两项错误;电解质的电离与是否通电无关,B项错误。
答案:A
4.解析:甲图中M极有机物失电子为负极,N极氧气得电子为正极,所以外电路电子从M流向N,交换膜处H+从左流向右,A选项错误;镀铜时铜作阳极应接外电源的正极,所以B选项错误。
答案:C
5.解析:A选项:若闭合K1,该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,负极上铁失电子,Fe-2e-===Fe2+;B选项:若闭合K1,该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-===4OH-,所以石墨棒周围溶液pH逐渐升高;C选项:K2闭合,Fe与负极相连为阴极,铁棒不会被腐蚀,属于外加电源的阴极保护法;D选项:K2闭合,电路中通过0.002 NA个电子时,阴极生成0.001 mol氢气,阳极生成0.001 mol氯气,两极共产生0.002 mol气体。
答案:B
6.解析: 惰性电极电解硫酸铜溶液时一极析出铜,一极析出氧气,加入氧化铜可复原,A正确;开关置于A处时组成电解池,阳极腐蚀加快,开关置于B处时组成原电池,负极腐蚀加快,B正确;在上述的总反应中,电解质溶液不能选取稀硝酸,C错误;上述反应设计成原电池时,发生吸氧腐蚀,正极反应式正确,D正确。
答案:C
7.解析:根据图中外加电源,可以确定左侧为阳极,OH-离子向左侧移动并放电产生氧气,右侧为阴极,H+通过d隔膜向右侧移动并放电产生H2。
答案:D
8.解析:(1)根据示意图,B极区生产H2,同时生成LiOH,则B极区电解液不能是LiCl溶液,如果是LiCl溶液则无法得到纯净的LiOH,则B极区电解液为LiOH溶液;电极A为阳极,阳极区电解液为LiCl溶液,根据放电顺序,阳极电极反应式为:2Cl--2e-===Cl2↑;根据电流方向,电解过程中Li+向B电极迁移。
(2)电解制备Al(OH)3时,电极分别为Al片和石墨,Al作阳极,石墨作阴极。Al在阳极放电,溶液中的H+在阴极放电,破坏了水的电离平衡,使的溶液中的OH-浓度增大,与产生的Al3+结合生成Al(OH)3,故总反应方程式为:2Al+6H2O2Al(OH)3↓+3H2↑。
(3)从图中离子移动方向可以确定a为阴极。
答案:(1)LiOH;2Cl--2e-===Cl2↑;B
(2)2Al+6H2O 2Al(OH)3↓+3H2↑
(3) 负 硫酸 SO-2e- +H2O===SO+2H+
9.解析:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-===H2
5
↑,X电极负极水的电离被破坏,氢氧根离子浓度增大,溶液呈红色,②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即 2Cl--2e-===Cl2↑,检验氯气的方法是用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色。
(2)①X电极材料是纯铜,阴极上铜离子放电,电极反应式为Cu2++2e-===Cu,②Y电极材料是粗铜,电极反应式为Cu-2e-===Cu2+。
答案:(1)①2H++2e-===H2↑;红色; 2Cl--2e-===Cl2↑;②用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色
(2)①Cu2++2e-===Cu;②Cu-2e-===Cu2+
(3)银
10.解析:(1)电解池中阳极失去电子发生氧化反应,则用惰性电极电解MnSO4溶液可制得MnO2,则阳极是Mn2+放电,其阳极电极反应式为Mn2++2H2O-2e-===MnO2 + 4H+。
答案:(1)Mn2++2H2O-2e-===MnO2+4H+
(2)a;NO+3e-+4H+===NO↑+2H2O
(3)CO(NH2)2+6OH--6e-===CO2↑ +N2↑+5H2O
11.解析: 题图中左边加入含硫酸的水,暗示左边制硫酸,即OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO通过M交换膜向左边迁移,即M为阴离子交换膜,由此推知X为阳极,与电源正极相连,B出口产生氧气,A出口流出硫酸;同理,右侧加入含KOH的水,说明右边制备KOH溶液,H+在Y极发生还原反应,说明Y极为阴极,与电源负极相连,右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜,所以C出口产生氢气,D出口流出KOH溶液。(3)若将制得的氢气和氧气在氢氧化钾溶液中构成原电池,正极反应式为O2+2H2O+4e-===4OH-,负极反应式为2H2-4e-+4OH-===4H2O。(4)n(H2)=0.5 mol,2H++2e-===H2↑,得电子1 mol,X极的反应式为4OH--4e-===2H2O+O2↑,根据得失电子守恒知,生成H+的物质的量为1 mol,故生成0.5 mol H2SO4,m(H2SO4)=49 g。
答案:(1)正 C (2)阴离子 阳离子 (3)H2-2e-+2OH-===2H2O (4)49 g 6.02×1023(或NA)
5