- 352.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考前强化练21 化学工艺流程综合题
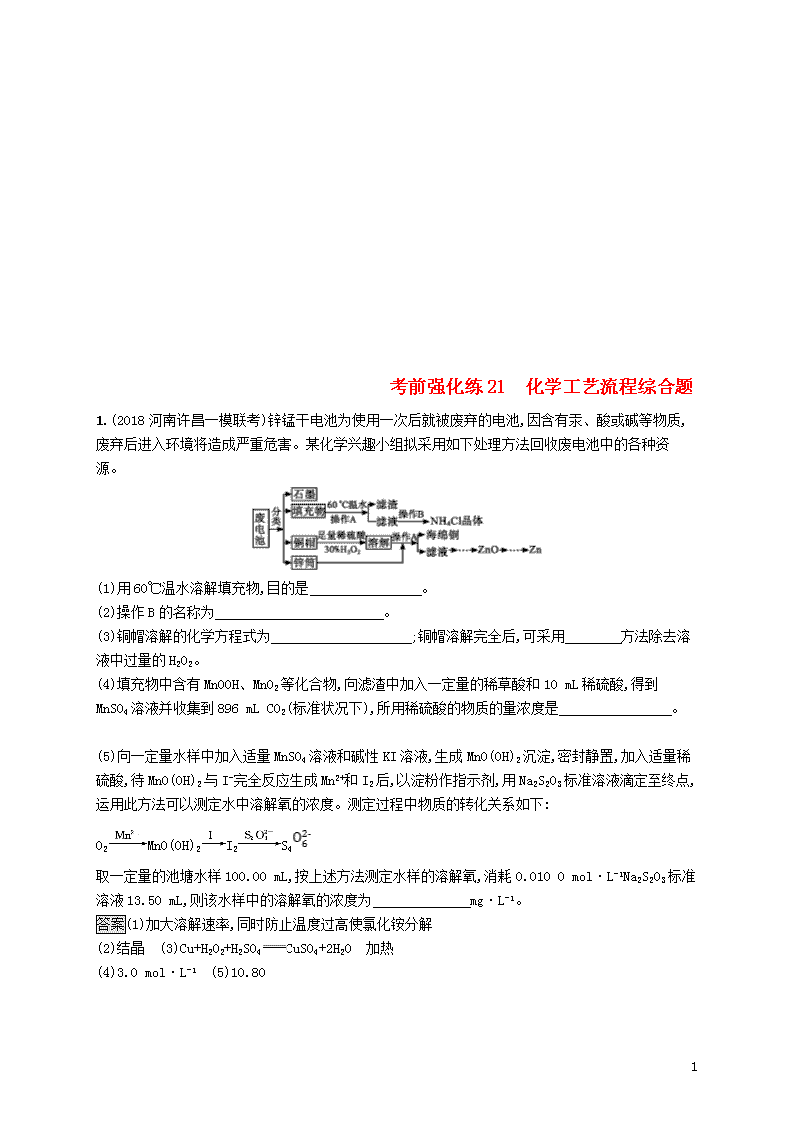
1.(2018河南许昌一模联考)锌锰干电池为使用一次后就被废弃的电池,因含有汞、酸或碱等物质,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)用60℃温水溶解填充物,目的是 。
(2)操作B的名称为 。
(3)铜帽溶解的化学方程式为 ;铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2。
(4)填充物中含有MnOOH、MnO2等化合物,向滤渣中加入一定量的稀草酸和10 mL稀硫酸,得到MnSO4溶液并收集到896 mL CO2(标准状况下),所用稀硫酸的物质的量浓度是 。
(5)向一定量水样中加入适量MnSO4溶液和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀硫酸,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,运用此方法可以测定水中溶解氧的浓度。测定过程中物质的转化关系如下:
O2MnO(OH)2I2S4
取一定量的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 0 mol·L-1Na2S2O3标准溶液13.50 mL,则该水样中的溶解氧的浓度为 mg·L-1。
答案(1)加大溶解速率,同时防止温度过高使氯化铵分解
(2)结晶 (3)Cu+H2O2+H2SO4CuSO4+2H2O 加热
(4)3.0 mol·L-1 (5)10.80
5
解析废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60 ℃温水充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用下发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌。(1)加热,适当升高温度,可促进溶解,同时防止温度过高使氯化铵分解;(2)滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体,所以该操作名称是结晶;(3)酸性条件下,双氧水能将铜氧化,铜帽溶解反应生成铜离子,反应的化学方程式为Cu+H2O2+H2SO4CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热;(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO43MnSO4+4CO2↑+6H2O,根据反应方程式可知,硫酸的物质的量为0.896 L÷22.4 L· mol-1×=0.03 mol,c==3.0 mol·L-1;(5)根据转化关系:O2→MnO(OH)2→I2→Na2S4O6;在100.00 mL水样中,存在I2+2S22I-+S4;n(I2)=n(Na2S2O3)×=0.010 00 mol·L-1×13.50 mL×10-3L·mL-1×=6.750×10-5 mol,根据题中MnO(OH)2与I-完全反应生成Mn2+和I2,可知发生了氧化还原反应,根据电子得失守恒:n[MnO(OH)2]=n(I2)=6.750×10-5 mol;n(O2)=n[MnO(OH)2]=×6.750×10-5 mol=3.375×10-5 mol,水中溶解氧=3.375×10-5 mol×32 g· mol-1×1 000 mg·g-1÷0.1 L=10.80 mg·L-1。
2.(2018江西重点中学协作体高三联考)硫酸镍晶体(NiSO4·7H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程:
已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Ni(OH)2]=1.2×10-15
(1)“碱浸”过程中发生反应的离子方程式是 。
(2)操作a所用到的玻璃仪器有烧杯、 、 ;操作c的名称为 、 、过滤、洗涤。
(3)固体①是 ;加H2O2的目的是(用离子方程式表示) 。
(4)调pH为2~3时所加的酸是 。
5
(5)操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2 mol·L-1,当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5 mol·L-1时,溶液中是否有Ni(OH)2沉淀生成? (填“是”或“否”)。
(6)NiSO4·7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金,该电池在放电过程中总反应的化学方程式是NiOOH+MHNi(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为 。
答案(1)2Al+2OH-+2H2O2Al+3H2↑
(2)漏斗 玻璃棒 蒸发浓缩 冷却结晶
(3)不溶杂质 2Fe2++H2O2+2H+2Fe3++2H2O
(4)硫酸(H2SO4) (5)否
(6)Ni(OH)2+OH--e-NiOOH+H2O
解析镍废样品中只有金属铝与强碱溶液发生反应生成偏铝酸盐和氢气,离子方程式为2Al+2OH-+2H2O2Al+3H2↑;(2)操作a为过滤,用到的玻璃仪器有烧杯、漏斗、玻璃棒;从溶液中得到硫酸镍晶体(NiSO4•7H2O),就需要制成高温时饱和溶液,然后再蒸发浓缩、冷却结晶、过滤、洗涤;(3)铁、镍都溶于酸,只有杂质不溶于酸和碱,所以固体①是不溶杂质;溶液中存在有亚铁离子,加入H2O2的目的就是氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+2Fe3++2H2O;(4)最后要得到NiSO4·7H2O,为了不引入杂质离子,最好加入硫酸调溶液的pH;(5)已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Ni(OH)2]=1.2×10-15;根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=1.0×10-5×c3(OH-)=4.0×10-38,可得c3(OH-)=4.0×10-33 mol·L-1,c(OH-)≈1.6×10-11 mol·L-1,Ni(OH)2的浓度商Qc=c(Ni2+)×c2(OH-)=2×(1.6×10-11)2=5.12×10-22