- 1.03 MB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学《物质的结构与性质》简答题汇编
1、(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
。
GeCl4
GeBr4
GeI4
熔点/℃
−49.5
26
146
沸点/℃
83.1
186
约400
2、东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
③氨的沸点 (“高于”或“低于”)膦(PH3),原因是
_____ ___________________ ;
(3) 元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu >INi的原因是_____
_____________________
3、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________ 。
4、碳及其化合物广泛存在于自然界中,回答下列问题:
(2)碳在形成化合物时,其键型以共价键为主,原因是
。
(4)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于 晶体。
5、A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是
___________________ ;
6、科学家正在研究温室气体CH4和CO2的转化和利用。
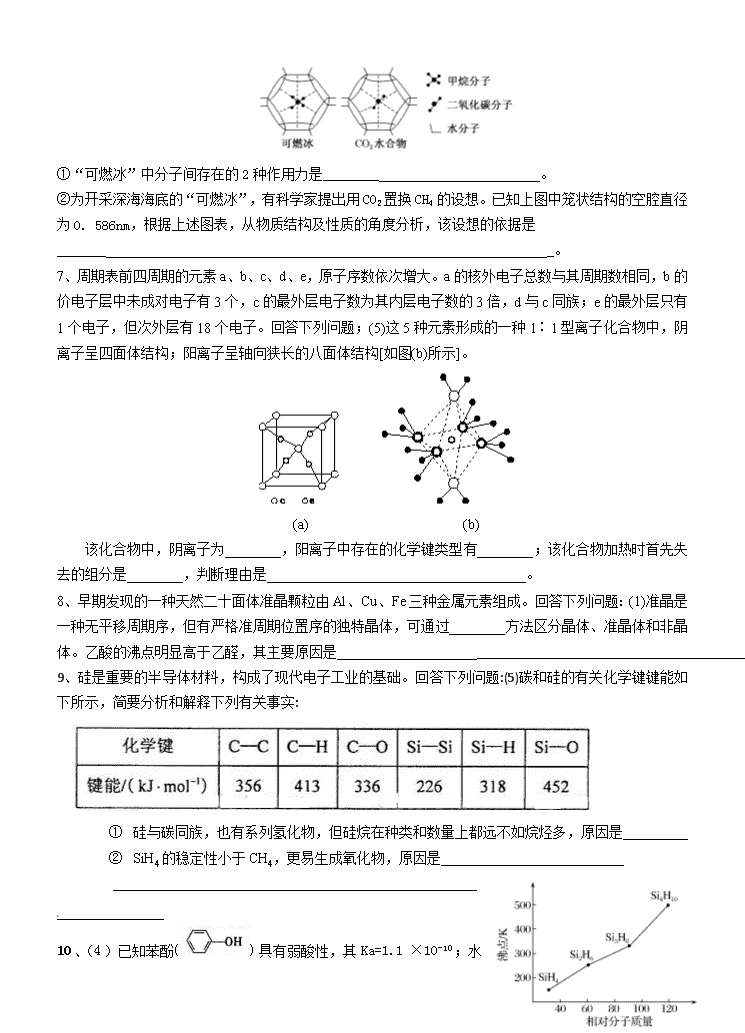
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
①“可燃冰”中分子间存在的2种作用力是________ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
_______ _。
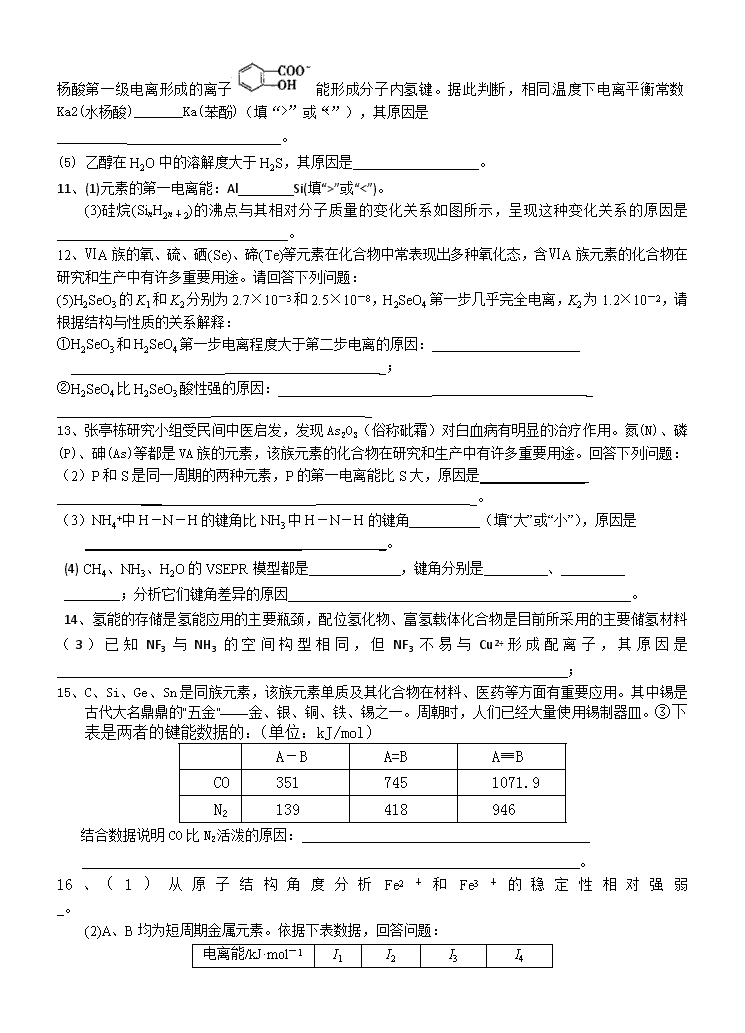
7、周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。
(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是_____________________________________。
8、早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。乙酸的沸点明显高于乙醛,其主要原因是____________________ 。
9、硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
① 硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
② SiH4的稳定性小于CH4,更易生成氧化物,原因是
10、(4)已知苯酚()具有弱酸性,其Ka=1.1 ×10-10
;水杨酸第一级电离形成的离子能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是
__________ 。
(5) 乙醇在H2O中的溶解度大于H2S,其原因是 。
11、(1)元素的第一电离能:Al________Si(填“>”或“<”)。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是_________________________________。
12、ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:________
______________________ _;
②H2SeO4比H2SeO3酸性强的原因:______________________ _
______________________ _
13、张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是_______________
_________________________ _。
(3)NH4+中H-N-H的键角比NH3中H-N-H的键角__________(填“大”或“小”),原因是_______________________________ _。
(4) CH4、NH3、H2O的VSEPR模型都是 ,键角分别是 、
;分析它们键角差异的原因 。
14、氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是____________________ ;
15、C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。其中锡是古代大名鼎鼎的“五金”——金、银、铜、铁、锡之一。周朝时,人们已经大量使用锡制器皿。③下表是两者的键能数据的:(单位:kJ/mol)
A-B
A=B
A≡B
CO
351
745
1071.9
N2
139
418
946
结合数据说明CO比N2活泼的原因:
。
16、(1)从原子结构角度分析Fe2+和Fe3+的稳定性相对强弱 _。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1
I1
I2
I3
I4
A
932
1 821
15 390
21 771
B
738
1 451
7 733
10 540
写出A原子的核外电子排布图________,Al原子的第一电离能________(填“大于”“小于”或“等于”)738 kJ·mol-1,原因是________________________________。
17、(1)硝酸和尿素的相对分子质量接近,但常温下硝酸为挥发性液体,尿素为固体,请解释原因:尿素分子间存在氢键,使其熔沸点升高,而硝酸分子内存在氢键,使其熔沸点降低
(2) H2O与CH3CH2OH可以任意比例互溶的原因:
_____________________________ _。
(3)硼酸晶体结构如图,晶体中存在的作用力有___________________;
加热时,硼酸的溶解度增大,主要原因是_________________________________
(4)金属 Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,
反应的离子方程式为______________________________________________ 。
18、(1)与H2O分子相比,OF2分子的极性更 (填“大”或“小”),原因是
。
(2)H2S键角比H2Se大的原因 。
(3)次硫酸结构式为H-O-S-O-H,该酸可能是 (填“强”或“弱”),易溶于 (填“水”或“汽油”)。
19、(1)FeO熔点比Fe2O3熔点 (填“高”或“低”),原因
(2)SO3的三聚体环状结构如图,较短的键为________(填图1中字母),原因是
(3)四氯化碳与水不互溶发生分层,四氯化硅与四氯化碳分子结构相似,但遇水极易发生水解反应,导致二者性质不同的原因是 。
(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P﹣Br键长,试用电离方程式解释PBr5熔体能导电的原因 。
20、(1)氮化铝熔点22000C,其晶体类型是 ,氮化硼的熔点比氮化铝高,其原因是 。
其晶胞结构如下,该晶体中存在配位键与共价键;判断晶体中有配位键的依据是
(2)硼酸(H3BO3)是一元弱酸,在水中电离时,硼酸结合水电离出的OH-生成[B(OH)4]-而呈酸性,不考虑空间构型,[B(OH)4]-中原子的成键方式用结构简式表示为 。
(3)1 mol NH4BF4(氟硼酸铵)含有________mol配位键。
21(2017•江苏-21)乙醇的沸点高于丙酮,这是因为 。
22(2017•新课标Ⅰ-35)基态原子中,核外电子占据最高能层的符号是___________,占据该能层电子的电子云轮廓图形状为_____________。和属于同一周期,且核外最外层电子构型相同,但金属
的熔点、沸点等都比金属低,原因是 。
23(2017•新课标Ⅱ-35)
元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量
称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如右图(a)
所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是
;
氮元素的E1呈现异常的原因是 。
24.(2017•新课标Ⅲ-11)研究发现,在CO2低压合成甲醇反应(CO2+3H2CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
,原因是
。
25.(2018全国I)Li+与H−具有相同的电子构型,r(Li+)小于r(H−),原因是______。
26、(2018全国II)右图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为 。
27、(2018全国III)[
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
28【2019全国1】
(3)一些氧化物的熔点如下表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/°C
1570
2800
23.8
−75.5
解释表中氧化物之间熔点差异的原因 。
29、【2019全国II】
元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比的________填“高”或“低”),其判断理由是________。
30、(2019全国III)
(3)苯胺()的晶体类型是__________。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________。
《物质的结构与性质》简答题答案
1、(2016·全国卷Ⅰ)
(2)Ge原子半径大,原子间形成的σ单键较长,p−p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键,不易形成双键或叁键。
(3)GeCl4、GeBr4、GeI4的熔沸点依次上升。因为都是分子晶体,其组成和结构相似的物质,随分子量增大,范德华力增大,熔沸点上升。
2 、(2016·全国卷Ⅱ) ③高于 氨气分子间存在氢键,分子间作用力强;
(3) Cu+核外电子排布呈全充满状态,比Ni+稳定,难以失去电子
3、(2016·全国卷Ⅲ)(4)GaF3是离子晶体,GaCl3是分子晶体,离子键比范德华力强;
4、(2015·全国卷Ⅰ)(2)C有4个价电子且半径较小,难以通过得或失电子达到稳定结构 (4)分子
5、(2015·全国卷II)(2)O3 都是分子晶体,O3的相对分子质量大,范德华力大,沸点高。
6、福建卷.2015.T31.(4)①氢键、范德华力 ②C02的分子直径小于笼状结构空腔直径,且与H20的结合能大于CH4
7、[2014·新课标全国卷Ⅱ] (5)SO 共价键和配位键 H2O
H2O与Cu2+的配位键比NH3与Cu2+的弱
8.[2014·新课标全国卷Ⅰ] (1)X射线衍射 CH3COOH存在分子间氢键
9.(2013·新课标卷I·37)(5)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂。导致长链硅烷难以生成
②C—H键的键能大于C—O键,C一H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
10.(2013·福建理综·31)
(5) H2O分子与C2H5OH分子间易形成氢键,而H2S与H2O分子间不能形成氢键
11、[2012·福建理综,30] (1) < (3)同是分子晶体,硅烷的相对分子质量越大,分子间范德华力越强(或其他合理答案)
12、[2012·课标全国理综,37]
(5)①第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
②H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2。H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,越易电离出H+
13、2016深圳一模37.(2)P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大(2分)。
(3)大(1分);NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤电子对(分析结构1分),孤电子对和成键电子对之间的排斥力强于成键电子对和成键电子对之间的排斥力(1分),导致NH4+中H-N-H的键角比NH3中大(共2分)。
(4)四面体形 109.50 1070 1050 CH4中键与键之间的排斥力一样,是正四面体,键角为109.50。而其他两个分子均有未成键的孤电子对,孤电子对间的排斥力>孤电子对与σ键电子对间的排斥力>σ键电子对间的排斥力。由于孤电子对成键电子的排斥作用,使得成键电子间夹角变小,H2O中有两对孤对电子,NH3中有一对孤对电子,固H2O中键角比NH3更小。
附: 价层电子对排斥力类型及大小:
孤电子对间 > 孤电子对~ σ键电子对 > σ键电子对间
原因:电子带负电,相互之间有排斥作用,σ键电子对受两原子束缚相互间斥力小,而孤对电子对只受一个原子束缚故相互间斥力大。
14.(2016校冲刺).(3)N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键。
15 岳阳原创③ CO中第一个π键的键能是326.9kJ/mol,N2中第一个π键的键能是528 kJ/mol,所以CO的第一个键比N2更容易断裂,所以CO比N2活泼。
16.(1)Fe2+:[Ar]3d6,Fe3+:[Ar]3d5,Fe3+的3d能级电子为半充满的稳定状态,故稳定性:Fe3+>Fe2+。
(2) 小于 由表中数据判断B为Mg,其最外层电子排布式为3s2,而Al最外层电子排布式为3s23p1,当3p处于全充满、半充满或全空时较稳定,因此,失去p能级的1个电子相对比较容易
17.(2)都是极性分子;H2O与CH3CH2OH可形成分子间氢键
(3)范德华力、氢键、共价键;加热破坏了硼酸分子之间的氢键
(4)H2O2具有强氧化性,可以将 Cu氧化为 Cu2+,氨分子与Cu2+可形成配离子,两者相互促进使反应得以进行Cu+H2O2+4NH3===[Cu(NH3)4]2++2OH-
18.(1)小 都是V形分子,且孤电子对均为2,F与O的电负性差值小于H与O电负性差值,导致正负电荷中心偏离程度减小。
(2)电负性S大于Se,共用电子对离S近,共用电子对间的排斥力大 (3)弱酸 水
19.(1)低 Fe2+半径比Fe3+大,电荷数小,FeO的晶格能较小
(2)b 形成b键的氧原子与两个硫原子结合,作用力较小。
(3)硅原子有3d空轨道,而碳原子没有d空轨道(因为没有2d),不能接受氧原子的孤对电子,所以四氯化硅能水解而四氯化碳不能水解。
(4)PBr5== PBr4+ + Br -
20.(1)原子晶体;同为原子晶体,硼原子半径小于铝原子半径,氮化硼中共价键键能较大
氮化铝晶体中,每个铝原子与4个氮原子结合,而铝原子只有3个价电子,需提供1个空轨道形成配位键以达到8电子对稳定结构。
(2) (3)2
21.乙醇分子间存在氢键 ⑸Fe3CuN
22. N ; 球形; K的质子数较少,半径较大,原子核对最外层电子的束缚作用较Cr更弱,形成的金属键较弱,导致熔沸点较低。
23同周期从左到右核电荷数依次增大,半径逐渐减小,故结合一个电子释放出的能量依次增大 N的2p能级处于半充满状态,相对稳定,不易结合电子。
24. ⑶H2O>CH3OH>CO2>H2 常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高。
25. Li+核电荷数较大
26、S8相对分子质量大,分子间范德华力强
27、(2)大于 Zn核外电子排布为全满稳定结构,较难失电子
(3)离子键 ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主、极性较小
28、Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2
29三角锥形;低; NH3分子间存在氢键
30(3)分子晶体 苯胺分子之间存在氢键