- 3.91 MB
- 2021-05-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高三理综第 1 页(共 16 页)
延庆区 2018—2019 学年度模拟考试试卷
高三理综
第Ⅰ卷(选择题共 120 分)
本卷共 20 小题,每小题 6 分,共 120 分。在每小题列出的四个选项中,只有一个是
正确的,请选出符合题目要求的一项。
可能用到的相对原子质量: H-1 O-16 N-14 Cu-64
1. 下列结构中所含化学成分相同的一组是
A. 纺锤体、细胞膜 B. 核糖体、HIV 病毒
C. 质粒、染色体 D. 中心体、叶绿体
2. 某生物细胞周期中的三个阶段(用①、②、③表示)示意图如下,每个阶段内绘有相
应的流式细胞仪分析图谱,据图分析判断下列错误的是
A. 一个细胞周期可表示为①→②→③过程
B. DNA 复制发生在①阶段且易发生基因突变
C. 着丝点分裂和染色体加倍发生在②阶段
D. ③阶段的细胞可能是刚刚完成分裂的细胞
3. 研究者发现日光照射实验动物皮肤后会使血液里的化学物质(UCA)含量大幅增加,
且 UCA 可进入大脑神经细胞内并转化成谷氨酸。细胞内的谷氨酸在运动皮层以及海马
区的神经末梢释放,并能激活相关的脑内神经环路,从而增强运动学习能力以及物体
识别记忆能力。根据以上资料可推断出
A. 谷氨酸不再是细胞内合成蛋白质的原料
B. 谷氨酸可作为一种参与神经调节的神经递质
C. 光照会使实验动物对环境的适应能力降低
D. UCA 在细胞外液中转化成谷氨酸后参与神经调节
2019 年 3 月
注:横坐标表示 DNA 量
纵坐标表示细胞数量
阴影表示处于该阶段细胞
高三理综第 2 页(共 16 页)
4. 下列实验材料或用品选择恰当的是
A. 鉴定可溶性还原糖——双缩脲试剂
B. DNA 的粗提取和鉴定——新鲜牛血
C. 用 PCR 仪对 DNA 分子扩增——DNA 连接酶
D. 鉴定纤维素分解菌——刚果红指示剂
5. 大蓝蝶幼虫分泌的蜜汁是红蚁最喜欢的食物,红蚁发现大蓝蝶幼虫后会将其带回蚁
巢,和同类一起分享其分泌的蜜汁,蜜汁被吃完后,大蓝蝶幼虫会散发出红蚁的气
味和声音,让红蚁误认为它是自己的同类,大蓝蝶幼虫就可以在蚁巢内走动且大吃
红蚁卵和幼虫,并躲避天敌。下列有关叙述错误的是
A. 红蚁有助于大蓝蝶幼虫避开与其它蝴蝶幼虫的竞争
B. 大蓝蝶幼虫和红蚁两者是相互选择的结果
C. 大蓝蝶可以在没有红蚁的地方繁衍后代
D. 大蓝蝶幼虫与红蚁之间存在着捕食关系
6.化学技术在社会发展中起着十分重要的作用,下列应用过程中不涉及化学反应的是
A.现代中药纳米粉碎 B.火力发电 C.高炉炼铁 D.生活中用暖宝宝取暖
7.下列事实不能用元素周期律解释的是
A.Si 与 H2 高温时反应,S 与 H2 加热能反应
B.K 与水的反应比 Na 与水的反应更剧烈
C.SO2 与 NaHCO3 溶液反应生成 CO2
D.常温下,Na2SO4 溶液的 pH=7,Al2(SO4)3 溶液的 pH<7
8.下列化学用语解释事实或过程正确的是
A. Fe3O4 溶于过量稀硝酸中:Fe3O4 + 8H+ =2Fe3+ + Fe2+ + 4H2O
B. 乙酸和乙醇的酯化反应:
CH3CH2OH+CH3CO18OH CH3CO18OCH2CH3 +H2O
C. 用足量氨水吸收烟气中的二氧化硫:SO2 + 2OH- = SO32- + H2O
D. 向少量 Mg(OH)2 悬浊液中加入适量的饱和 NH4Cl 溶液,固体溶解:
Mg(OH)2+2NH4+ Mg2++2NH3·H2O
高三理综第 3 页(共 16 页)
10 滴 0.1 mol·L-1
AgNO3溶液
0.1 mol·L-1 NaCl
溶液至不再产生
沉淀
10 滴 0.1
mol·L-1
KI 溶液
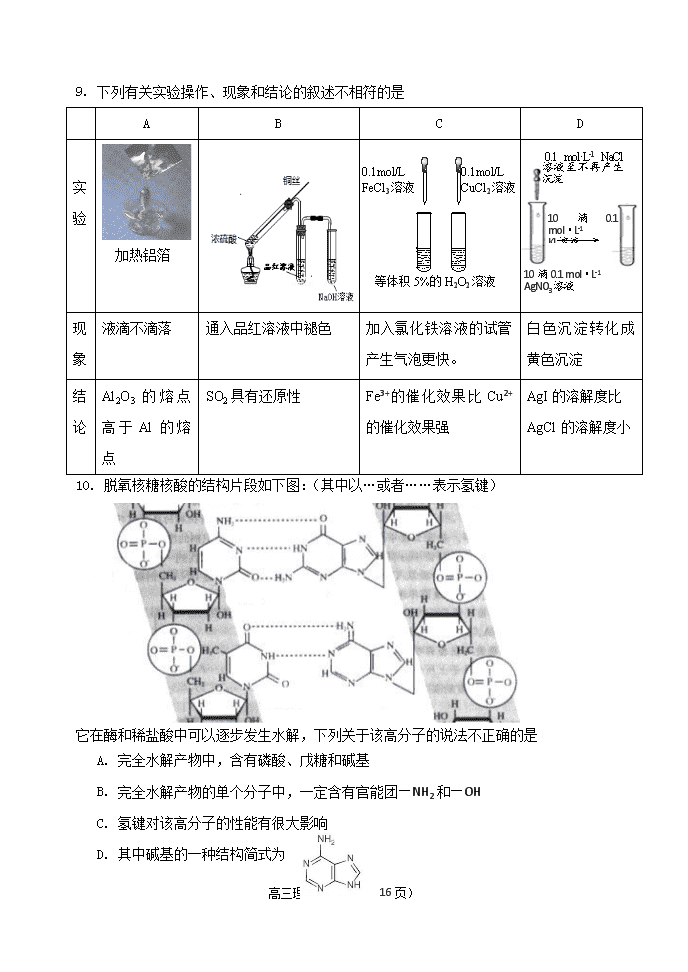
9. 下列有关实验操作、现象和结论的叙述不相符的是
A B C D
实
验
现
象
液滴不滴落 通入品红溶液中褪色 加入氯化铁溶液的试管
产生气泡更快。
白色沉淀转化成
黄色沉淀
结
论
Al2O3 的 熔 点
高 于 Al 的 熔
点
SO2 具有还原性 Fe3+的催化效果比 Cu2+
的催化效果强
AgI 的溶解度比
AgCl 的溶解度小
10. 脱氧核糖核酸的结构片段如下图:(其中以…或者……表示氢键)
它在酶和稀盐酸中可以逐步发生水解,下列关于该高分子的说法不正确的是
A. 完全水解产物中,含有磷酸、戊糖和碱基
B. 完全水解产物的单个分子中,一定含有官能团—NH2 和—OH
C. 氢键对该高分子的性能有很大影响
D. 其中碱基的一种结构简式为
等体积 5%的 H2O2 溶液
0.1mol/L
FeCl3 溶液
0.1mol/L
CuCl2 溶液
加热铝箔
高三理综第 4 页(共 16 页)
11. 室温下,将 0.05 mol Na2CO3 固体溶于水配成 100 mL 溶液,向溶液中加入下列物质,有
关结论正确的是
A. 加入 50 mL 1 mol·L-1H2SO4,反应结束后,c(Na+)=c(SO42-)
B. 加入 0.05 mol CaO,溶液中 减小
C. 加入 50 mL H2O,由水电离出的 c(H+)·c(OH-)增大
D. 加入 0.1 mol NaHSO4 固体,反应完全后,溶液呈中性
12. 某同学用 KSCN 溶液和 FeCl2 溶液探究 Fe2+的还原性时出现异常现象,实验如下:
① ② ③
溶液变红,大约 10 秒左右红
色褪去,有气体生成(经检验
为 O2)。取褪色后溶液,滴加
盐酸和 BaCl2 溶液,产生白色
沉淀
溶液变红且不褪色,有气体
生成(经检验为 O2),经检
验有丁达尔效应。
溶液变红且不褪色,滴加盐
酸和 BaCl2 溶液,无白色沉
淀,经检验无丁达尔效应。
下列说法不正确的是
A.对比①③,可以判定酸性条件下H2O2可以氧化SCN-
B.实验②中发生的氧化还原反应有两种
C. ②中红色溶液中含有Fe(OH) 3胶体
D.③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O
高三理综第 5 页(共 16 页)
13.下列核反应方程中,属于 α 衰变的是
A.
B.
C.
D.
14.飞机从地面由静止起飞,随后在高空飞行,乘客小明随身携带了一个茶杯,以下说
法中正确的是
A.飞机飞行的速度越大,组成茶杯的分子平均动能越大
B.飞机飞行的高度越高,组成茶杯的分子势能越大
C.倒入热水后的茶杯温度升高,组成茶杯的每个分子速率都会增大
D.倒入热水后的茶杯温度越高,组成茶杯的分子热运动越剧烈
15.m、n 两种单色光以相同的入射角和入射点从空气斜射向长方形玻璃砖,其光路如图
所示。关于 m、n 两种单色光,下列说法正确的是
A.玻璃砖对 m 光的折射率较小
B.m 光的光子能量较小
C.对同一双缝干涉装置,m 光的干涉条纹间距较小
D.m 光在该玻璃中传播的速度较大
16.如图所示,一个匝数为 n 的圆形线圈,面积为 S,电阻为 r。将其两端 a、b 与阻值
为 R 的电阻相连接,在线圈中存在垂直线圈平面向里的磁场区域,磁感应强度 B 随时
间 t 均匀增加,当 时线圈中产生的感应电流为 I1;当 时,其他条件不
变,线圈中产生的感应电流变为 I2。则通过电阻 R 的电流方向及 I1 与 I2 之比分别为
A.c→d,I1:I2=1:2
B.c→d,I1:I2=2:1
C.d→c,I1:I2=2:1
D.d→c,I1:I2=1:2
a
d
c
b
R
n m
nm
高三理综第 6 页(共 16 页)
17.在平静的水面上激起一列水面波,使漂浮在水面上沿传播方向相距 6.0m 的小树叶 a
和 b 发生振动,当树叶 a 运动到上方最大位移处时,树叶 b 刚好运动到下方最大位移
处,经过 1.0s 后,树叶 a 的位移第一次变为零.则该波的波速可能是
A.1.5m/s B.2m/s C.3m/s D.6m/s.
18.蹦极是一项富有挑战性的运动,运动员将弹性绳的一端系在身上,另一端固定在高
处,然后运动员从高处跳下,如图所示。图中 a 点是弹性绳自然下垂
时绳下端的位置,c 点是运动员所到达的最低点。在运动员从 a 点到 c
点的运动过程中,忽略空气阻力,下列说法正确的是
A.运动员的速度一直增大
B.运动员的加速度始终减小
C.运动员始终处于失重状态
D.运动员克服弹力做的功大于重力对运动员做的功
19.如图所示是演示自感现象的电路图,关于此实验,下列说法正确的是
A.通电稳定后,断开开关时灯泡 A 逐渐熄灭,灯泡 B 立刻熄灭
B.变阻器 R 的作用是在接通开关时使灯泡 B 逐渐变亮
C.如果灯泡 B 短路,接通开关时灯泡 A 立刻变亮
D.如果灯泡 A 短路,接通开关时通过 L 的电流逐渐增大
20. 2016 年我国成功发射首颗微重力实验卫星——实践十
号,可以达到 10-6g 的微重力水平(10-6g 其实指的是加速
度),跻身世界先进行列。在太空中不是应该引力提供向
心力而完全失重吗?微重力的来源之一是“引潮力”。引
潮力较为复杂,简单说来是由于卫星实验舱不能被看作
质点造成的,只有在卫星的质心位置引力才恰好等于向心力。假设卫星实验舱中各点
绕地球运动的角速度相同,请根据所学知识判断下列说法中正确的是
A. 在卫星质心位置下方(靠近地心一侧)的物体微重力方向向上(远离地心一侧)
B. 在卫星质心位置上方的物体微重力方向向上
C. 处在卫星质心位置的物体所受合力为零
D. 在卫星质心位置上方的物体所受引力大于向心力
L
R B
A
高三理综第 7 页(共 16 页)
第 II 卷(非选择题共 180 分)
21.(18 分)伏安曲线是非线性电路元件的基本参数。某实验小组描绘规格为“2.5V
0.6W”的小灯泡的伏安特性曲线。实验室提供下列器材:
A.电流表 A1(量程为 0-300mA,内阻约 1Ω)
B.电流表 A2(量程为 0-0.6A,内阻约 0.5Ω)
C.电压表 V(量程为 0-3V,内阻约 5kΩ)
D.滑动变阻器 R1(0-10Ω,额定电流 1.5A)
E.滑动变阻器 R2(0-1kΩ,额定电流 0.6A)
F.直流电源(电动势 3V,内阻不计)
G.开关一个、导线足够
( 1) 本 实 验 电 流 表 应 选 择 ______( 填 A 1 或 A2) ; 滑 动 变 阻 器 应 选 择 ______
( 填
R1 或 R2) 。
(2)在图(甲)虚线框中画出电路图。
(3)根据实验数据,画出小灯泡的 I-U 特性曲线如图(乙)所示。图线发生弯曲,其
原因是_________________________________;根据图线,小灯泡两端电压为 1.50V
时,其实际电阻为______Ω,功率 P 约为______W(结果保留 2 位有效数字)。
(4)如果实验室只提供量程为 0—2V,内阻为 2000Ω 的电压表,需要将其改装为量程是
0—3V 的电压表,则需要 联(填“串”或“并”)一个 Ω 的电阻。
(5)由图(乙)曲线推断电阻随电压变化曲线与下图哪一个比较接近( )
U
R
A
U
R
B
U
R
C
U
R
D
1.00 1.50 2.00 2.50
U/V
(乙)
0.50
0
0.05
0.10
0.15
0.20
0.25
0.30
I/A
0(甲)
高三理综第 8 页(共 16 页)
22.(16 分)如图所示,MN 是半径为 R=0.8m 的竖直四分之一光滑圆弧轨道,竖直固定
在水平桌面上,轨道末端处于桌子边缘并与水平桌面相切于 N 点。把一质量为 m=1kg 的
小球 B 静止放于 N 点,另一完全相同的小球 A 由 M 点静止释放,经过 N 点时与 B 球发
生正碰,碰后粘在一起水平飞出,落在地面上的 P 点。若桌面高度为 h=0.8m,取重力加
速度 g=10m/s²。不计阻力,小球可视为质点。求:
(1)小球 A 运动到 N 点与小球 B 碰前的速度 v0 的大小
(2)小球 A 与小球 B 碰后瞬间的共同速度 v 的大小
(3)P 点与 N 点之间的水平距离 x
23.(18 分)核聚变是能源的圣杯,但需要在极高温度下才能实现,最大难题是没有任何
容器能够承受如此高温。托卡马克采用磁约束的方式,把高温条件下高速运动的离子约
束在小范围内巧妙实现核聚变。相当于给反应物制作一个无形的容器。2018 年 11 月 12
日我国宣布“东方超环”(我国设计的全世界唯一一个全超导托卡马克)首次实现一亿度
运行,令世界震惊,使我国成为可控核聚变研究的领军者。
(1)2018 年 11 月 16 日,国际计量大会利用玻尔兹曼常量将热力学温度重新定义。玻尔
兹曼常量 k 可以将微观粒子的平均动能与温度定量联系起来,其关
系式为 ,其中 k=1.380649×10-23J/K。请你估算温度为一亿
度时微观粒子的平均动能(保留一位有效数字)。
(2)假设质量为 m、电量为 q 的微观粒子,在温度为 T0 时垂直进
入磁感应强度为 B 的匀强磁场,求粒子运动的轨道半径。
(3)东方超环的磁约束原理可简化如图。在两个同心圆环之间有很
强的匀强磁场,两圆半径分别为 r1、r2,环状匀强磁场围成中空区域,
中空区域内的带电粒子只要速度不是很大都不会穿出磁场的外边
缘,而被约束在该区域内。已知带电粒子质量为 m、电量为 q、速度
为 v,速度方向如图所示。要使粒子不从大圆中射出,求环中磁场的磁感应强度最小值。
24.(20 分)如图,水平面上有两根足够长的光滑平行金属导轨,导轨间距为 l,电阻不
计。左侧接有定值电阻 R。质量为 m、电阻为 r 的导体杆,以初速度 v0 沿轨道滑行,在
滑行过程中保持与轨道垂直且接触良好。整个装置处于方向竖直向上,磁感应强度为 B
的匀强磁场中。
宏观规律与微观规律有很多相似之处,导体杆速度的减小规律类似于放射性元素的
半衰期,理论上它将经过无限长的时间衰减完有限的速度。
(1)求在杆的速度从 v0 减小到 的过程中
a. 电阻 R 上产生的热量
b. 通过电阻 R 的电量
(2)a.证明杆的速度每减小一半所用的时间都相等
b. 若杆的动能减小一半所用时间为 t0,则杆的动量减小一半所用时间是多少?
3
2kE kT=
0
2
v
r1
r2
v
v0 B
R
高三理综第 9 页(共 16 页)
25.(17 分)镇痛药物 J 的合成方法如下:
已知:
(1)B 的官能团为_________________ 。
(2)反应①的化学方程式 。
(3)F 的结构简式 。
(4)G→J 的反应类型 。
(5)C→D 的化学反应方程式 。
(6)有机物 K 分子组成比 F 少两个氢原子,符合下列要求的 K 的同分异构体有____种,
写出其中两种取代基不同的结构简式即可 、 。
A.遇 FeCl3 显紫色 B.苯环上有两个取代基
(7)已知: ,R1、R2 为烃基。
是一种重要的化工中间体。以环已醇( )和乙醇为起始原料,
结合己知信息选择必要的无机试剂写出 合成路线(用结构简式表
R1HC=CHR2 R1COOH+R2COOHKMnO4/H+
高三理综第 10 页(共 16 页)
示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
26.(12 分)CO2 的捕集和利用因为其工业价值和减少 CO2 排放的环境意义而受到广泛关注。
(1)下列物质中可以作为 CO2 捕获剂的是______。
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2 E.(NH4)2CO3
(2)在 Cu/ZnO 催化剂条件下,CO2 与 H2 可生成 CH3OH,CO2(g)+3 H2(g)
CH3OH(g)+H2O(g) ΔH1 = - 53.7 kJ.mol-1 。科研人员提出了该催化反应历程的
示意图如下,其中 CO 是重要的中间产物。
已知:第一步反应 I:CO 2(g)+ H 2 (g) CO(g)+H2O(g) ΔH2 = +
41kJ.mol-1
①第二步反应的热化学方程式是 。
②CO2 与 H2 生成 CH3OH 反应的平衡常数表达式 K = 。
③下图是其他条件一定时,反应温度对CO2平衡转化率影响的曲线
请 结 合 化 学 用 语 说 明 温 度 低 于 350 ℃ 时 , CO2 的 平 衡 转 化 率 随 温 度 变 化 的 原 因
是 。
(3)O2 辅助的 Al—CO2 电池工作原理如图所示。该电池电容量大,能有效利用 CO2。电
池反应产物 Al2(C2O4)3 是重要的化工原料。电池原理如下:
①O2 作为正极反应的催化剂,可能的催化过程如下。
将 i 补充完整,并写出 ii 的离子方程式。
i.O2+
高三理综第 11 页(共 16 页)
ii. 。
②结合电极反应式简述 Al2(C2O4)3 的生成 。
27.(12 分)纳米铜是一种性能优质的超导材料,以辉铜矿(主要成分为 Cu2S)为原料制备
纳米铜粉的工艺流程如图所示。
资料:肼(N2H4)无色油状液体,溶于水生成水合肼 N2H4·H2O(水合肼有强还原性,生
成无污染物质,易挥发)
(1)①上述流程中可以加快反应速率的措施有 。
A. 过滤和萃取 B. 升高温度 C. 增大压强 D. 研磨矿石
②用 FeCl 3 溶液浸取辉铜矿中铜元素的反应为:Cu2S+4FeCl3=2CuCl2+4FeCl2+S。
浸取时,在有氧的环境下可维持 Fe3+较高浓度,有关反应的离子方程式为
_______。
(2)“萃取”时,两种金属离子萃取率与 pH 的关系如图所示。当 pH>1.7 时,pH 越大,
金属离子萃取率越低,其中 Fe3+萃取率降低
的原因是_____________________。
(3)“反萃取”得到的 CuSO4 溶液制备纳米铜粉时,Cu2+的
还原率随 pH 和温度的变化如下表所示:
①该反应的离子方程式为 。
②超过 70℃时 Cu2+的还原率降低的原因是 。
pH 6 7 8 9 10 11 12
Cu2+还原率(%) 34 60 90 92 95 92 90
产物形态 砖红色 Cu2O 铜粉 紫黑色纳米铜
温度 30 40 50 60 70 80 90
Cu2+还原率(%) 25 45 70 80 95 90 85
产物形态 砖红色 Cu2O 铜粉 紫黑色纳米铜
油相 2
反萃取
水相 2
水相 11
油相 1
萃取滤液 萃取剂
浸取
过滤
滤渣
纳米铜粉
FeCl3 溶
液
制铁红氨水
调节 pH=10
辉铜矿
稀硫酸
N2H4 溶液
调 pH=1.7
金属离子萃取率 %
Fe3+
高三理综第 12 页(共 16 页)
③以辉铜矿为原料制备纳米铜粉的工艺条件选择 70℃、pH=10 的理由是 。
(4)“水相 1”中加入适量氨水,静置,再经过滤、_____、干燥、____等操作可得到
Fe2O3 。
(5)假设制得纳米铜的质量为 a kg,则最少投入肼的物质的量是 。
28.(13 分)某实验小组在电压 12V 电流 3A 的条件下电解 2mol/L 的氯化铜溶液并探究
其产物的性质。
(1)根据电解原理,预测:阴极发生的实验现象是 。
阳极发生的电极反应式为 。
电解氯化铜溶液总的化学方程式为 。
(2)小组同学在实际电解过程中,意外的观察到下表的实验现象:
条 件 电极 现 象
阴极 3min 后,附近溶液变成棕褐色。30min 后,溶液变成深棕褐
色。电极底部表面有少量红色金属生成,还有少量白色物质。电压 12V
电流 3A
阳极 开始出现少量气泡,后来气泡增多。
实验小组学生对阴极区产生异常现象的原因进行了探究:
资料 1:CuCl 是白色的难溶物,用 Cu 还原 CuCl2 溶液可以得到 CuCl 沉淀,它易溶于
浓盐酸,用水稀释 CuCl 的浓盐酸溶液则又析出 CuCl 白色沉淀。
资料 2:[CuCl2. CuCl2(H2O)]-(棕褐色) CuCl+Cu2++3Cl-+ H2O。
Ⅰ.探究阴极表面产生的白色物质:
① 根据资料写出 Cu 还原 CuCl2 溶液反应的化学方程式 。
② 学生为了确定阴极产物进行实验 A:取 2mol/L 的 CuCl2 溶液,加入铜粉,充分振
荡,几分钟后,试管底有白色沉淀生成,过滤出白色固体,加入浓盐酸,固体
溶解,加水稀释,又析出白色沉淀。
如果要确认阴极产生的白色沉淀是 CuCl,还需要进行对照实验 B,该实验的设
计方案是 。
高三理综第 13 页(共 16 页)
实验结论:通过实验 A 和实验 B 的对比,可以确定阴极产生的白色固体是 CuCl。
Ⅱ.探究阴极区域溶液呈现棕褐色的原因:
猜想 1:可能是 Cu2+与高浓度的 Cl-发生络合反应所致。
实验 C:向 2mol/L 的 CuCl2 溶液中加入 ,溶液呈现绿
色,没有变成棕褐色。
实验结论:溶液颜色呈现棕褐色 (填“是”或者“不是”)由于 Cu2+
与高浓度的 Cl-发生络合反应所致。
猜想 2:棕褐色溶液可能与+1 价 Cu 有关。
实验 D:用铜粉和 2mol/L 的 CuCl2 溶液反应制备[CuCl2. CuCl2(H2O)]-,取少量该标准
溶液与实验中得到的棕褐色溶液进行对照实验。
步骤一:配制标准[CuCl2. CuCl2(H2O)]-棕褐色溶液进行稀释,实验流程如图所示:
步骤二:取阴极附近的棕褐色溶液,重复上述实验进行对照:请画出对照实验的
流程图:
实验结论:通过对照实验,确认棕褐色溶液与+1 价 Cu 有关。
铜丝
拔出铜丝
白色固体白色沉淀2mL2mol/LCuCl2 溶液 深棕褐色溶液
先产生白色沉淀,后溶解
溶液呈深棕褐色
加入 6mL 蒸馏水 过滤、洗涤
保留固体
滴加浓盐酸
沉淀溶解
高三理综第 14 页(共 16 页)
29.(16 分)研究人员发现一种短根白化突变体水稻 sra1,利用该突变体可以深入研究植
物叶绿体发育和光合作用的调控机制。
(1)比较长势一致且生长状况良好的野生型水稻 WT 和突变体水稻 sra1 植株,在适宜条件
下测定光合参数,结果见下表。
水稻品种 净光合速率
(µmolm-2s-1)
气孔导度
(molm-2s-1)
胞间 CO2 浓度
(µmolm-1)
WT 11.77 0.30 298.44
sra1 ‒3.61 0.18 424.52
二氧化碳的固定量直接反映植物光合作用过程中的_________反应速率,净光合
速率为负值表明____________________________。据上表分析,sra1 净光合速率的
显著降低________(填“是”或“不是”)由摄入二氧化碳量变化引起。
(2)对 WT 和 sra1 水稻植株相同位置的叶片进行观察,结果如图 1 所示,与 WT 相比 sra1
植株_______体积明显增大;叶绿体明显变少或没有,且内部的_____________松散或
发育不完整。
(3)利用分光光度计对 WT 和 sra1 水稻植株进行光合色素含量的测定,发现 sra1 植株中
叶绿素 a、叶绿素 b 和类胡萝卜素含量都接近于零,这与上述细胞结构变化及光合作
用特征________(填“一致”或“不一致”)。
(4)研究发现过氧化氢酶(CAT)参与水稻细胞内有害物质(超氧自由基)的分解,膜脂
过氧化物(MDA)的增多会加剧膜的损伤。图 2 为 WT 和 sra1 中上述两种物质相对含
图 1
1.叶绿体 2.液泡 3.基粒 4.类囊体 5.间质类囊体
A、B 为野生型植株 C、D 为 sra1 植株
1.叶绿体 2.液泡 3.基粒 4.类囊体 5.间质类囊体
A、B 为野生型植株 C、D 为 sra1 植株 图 1
高三理综第 15 页(共 16 页)
量的测定结果,sra1 中 CAT 的含量比 WT_______,可能使超氧自由基含量_______,
会加速 MDA 的合成,造成________膜结构的损伤,从而导致 sra1 净光合速率下降。
(5)综上所述,sra1 植株白化的根本原因可能是__________________________。此外,
该突变体根明显变短,所以对________________,加剧水稻净光合速率的降低。
30.(19 分)为研究野生型拟南芥抗盐机理,研究人员利用 T-DNA 插入拟南芥基因组中,
得突变体 Y。
(1)种植野生型拟南芥,将地上部分浸入_____________菌悬浮液中以实现转化,该菌的
T-DNA 上需带有抗除草剂基因以便筛选。在适宜条件下培养,收获种子(称为 T1 代)。
(2)假设所处理植株为 T-DNA 单拷贝插入,则 T1 代植株自交后所结种子中具有抗除草
剂性状的占_________。继续种植具有抗除草剂性状的种子,长成植株后进行自交,
若____________________,表明获得了纯合的转基因突变体植株 Y。
(3)野生型拟南芥的抗盐性状与 D 基因密切相关,T-DNA 插入到 D 基因中,致使该基
因失活,失活后的基因记为 d。收集上述突变体 Y 叶片并提取 DNA,分别用引物
“LB+RP”组合及“LP+RP”组合进行 PCR 扩增。已知插入完整 T-DNA 后,“LP+RP”不
能完成 PCR 扩增如图 1。检测扩增结果中,若__________________________,则相
应植株的基因型为 Dd;若_____________________,则相应植株的基因型为 dd。
图 1 图 2
(4)研究人员收集 7 个突变体的叶片,提取叶片总 mRNA,并逆转录为 cDNA,利用特异
性引物进行 PCR 扩增,结果如图 2。基因 actin 在拟南芥中表达相对稳定,作为本
实验的____________,结果表明_____号植株因 T-DNA 的插入,D 基因完全沉默。
(5)将野生型和突变体种子消毒后,分别播种于含有不同浓度 NaCl 培养基中,观察种
子萌发情况,结果见图 3。
高三理综第 16 页(共 16 页)
由图3可知,在不含 NaCl 的培养基上,野生型和突变体种子的萌发率
____________;随着 NaCl 浓度的升高,突变体种子的萌发率明显_________。
(6)野生型在高浓度 NaCl 胁迫下,脱落酸(ABA)含量增加,并迅速参与到抗胁迫的
反应中。突变体 D 基因由于 T-DNA 的插入不能正常表达,导致突变体的抗盐性下
降,由此推测 D 基因抗盐作用的机理是_____________________________。
31.(15 分)α-syn 是一种神经细胞突触核蛋白,正常情况下以可溶的单体形式存在,当
其聚集成不溶性寡聚体(α-syn PFF)时,可引起神经元细胞死亡,导致帕金森病。
(1)科研人员用 α-突触核蛋白寡聚体(α-syn PFF)处理小鼠脑细胞,连续观察 14 天,
发现细胞内的 PARP1 蛋白增多,有些脑细胞开始死亡,可初步假设 α-syn PFF 使脑
细胞死亡的机理为__________________________________。
(2)研究人员用 α-syn PFF 和三种 PARP1 抑制剂(ABT,AG,BMN)处理小鼠脑细胞,
一段时间后测定脑细胞的死亡率,结果见下图。
据上图可知 PARP1 抑制剂能______α-syn PFF 对脑细胞的致死效应,且______
抑制剂的作用效果最显著,实验结果________(填“支持”或“不支持”)上述假说。
(3)为了在活哺乳动物中进一步进行验证,研究人员将 α-syn PFF 注射到正常小鼠和缺
乏 PARP1 基因的小鼠的大脑中。如缺乏 PARP1 的小鼠脑细胞比正常小鼠脑细胞_____
__________________,则能验证 PARP1 的作用。
(4)PARP1 引起神经细胞死亡的作用机理如下图所示。
据上图可知,α-syn PFF 激活 NO 合成酶,NO 含量增加造成 DNA 损伤,过度
α-syn PFF
PARP1 抑制
剂
高三理综第 17 页(共 16 页)
激活 PARP1。在 PARP1 存在时会导致神经元产生__________,从而导致细胞死亡。
另外 PAR 通过核孔,在_________中与 α-syn PFF 结合,________(填“促进”或“抑制”)
α-syn PFF 积聚,加剧细胞死亡。
(5)综上分析,你对治疗帕金森病提出合理的治疗方案_________________________。
2019 延庆区一模物理参考答案
一、选择题
题号 13 14 15 16 17 18 19 20
答案 B D C A C D D B
二、实验题
21 题
1) A1,R1 (每空 2 分,共 4 分)
2) 如图 (2 分)
3) 金属电阻率随温度升高而增大 7.5,0.30
(每空 2 分,共 6 分)
4) 串,1000 (每空 1 分,共 2 分)
5) D (4 分)
三、计算题
22 题 解:(1)mgR=mv02/2 ------------------3 分
v0=4m/s ----------------------2 分
(2)mv0=2mv ---------------------3 分
v=2m/s ---------------------2 分
(3) h=gt2/2 ---------------------2 分
x=vt ---------------------2 分
x=0.8m ---------------------2 分
V
A
高三理综第 18 页(共 16 页)
23 题 解:(1) --------------- 4 分
(2) ---------------2 分
---------------2 分
---------------2 分
(3)磁场最小时粒子轨迹恰好与大圆相切,如图所示 --------------- 2 分
设粒子轨迹半径为 r,由几何关系得
---------------2 分
解得
由牛顿第二定律 --------------- 2 分
解得 --------------- 2 分
-153 2 10 J2kE kT= ≈ ×
2 2 2
2 1( )r r r r− = +
2 2
2 1
22
r rr r
−=
2vqvB m r
=
( )2
2 2
2 1
2r mvB
q r r
=
−
r1 r2
r
高三理综第 19 页(共 16 页)
24 题 解:(1)a. 设电路产热为 Q,由能量守恒
------------------2 分
串联电路中,产热与电阻成正比,可得
-----------------2 分
解得 电阻 R 产热为 -----------------1 分
b. 设该过程所用时间为 t,由动量定理
或: ,其中 -----------------3 分
(用求和方式表示亦可)
解得 通过 R 的电量为 -----------------1 分
(2)a. 某时刻杆的速度为 v(从 v0 开始分析亦可),则
感应电动势 ,感应电流 ,安培力 ----------------- 2
分
在很短时间∆t 内,由动量定理 ,( 为速度变化绝对值)
可得 -----------------2 分
所以在任意短时间内速度变化的比例为
由于 为定值,所以任何相等时间内速度变化的比例都相等。
所以从任何时刻开始计算,速度减小一半所用时间都相等。 -----------------2 分
b. 动能减小一半,速度 v 减小为 -----------------1 分
由 a 中分析可得,速度从 再减小到 所用时间仍为 t0 -----------------2 分
所以速度减小一半所用时间为 2t0 ,动量减小一半所用时间也为 2t0 -----------------2 分
方法或表述不同,分析正确均可得分
2 20
0
1 1 ( )2 2 2
vmv m Q= +
R
RQ QR r
= +
2
03
8( )R
RmvQ R r
= +
0
0( )2
vBIlt m v= − It q=
0
2
mvq Bl
=
E Blv= EI R r
= +
2 2B l vF BIl R r
= = +
F t m v∆ = ∆ v∆
2 2B l v t m vR r
∆ = ∆+
2 2
( )
v B l tv m R r
∆ = ∆+
2 2
( )
B l
m R r+
2
v
2
v 1
2 2
v ×
高三理综第 20 页(共 16 页)
2019 年延庆高三理综模拟化学学科参考答案
6.A 7.C 8.D 9.B 10.B 11.D 12.B
25.(17 分)
(1)氯原子 碳碳双键(2 分),(2)CH2=CH-CH2Cl + NH3 → CH2=CH-CH2 NH2+HCl(2 分),
(3) (2 分),(4)取代反应 (2 分),
(5)
(2 分)
(6)15 种 (2 分)
(每个 1 分,共 2 分)
(7)(3 分)
26. (12 分)(1)BDE(2 分)
(2)① CO(g)+ 2H2(g) CH3OH(g) ΔH2= -94.7 kJ·mol-(2 分)
②略(1 分)
高三理综第 21 页(共 16 页)
③ 0-350 时,第一步反应(吸热)为主,正反应为吸热反应,升高温度平
衡正向移动,因此升温使 CO2 转化率增大。(2 分)
(3)① i.O2+e− O2−(1 分)ii.2CO2+2O2·− 1C2O42−+2O2 (答案)(2 分)
② 负极发生反应 Al-3e-=Al3+,Al3+通过阳离子交换膜移动到正极与正极生
成的 1C2O42−结合生成 Al2(C2O4)3(2 分)
27. (16 分)
(1)①BD(2 分)
②4Fe2++O2+4H+=4Fe3++2H2O(2 分)
(2) Fe3+水解程度随 pH 的升高而增大(2 分)
(3)① 2Cu2+ + N2H4 + 4OH- = 2Cu + N2 + 4H2O(2 分)
②超过 70℃时水合肼(或肼)易挥发, 肼(或水合肼)浓度降低,Cu2+还原率降
低(2 分)
③70℃、PH=10 时 Cu2+还原率最高,同时可以得到高纯度的纳米铜(2 分)
(4) 洗涤;煅烧(或灼烧)(2 分)
(5)103a/128 mol 或者 125a/16 mol 或者 7.81mol。(2 分)
28. (13 分)
(1)有红色(紫红色)固体产生(1 分),
2Cl— - 2e— = Cl2 ↑(2 分), CuCl2 ==Cu + Cl2↑(2 分),
(2)Ⅰ.①Cu+CuCl2=CuCl ↓(2 分) ②设计方案:取阴极产生的白色固体,溶于稀盐
酸配成溶液,浇水稀释,又析出白色沉淀。(2 分)
Ⅱ.猜想 1:实验 C:加入 NaCl 固体至不再溶解(1 分);不是(1 分)。
猜想 2:
(2 分)
(答案合理即给分)。
通电
高三理综第 22 页(共 16 页)
延庆区 2018—2019 学年度模拟考试答案
高三生物
答案:1-5:BABDC
29.(16 分) (1)-(3)每空 1 分,(4)-(5)每空 2 分
(1)暗(1 分);呼吸速率大于光合速率(1 分);不是(1 分)
(2)液泡(1 分);类囊体(1 分)
(3)一致(1 分)
(4)低;增加(上升);叶绿体
(5)过氧化氢酶合成基因表达量减少引起叶绿体损伤;水分和无机盐的吸收减少
30.(19 分) 除第(1)小题每空 1 分外,其他小题每空 2 分
(1)农杆(1 分)
(2)3/4; 全部具有抗除草剂性状
(3)“LB+RP”组合和“LP+RP”组合均能进行 PCR 扩增
“LB+RP”组合能扩增,“LP+RP”组合不能扩增(只有“LB+RP”组合能扩增)
(4)参照或标准(物质); 5
(5)没有明显差异; 下降(抑制)
(6)D 基因的表达会促进 ABA 的合成,从而提高抗盐能力
31.(15 分) 除第(2)小题每空 1 分外,其他小题每空 2 分
(1)α-syn FPP 诱导脑细胞产生 PARP1 而引起脑细胞死亡。
(2)抑制(1 分);ABT(1 分);支持(1 分)
(3)脑细胞死亡率明显降低
(4)PAR;细胞质基质;促进
(5)敲除 PARP-1 基因或服用 PARP-1 抑制剂药物
2019 年 3 月
相关文档
- 理综物理卷·2018届广东省汕头市高2021-05-2611页
- 河北省保定市2020届高三第一次模拟2021-05-2611页
- 北京市房山区2020届高三第一次模拟2021-05-269页
- 【物理】北京市延庆区2019-2020学2021-05-2610页
- 北京市延庆区2021届高三物理9月考2021-05-2627页
- 湖南省永州市2021届高三第一次模拟2021-05-2612页
- 【物理】北京市延庆区2020届高三下2021-05-2619页
- 【物理】北京市延庆区2019-2020学2021-05-2620页
- 2020-2021学年广东省汕头市高三第2021-05-2612页
- 北京市延庆区2020届高三3月模拟考2021-05-2614页