- 862.03 KB
- 2021-06-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
石景山区2018—2019学年第一学期高三期末试卷化 学
考生须知
1.本试卷分为选择题和非选择题两部分,满分100分。考试时间100分钟。
2.在答题卡上准确填写学校名称、姓名和准考证号。
3.请将答案填在答题纸的相应位置。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Fe—56
第Ⅰ卷(选择题 共42分)
本部分共14个小题,每小题3分,每小题只有一个选项符合题意
1.下列生活用品的主要成分属于有机高分子的是
A.棉袜子
B. 明矾
C. 紫砂壶
D. 汽油
2.下列仪器主要用于“冷凝”的是
A.
B.
C.
D.
高温
高温
△
△
3.下列常见金属的冶炼原理不合理的是
A.还原法炼铝:3H2+Al2O3===2Al+3H2O
B.加热法炼汞:2HgO===2Hg+O2↑
C.铝热法炼铁:Fe2O3+2Al===2Fe+Al2O3
D.火法炼铜:Cu2S+O2===2Cu+SO2
4.下列有关元素周期律的叙述正确的是
A.原子半径:Mg>O,离子半径:Mg2+>O2-
B.S和Se属于第ⅥA族元素,H2SO4的酸性强于H2SeO4
C.结合质子能力:S2-<Cl-
D.Na、Mg、A1三种元素最高价氧化物对应水化物的碱性依次增强
5.食盐、蔗糖、醋酸、84消毒液(主要成分为NaClO)、洁厕灵(主要成分为盐酸)等是灾后经常使用的物质,下列有关说法或化学用语正确的是
A.食盐中阴离子的结构示意图:
B.蔗糖和醋酸都是弱电解质
C.84消毒液显碱性的原因:ClO-+H2OHClO+OH-
D.84消毒液和洁厕灵不能混用的主要原因是发生酸碱中和反应
高三化学期末试卷 第 13 页 (共13 页)
6.水杨酸、冬青油、阿司匹林的结构简式如下,下列说法不正确的是
A.由水杨酸制冬青油的反应是取代反应
B.冬青油苯环上的一氯取代物有4种
C.可用FeCl3溶液检验阿司匹林中是否混有水杨酸
D.相同物质的量的冬青油和阿司匹林消耗NaOH的物质的量相同
7.从海水的母液中提取金属镁的一种工艺流程如下:
海水
粗盐
蒸发
母液
Mg(OH)2
沉镁
①
脱水
电解
盐酸
②
MgCl2
MgCl2·6H2O
③
④
Mg
下列说法不正确的是
A.步骤①沉镁可加入石灰乳
B.步骤③脱水时,在空气中加热MgCl2·6H2O得到MgCl2
C.步骤④中镁在阴极生成
D.设计步骤①、②、③的主要目的是富集镁元素
8.在探究柠檬电池的工作原理时,某课外小组同学发现:当按图Ⅰ所示连接一个柠檬时,二极管不发光;按图Ⅱ所示连接几个柠檬时,二极管发光。下列说法不正确的是
A.图Ⅰ中二极管不发光,说明该装置不构成原电池
B.图Ⅱ中铁环为负极、铜线为正极,负极的电极反应为:Fe-2 e-===Fe2+
C.图Ⅰ中二极管不发光的原因是单个柠檬电池的电压较小
D.图Ⅱ中所得的电池组的总电压是各个柠檬电池的电压之和
铁环
铜线
图Ⅰ 图Ⅱ
高三化学期末试卷 第 13 页 (共13 页)
9.1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH===== Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
1100℃
A.戴维法制钠,阳极的电极反应式为:2OH-+2e-===H2↑+O2↑
B.盖·吕萨克法制钠原理是利用铁的金属性比钠的强
C.若用戴维法与盖·吕萨克法制得等量的钠,两方法转移电子总数相等
D.还可以用电解熔融氯化钠法制钠
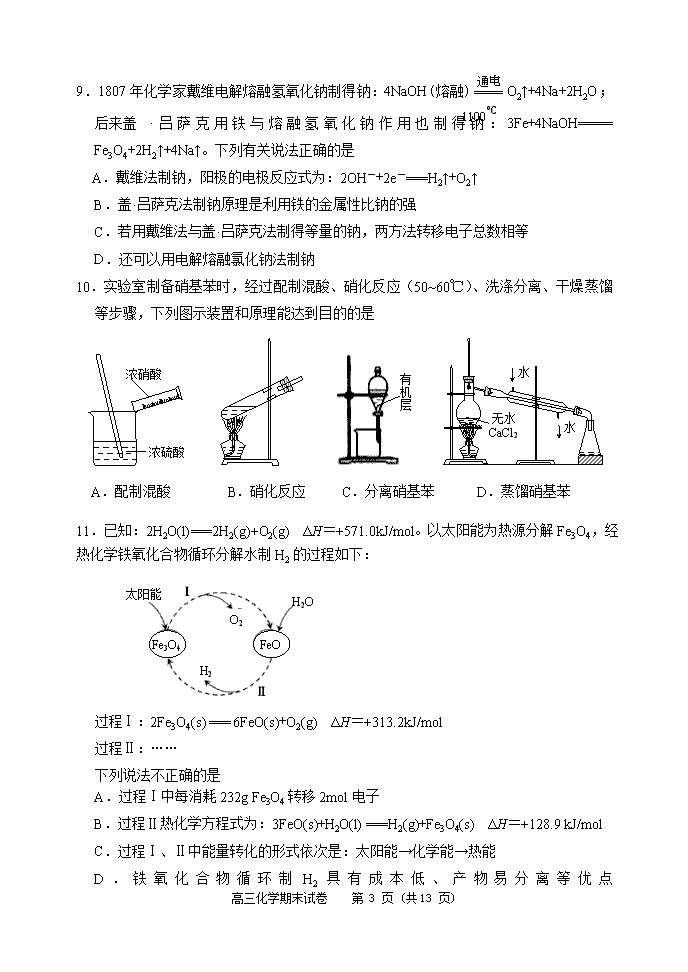
10.实验室制备硝基苯时,经过配制混酸、硝化反应(50~60℃)、洗涤分离、干燥蒸馏等步骤,下列图示装置和原理能达到目的的是
水
溶
浓硝酸
浓硫酸
水
A.配制混酸 B.硝化反应 C.分离硝基苯 D.蒸馏硝基苯
有
机
层
无水
CaCl2
11.已知:2H2O(l)===2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
Fe3O4
FeO
H2O
O2
H2
太阳能
过程Ⅰ:2Fe3O4(s) === 6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是
A.过程Ⅰ中每消耗232g Fe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l) ===H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
高三化学期末试卷 第 13 页 (共13 页)
12.在一定条件下,甲苯可生成二甲苯的混合物和苯。有关物质的沸点、熔点如下:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点 / ℃
138
144
139
80
熔点 / ℃
13
﹣25
﹣47
6
下列说法不正确的是
A.苯、甲苯、对二甲苯属于同系物
B.推测甲苯的沸点高于80℃而低于138℃
C.甲苯生成二甲苯和苯的反应属于取代反应
D.用蒸馏的方法能从二甲苯混合物中分离出对二甲苯
13.常压下羰基化法精炼镍是工业上提纯镍的主要方法,其原理为:Ni(s)+4CO(g) Ni(CO)4(g) △H<0。已知:Ni(CO)4的沸点为42.2℃,230℃时该反应的平衡常数K=2×10—5,固体杂质不参与反应。
第一阶段:调控温度使粗镍与CO反应,转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,调控温度制得高纯镍。
下列判断正确的是
A.第一阶段将粗镍粉碎有利于平衡正向移动
B.第二阶段可以选择230℃
C.第一阶段的温度高于第二阶段的温度
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
14.已知常温下,氨水中NH3·H2O的电离平衡常数:Kb≈1×10-5。向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是
A.NH4Cl的电离方程式为:NH4ClCl-+NH4+
B.M点时,pH≈9
C.a=0.05
D.当n(NaOH)=0.05 mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
高三化学期末试卷 第 13 页 (共13 页)
第Ⅱ卷(非选择题 共58分)
本部分共5小题,共58分
15.(10分)联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:
X
(1)碳元素在周期表中的位置是 。
(2)将硅的元素符号填写在上述周期表相应的空格中。
(3)在上述周期表中,用实线画出周期表的上方边界。
(4)从原子结构角度解释碳化硅中碳元素显负价的原因 。
(5)第118号元素为Og(中文名“”,ào),下列说法不正确的是 。
a.Og是第七周期0族元素 b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强 d.中子数为179的Og核素符号是
(6)已知X与Y是位于相邻周期的同主族元素。某温度下,X、Y的单质与H2化合生成气态氢化物的平衡常数分别为KX =9.7×1012、KY =5.6×107。Y是 (填元素符号),判断理由是 。
16.(11分)硫酸亚铁铵(NH4)2Fe(SO4)2•6H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
已知:FeS2与H2SO4不反应。相应物质的溶解度曲线如右下图。
(1)FeS2中S元素的化合价为 。
(2)硫铁矿焙烧的主反应是:4FeS2+11O22Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有 (写两点即可)。
(3)加H2SO4酸浸,发生反应的离子方程式为 。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
高三化学期末试卷 第 13 页 (共13 页)
反应Ⅱ的离子方程式为: 。
(5)得到莫尔盐晶体的操作是:蒸发浓缩、结晶、过滤、洗涤。结晶、过滤时选择的适宜温度为60℃,解释选择该温度的原因 。
(6)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中, ,证明含有Fe2+和NH4+。
17.(12分)氮氧化物的存在会破坏地球环境,人们一直在积极探索改善大气质量的有效措施。
已知:N2(g)+O2(g)2NO(g) △H=+181.5 kJ·mol-1
(1)写出NO2转化为HNO3的化学方程式 。
(2)氮氧化物是形成臭氧层空洞、光化学烟雾、 (列举一种)等大气污染现象的物质之一。北京市为防治大气污染,采取的措施有 (写两点即可)。
(3)NOx在平流层使O3浓度减少,形成臭氧层空洞,其中一种反应机理可用下图表示,
写出其总反应的化学方程式 。
光能
光能
(4)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用 、 、 和
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是 (填字母序号)。
(5)温度为T1时,在容积为1L的恒容密闭容器中充入0.6mol的NO2,达平衡时c(O2)=0.2mol/L,仅发生反应:2NO2(g)2NO(g)+O2 (g)(△H>0)。实验测得:
v正=v (NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO) •c(O2),k正、k逆为速率常数,仅受温度影响。当温度改变为T2时,若k正=k逆,则T1 T2(填“>”或“<”),得出该结论的理由是 。
高三化学期末试卷 第 13 页 (共13 页)
18.(11分)Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)
Na2SO3固体
70%的硫酸
NaOH溶液
A B C
NaOH溶液
Zn粉-水悬浮液
①
(1)仪器①的名称是 。
(2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2 ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为 。
(3)B装置反应前,先进行的实验操作是 。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是 。
Ⅱ.探究Na2S2O4的性质
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是 。
(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
(6)制备纳米级银粉
用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2︰1,且生成的含硫物质只有一种,写出该反应的离子方程式 。
高三化学期末试卷 第 13 页 (共13 页)
19.(14分)萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分。I是一种萜类化合物,它的合成路线如下:
(C17H22O5)
回答下列问题:
(1)按官能团分类,A的类别是 。
(2)A→C的反应类型是 。
(3)C→D、E→F的化学方程式分别是 、 。
(4)写出下列物质的结构简式:B 、H 。
(5)F→G的反应中,乙酸酐的作用 。
(6)十九世纪末O.Wallach发现并提出了“异戊二烯法则”,即自然界中存在的萜类化合物均可以看作是异戊二烯的聚合体或衍生物,为表彰他对萜类化合物的开创性研究,1910年被授予诺贝尔化学奖。请以CH3CH2OH、CH3MgI、CH3CH2MgBr为有机原料,结合题目所给信息,选用必要的无机试剂,补全异戊二烯()的合成路线。
高三化学期末试卷 第 13 页 (共13 页)
石景山区2018—2019学年第一学期高三期末
化学试卷答案及评分标准
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
A
D
A
B
C
D
B
A
D
C
C
D
B
B
阅卷说明:
1.化学方程式评分标准:
(1)化学(离子)方程式中,离子方程式写成化学方程式2分的给1分,1分的写对给分;化学方程式写成离子方程式的不扣分。
(2)反应物、生成物化学式均正确得1分,有一种物质的化学式错即不得分。
(3)不写条件或未配平,按要求看是否扣分。
(4)不写“↑”或“↓”不扣分。
2.简答题中加点部分为给分点。
3.合理答案酌情给分。
15.(10分)
(1)第二周期第IVA族(1分)
(2)(1分)(3)(1分)
Si
x
(4)C、Si位于同一主族,从上到下随核电荷数递增,原子半径逐渐增大,原子核吸引电子的能力逐渐减弱,C、Si之间形成的共用电子对偏向C,所以碳元素显负价
………………………………………………………………………………………………………………………………………………………………………(2分)
(5)c、d……………………………………………………………………………………………………………………………………………………………(2分)
(6)
高三化学期末试卷 第 13 页 (共13 页)
Br………………………………………………………………………………………………………………………………………………………………(1分)
理由:由KY < KX,可知Y的气态氢化物的稳定性弱于X,Y位于X的下方,为Br ……………………………………………………………………………………………………………………………………………………………(2分)
16.(11分)
(1)-1 ……………………………………………………………………………………………………………………………………………………………(1分)
(2)将硫铁矿粉碎、增大通入空气的量或提高焙烧温度……………………………………(2分)
(3)Fe2O3+ 6H+ = 2Fe3++3H2O………………………………………………………………………………………………………(2分)
(4)FeS2 +2Fe3+ = 3Fe2++2S………………………………………………………………………………………………………………(2分)
(5)60℃时,硫酸亚铁晶体的溶解度最大,硫酸铵较大,均比莫尔盐溶解度大,结晶时不宜析出,因此,选择60℃结晶、过滤,得到莫尔盐晶体的纯度更高………………(2分)
(6)加入适量浓氢氧化钠溶液,溶液中的白色沉淀迅速变灰绿,最终变为红褐色(1分);微热,用湿润的红色石蕊试纸接近试管口,观察到湿润的红色石蕊试纸变蓝(1分),证明含有Fe2+和NH4+……………………………………………………………………………………………………………(总2分)
17.(12分)
(1)3NO2+H2O= 2HNO3+NO …………………………………………………………………………………………………………(2分)
(2)雾霾、酸雨、温室效应等………………………………………………………………………………………………………………(1分)
光
NO
新能源汽车;汽车限行;推广使用清洁燃料;煤改电等………………………………………………(2分)
光
NO
光
NO
(3)2O3
高三化学期末试卷 第 13 页 (共13 页)
3O2………………………………………………………………………………………………………………………………(2分)
(4)C………………………………………………………………………………………………………………………………………………………………(2分)
光
NO
(5)T2>T1 ………………………………………………………………………………………………………………………………………………………(1分)
达到平衡状态时正逆反应速率相等,根据k正c2(NO2)=k逆c2(NO)•c(O2),且k正=k逆,可知c2(NO2)=c2(NO)•c(O2),T2时化学平衡常数K等于1,大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以 T2>T1 ……………………………(2分)
18.(11分)
28~35℃
(1)圆底烧瓶………………………………………………………………………………………………………………………………………………(1分)
(2)ZnS2O4+2NaOH Na2S2O4 + Zn(OH)2¯……………………………………………………………………(2分)
(3)打开A中分液漏斗活塞,使硫酸与亚硫酸钠先反应产生的SO2,排出装置中残留的O2 ……………………………………………………………………………………………………………………………………………………………(2分)
(4)加入氯化钠,增大了Na+离子浓度,促进Na2S2O4结晶析出(用沉淀溶解平衡解释可以)(答盐析只给1分)……………………………………………………………………………………………………………(2分)
(5)取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质………………………………………………………………………(2分)
(6)2Ag++S2O42—+4OH—=2Ag↓+2SO32—+2H2O…………………………………………………………………………(2分)
高三化学期末试卷 第 13 页 (共13 页)
19.(14分)
(1)酚……………………………………………………………………………………………………………………………………………………………(1分)
(2)取代反应………………………………………………………………………………………………………………………………………………(2分)
(3)C→D…………………(2分)
E→F……………………(2分)
(4) ……………………………………………………………………………………………………………………………………(2分)
………………………………………………………………………………………………………………………………………(2分)
(5)保护酚羟基不被氧化………………………………………………………………………………………………………………………(1分)
(6)……………………………………………………………………………………………………………………………………………………………………(2分)
也可以设计以下路线:
高三化学期末试卷 第 13 页 (共13 页)
高三化学期末试卷 第 13 页 (共13 页)