- 1.22 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第14讲 碳、硅及无机非金属材料
考纲要求 1.了解C、Si元素单质及其重要化合物的制备方法,掌握其主要性质及应用。2.了解C、Si元素单质及其重要化合物对环境质量的影响。
考点一 碳及其重要化合物
1.碳单质
(1)碳单质的存在形式有金刚石、石墨、无定形碳、足球烯,它们互为同素异形体。
(2)结构
金刚石:正四面体空间网状结构;石墨:平面正六边形层状结构。
(3)物理性质:金刚石熔点高、硬度大;石墨熔点高、质软,有滑腻感。
(4)主要化学性质——还原性
①可燃性
②与氧化物反应
③与强氧化性酸反应
2.一氧化碳
(1)物理性质:无色气体,有毒,难溶于水。
(2)化学性质——还原性
①燃烧:2CO+O22CO2,淡蓝色火焰;
②还原CuO:CuO+COCu+CO2(冶炼金属)。
3.二氧化碳(CO2)
(1)一种无色、无味的气体,能溶于水,固态CO2俗称干冰。
(2)与H2O、Na2O、Ca(OH)2(足量、澄清)、Mg反应的方程式分别为CO2+H2O??H2CO3,Na2O
+CO2===Na2CO3,CO2+Ca(OH)2===CaCO3↓+H2O,2Mg+CO22MgO+C。
(3)CO2在自然界中的循环
①CO2的主要来源:大量含碳燃料的燃烧。
②自然界消耗CO2的主要反应:
a.溶于江水、海水中:CO2+H2O??H2CO3;
b.光合作用将CO2转化为O2;
c.岩石的风化:CaCO3+H2O+CO2===Ca(HCO3)2。
4.碳酸(H2CO3)
弱酸性、不稳定性。碳酸(H2CO3)只能在水中存在。H2CO3在水中与CO2共存,因此常把CO2+H2O当碳酸用。
5.碳酸的酸式盐和正盐的比较
(1)在水中的溶解性
①含K+、Na+、NH的正盐易溶于水,其余一般不溶于水;酸式盐均能溶于水。
②一般来说,在相同温度下,难溶性正盐溶解度小于其酸式盐溶解度,如溶解度Ca(HCO3)2>CaCO3;可溶性正盐溶解度大于其酸式盐溶解度,如溶解度Na2CO3>NaHCO3。
(2)热稳定性
一般来说,热稳定性顺序为正盐>酸式盐>碳酸,如稳定性Na2CO3>NaHCO3>H2CO3。可溶性正盐>难溶性正盐,如CaCO3高温分解,而K2CO3不易分解。
(3)水溶液酸碱性强弱
物质的量浓度相同时,正盐溶液的pH大于其酸式盐溶液,如pH:Na2CO3溶液>NaHCO3溶液。
1.碳单质及其氧化物性质用途的判断
(1)12C、13C、14C是碳的三种同素异形体(×)
解析 12C、13C、14C互称同位素,碳元素的三种常见的同素异形体为金刚石、石墨和C60。
(2)金刚石和石墨由相同的元素组成,因此它们具有相同的性质(×)
(3)石墨转变为金刚石的反应属于氧化还原反应(×)
(4)向空气中排放二氧化碳会形成酸雨(×)
(5)一氧化碳易与血液中的血红蛋白结合(√)
(6)木炭、一氧化碳在一定条件下都能与氧化铜反应(√)
(7)大气中二氧化碳的消耗途径主要是绿色植物的光合作用(√)
2.二氧化碳与盐溶液反应的判断
(1)向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失(×)
解析 H2SiO3不溶于H2CO3。
(2)向Ca(ClO)2溶液中通入CO2气体,溶液变浑浊,继续通入CO2至过量,浑浊消失(√)
解析 开始生成CaCO3沉淀,CO2过量时,CaCO3又与CO2、H2O反应生成Ca(HCO3)2。
(3)向CaCl2溶液中通入CO2,无明显现象,若先通入NH3再通CO2,溶液会变浑浊(√)
(4)向饱和Na2CO3溶液中通入过量的CO2气体,有晶体析出(√)
解析 NaHCO3的溶解度比Na2CO3的小。
(5)向NaAlO2溶液中通入CO2气体,一开始有白色沉淀生成,CO2过量,沉淀溶解(×)
解析 Al(OH)3不能溶于H2CO3。
(6)向饱和NaCl的氨溶液中通入过量CO2气体,有晶体析出(√)
解析 会析出NaHCO3晶体。
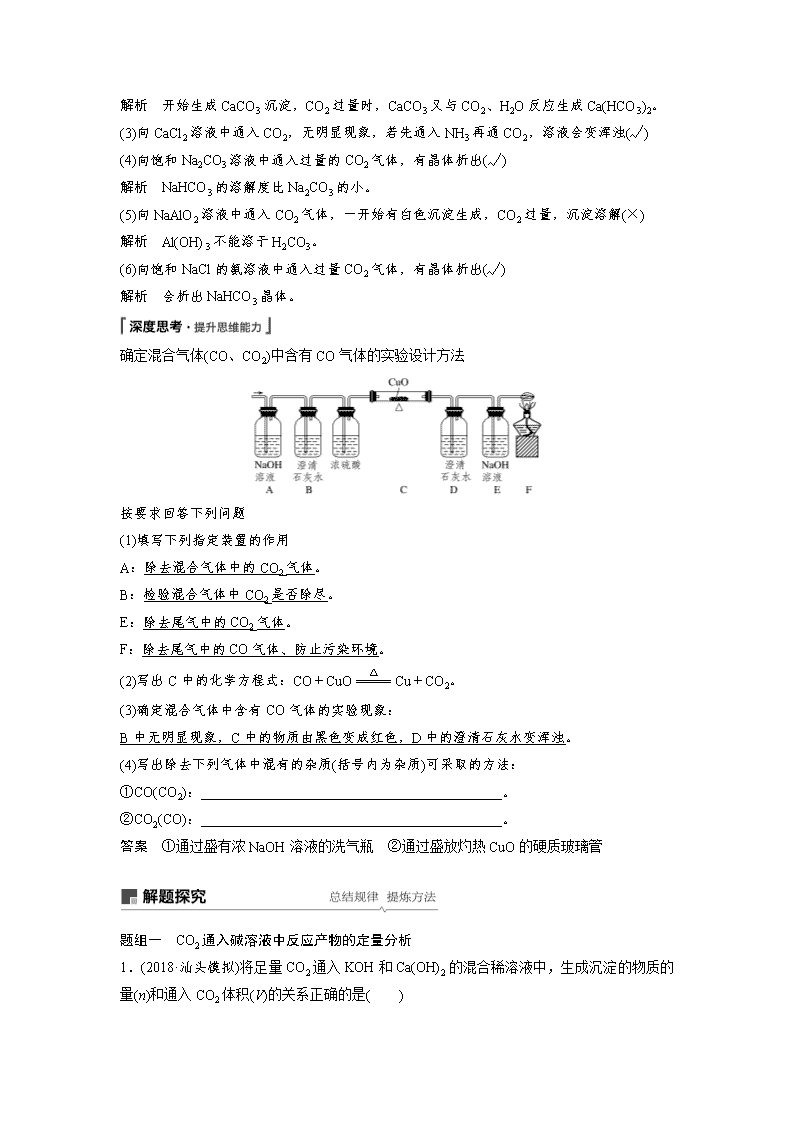
确定混合气体(CO、CO2)中含有CO气体的实验设计方法
按要求回答下列问题
(1)填写下列指定装置的作用
A:除去混合气体中的CO2气体。
B:检验混合气体中CO2是否除尽。
E:除去尾气中的CO2气体。
F:除去尾气中的CO气体、防止污染环境。
(2)写出C中的化学方程式:CO+CuOCu+CO2。
(3)确定混合气体中含有CO气体的实验现象:
B中无明显现象,C中的物质由黑色变成红色,D中的澄清石灰水变浑浊。
(4)写出除去下列气体中混有的杂质(括号内为杂质)可采取的方法:
①CO(CO2):___________________________________________。
②CO2(CO):___________________________________________。
答案 ①通过盛有浓NaOH溶液的洗气瓶 ②通过盛放灼热CuO的硬质玻璃管
题组一 CO2通入碱溶液中反应产物的定量分析
1.(2018·汕头模拟)将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,
生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是( )
答案 D
解析 CO2与KOH和Ca(OH)2都会反应,但存在着竞争,如果先与KOH反应,则反应后生成的K2CO3立即会与Ca(OH)2反应生成CaCO3,因此,可以看成CO2先与Ca(OH)2反应,所以通CO2后立即有CaCO3生成。第二步还要判断CO2是先跟KOH反应还是先与生成的CaCO3反应,同样可以采用假设法判断,即如果先与CaCO3反应,则生成的Ca(HCO3)2又会与KOH反应,因此是先与KOH反应,此过程生成沉淀的物质的量不变,当KOH反应完全,再与CaCO3反应,直至沉淀完全溶解,故选D。
2.标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1NaOH溶液中,充分反应后溶液中c(CO)与c(HCO)的比值为( 不考虑CO、HCO的水解)( )
A.1∶1 B.1∶2
C.2∶1 D.1∶3
答案 B
解析 n(CO2)==0.150 mol,n(NaOH)=0.200 L×1.00 mol·L-1=0.200 mol
==,即1<<2,反应产物为Na2CO3、NaHCO3,设其物质的量分别为x、y,则,解得,所以=。
题组二 CO2的综合利用
3.[2015·北京理综,27(1)(2)(3)]研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO占95%。写出CO2溶于水产生HCO的方程式:_______________________________________。
(2)在海洋碳循环中,通过下图所示的途径固碳。
①写出钙化作用的离子方程式:________________________________________________。
②同位素示踪法证实光合作用释放出的O2只来自于H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整:
________+________(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法:
①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用x mol·L-1 HCl溶液滴定,消耗y mL HCl溶液。海水中溶解无机碳的浓度=________ mol·L-1。
答案 (1)CO2+H2O??H2CO3、H2CO3??H++HCO
(2)①2HCO+Ca2+===CaCO3↓+CO2↑+H2O ②xCO2 2xH218O
(3)①②
解析 (1)CO2溶于水生成H2CO3,H2CO3电离出H+和HCO 。(2)①根据钙化作用的反应物是HCO 和Ca2+,生成物是CaCO3和CO2,故不难写出反应的离子方程式为2HCO+Ca2+===CaCO3↓+CO2↑+H2O。②根据元素守恒及示踪原子的标记知,方程式中的空白处为xCO2和2xH218O。(3)①该装置为洗气装置,要注意装置中长管进、短管出,且用分液漏斗滴加酸化所用试剂为稀硫酸,因HCl易挥发出来影响后续的滴定而不能用盐酸。②根据该滴定过程得关系式:CO2~HCO~HCl,n(CO2) =n(HCl)=x mol·L-1×y×10-3L=xy×10-3 mol,所以c(CO2)== mol·L-1。
考点二 硅及其化合物 无机非金属材料
1.硅(Si)
(1)硅的存在:硅在自然界中以化合态存在,在地壳中的含量仅次于氧。
(2)物理性质:灰黑色,硬度大,熔、沸点高,具有金属光泽。
(3)化学性质:常温下与F2、HF、NaOH反应;加热时能与H2化合生成不稳定的氢化物SiH4,加热时还能与Cl2、O2化合分别生成SiCl4、SiO2。涉及的化学方程式如下:
①与非金属单质反应
②与氢氟酸反应:Si+4HF===SiF4↑+2H2↑。
③与NaOH溶液反应:
Si+2NaOH+H2O===Na2SiO3+2H2↑。
(4)制法:SiO2+2CSi+2CO↑。
(5)用途:①良好的半导体材料;②太阳能电池;③计算机芯片。
2.二氧化硅(SiO2)
(1)二氧化硅存在于沙子、石英、水晶、玛瑙(含杂质的石英)等中。SiO2是由Si和O按个数比1∶2直接构成。Si、SiC、Si3N4、BN等也是直接由原子构成的。
(2)二氧化硅的性质及用途
主要物理性质
硬度大,熔、沸点高,常温下为固体,不溶于水
化
学
性
质
①与水反应
不反应
②与酸反应
只与氢氟酸反应:SiO2+4HF===SiF4↑+2H2O
③与碱反应(NaOH)
SiO2+2NaOH===Na2SiO3+H2O(盛碱液的试剂瓶用橡胶塞)
④与盐反应
如与Na2CO3反应:SiO2+Na2CO3Na2SiO3+CO2↑
⑤与碱性氧化物反应
如与CaO反应:SiO2+CaOCaSiO3
用途
光导纤维、光学仪器、电子部件
3.硅酸和硅酸钠
(1)硅酸
硅酸不溶于水,其酸性比碳酸弱,硅酸不能(填“能”或“不能”)使紫色石蕊溶液变红色。
①硅酸不稳定,受热易分解:H2SiO3SiO2+H2O。
②硅酸能与碱溶液反应。
③硅酸在水中易聚合形成胶体。硅胶吸附水分能力强,常用作干燥剂。
(2)硅酸钠(Na2SiO3)
①白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,有黏性,水溶液显碱性。
②它能与酸性比硅酸强的酸反应,分别写出以下化学方程式:
与盐酸反应:Na2SiO3+2HCl===2NaCl+H2SiO3↓。
与CO2水溶液反应:Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3。
③用途:黏合剂(矿物胶),耐火阻燃材料。
(3)硅酸盐组成的表示:通常用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成:如硅酸钠(Na2SiO3)中表示为Na2O·SiO2,石棉(CaMg3Si4O12)可表示为CaO·3MgO·4SiO2。
4.无机非金属材料
(1)传统无机非金属材料,如水泥、玻璃、陶瓷等硅酸盐材料。
①常见硅酸盐材料比较
水泥
玻璃
陶瓷
生产原料
石灰石、黏土
纯碱、石灰石、石英
黏土
主要设备
水泥回转窑
玻璃窑
陶瓷窑
②玻璃生产中的两个重要反应:Na2CO3+SiO2Na2SiO3+CO2↑;CaCO3+SiO2CaSiO3+CO2↑。
(2)新型无机非金属材料,如高温结构陶瓷、光导纤维、生物陶瓷、压电陶瓷等。
1.关于Si、SiO2的存在、性质及用途的判断
(1)硅在自然界中只以化合态的形式存在(√)
(2)晶体硅熔点高硬度大,故可用于制作半导体材料(×)
(3)Si和SiO2都可用于制造光导纤维(×)
解析 Si可用于制造半导体,SiO2用于制造光导纤维。
(4)非金属性:C>Si,则热稳定性:CH4>SiH4(√)
(5)高温下用焦炭还原SiO2制取粗硅(√)
(6)硅的化学性质不活泼,常温下不与任何物质反应(×)
(7)SiO2是酸性氧化物,可溶于强碱(NaOH),不溶于任何酸(×)
解析 SiO2可溶于氢氟酸:SiO2+4HF===SiF4↑+2H2O。
(8)常温下,SiO2与氢氟酸、NaOH溶液均可反应,SiO2是两性氧化物(×)
解析 SiO2是酸性氧化物。
2.硅酸盐、无机非金属材料性质及应用判断
(1)玻璃是一种晶体,有较高的熔点(×)
(2)水玻璃是一种特殊的玻璃,泡花碱属于碱(×)
(3)传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料(√)
(4)光导纤维、碳纳米管、氮化硅结构陶瓷等都是新型无机非金属材料(√)
(5)高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点(√)
(6)普通玻璃、石英玻璃、水泥、玛瑙都属于硅酸盐产品(×)
(7)反应①Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都发生(×)
(8)硅胶多孔,吸水能力强,常用作袋装食品的干燥剂和抗氧化剂(×)
(9)用SiO2制取硅酸,将SiO2溶解在水中一段时间后可得到硅酸(×)
(10)水玻璃是混合物,可用于生产黏合剂和防火剂(√)
(11)硅胶是硅酸钠的水溶液失去水后形成的凝胶(×)
1.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作________。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(2)工业上常利用反应2C+SiO2Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
答案 (1)防火剂 D (2)C SiO2
2.写出除去下列固体粉末中混有杂质(括号内为杂质)可采取的方法,写出有关反应的方程式。
(1)CaCO3(SiO2) _____________________________________________________。
(2)SiO2(CaCO3) ___________________________________________________________。
(3)SiO2(NH4Cl)________________________________________________________。
答案 (1)在固体混合物中加入足量氢氧化钠溶液,充分反应后,过滤、洗涤。SiO2+2NaOH===Na2SiO3+H2O
(2)在固体混合物中加入足量稀盐酸,充分反应后,过滤、洗涤。CaCO3+2HCl===CaCl2+CO2↑+H2O
(3)方法一:在固体中加入适量水溶解、过滤。
方法二:将固体混合物在坩埚中充分灼烧,除去NH4Cl。
NH4ClNH3↑+HCl↑
解析 (1)可根据SiO2可溶于NaOH溶液除去。(2)可根据CaCO3可溶于盐酸除去。(3)可根据NH4Cl的热稳定性,或NH4Cl易溶于水的性质除去。
题组一 硅和二氧化硅的特性
1.(2017·甘肃秦安一中第二次检测)下列叙述正确的是( )
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸
C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳
答案 D
解析 B项,物质中都含有SiO2,能与氢氟酸反应;C项,石灰硬化的原理是Ca(OH)2与CO2反应生成CaCO3的过程,而水泥硬化过程中发生复杂的物理变化和化学变化。
2.二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行的判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2CSi+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2Na2SiO3+CO2↑
⑤SiO2+3CSiC+2CO↑
a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃
b.反应②中SiO2表现出氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④符合用难挥发性的酸酐制取易挥发性的酸酐的道理
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde C.cde D.ab
答案 B
解析 通常用氢氟酸来刻蚀玻璃,与之对应的反应是③,因此a、c判断错误;反应②是一个置换反应,其中二氧化硅被还原,表现出氧化性,b判断正确;反应④是一个复分解反应,用难挥发的二氧化硅制取易挥发的二氧化碳,d判断正确;反应⑤中碳的化合价由0价变为-4和+2价,硅的化合价和氧的化合价都没有改变,因此二氧化硅没有参加氧化还原反应,e判断也正确。
题组二 高纯硅的提取
3.(2017·重庆市巴蜀中学高三月考)从石英砂制取高纯硅的主要化学反应如下:
①SiO2+2CSi(粗)+2CO↑
②Si(粗)+2Cl2SiCl4
③SiCl4+2H2Si(纯)+4HCl
关于上述反应的叙述不正确的是( )
A.①③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成28 g硅,均转移4 mol电子
D.高温下在炉子里将石英砂、焦炭、氯气、氢气按比例混合就能得到高纯硅
答案 D
解析 在氧化还原反应中,还原剂的还原性比还原产物的还原性强,B正确;根据元素化合价的变化,每消耗或生成28 g(1 mol)硅,均转移4 mol电子,C正确;题中的三个反应是在三个不同的反应器中发生的,D错误。
4.硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式:___________________________________
________________________________________________________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出并配平该化学反应方程式:______________________________________________;
H2还原SiHCl3过程中若混有O2,可能引起的后果是_________________________________
________________________________________________________________________。
(2)化学研究性学习小组在探究硅的制取方法时,从资料查阅到下列信息:
Ⅰ.Mg在高温条件下可与SiO2反应;
Ⅱ.金属硅化物与稀H2SO4反应生成硫酸盐和SiH4;
Ⅲ.SiH4在空气中自燃。
他们根据信息进行实验,当用足量稀H2SO4溶解第Ⅰ步实验获得的固体产物时,发现有爆鸣声和火花;然后过滤、洗涤、干燥;最后称量、计算,测得其产率只有预期值的63%左右。
①第Ⅰ步实验发生反应的化学方程式是___________________________________________
________________________________________________________________________。
②用稀H2SO4溶解第Ⅰ步实验获得固体产物时,产生爆鸣声和火花的原因是________________________________________________________________________
________________________________________________________________________。
答案 (1)①SiHCl3+H2Si+3HCl
②SiHCl3+3H2O===H2SiO3↓+H2↑+3HCl 高温下,H2遇O2发生爆炸
(2)①2Mg+SiO22MgO+Si、2Mg+SiMg2Si
②硅化镁与稀硫酸反应生成的SiH4可自燃,即发生反应Mg2Si+2H2SO4===2MgSO4+SiH4↑,SiH4+2O2===SiO2+2H2O
解析 (1)在SiHCl3中,把硅考虑为+4价,则氢为-1价,氯为-1价,SiHCl3水解时,-1价氢还原水中+1价的氢,生成氢气。
在设计制备纯硅的实验题中,常遇到的知识点
(1)高温下用碳还原二氧化硅制得粗硅:
SiO2+2CSi(粗)+2CO↑
(2)粗硅与干燥HCl气体反应制得SiHCl3:
Si(粗)+3HClSiHCl3+H2
(3)粗硅与干燥Cl2反应制得SiCl4:
Si(粗)+2Cl2SiCl4
(4)SiHCl3与过量H2在高温下反应制得纯硅:
SiHCl3+H2Si(纯)+3HCl
(5)SiCl4与过量H2在高温下反应制得纯硅:
SiCl4+2H2Si(纯)+4HCl
(6)SiO2+2Mg2MgO+Si
(7)SiHCl3、SiCl4能与水发生反应:
SiHCl3+3H2O===H2SiO3↓+3HCl+H2↑
SiCl4+3H2O===H2SiO3↓+4HCl
(8)SiH4在空气中易自燃:
SiH4+2O2===SiO2+2H2O
1.下列有关硅及其化合物的叙述错误的是( )
A.SO2通入Na2SiO3溶液产生胶状沉淀,证明酸性H2SO3>H2SiO3(2017·北京理综,10D)
B.SiO2硬度大,故可用于制造光导纤维(2017·江苏,3C)
C.HF能与SiO2反应,可用氢氟酸在玻璃器皿上刻蚀标记(2016·全国卷Ⅲ,7D)
D.石英砂可用于生产单晶硅(2016·海南,4C)
答案 B
解析 A项,依据强酸制弱酸原理判断;B项,前后无因果关系。
2.下列说法正确的是( )
A.硅胶作袋装食品的干燥剂的过程中没有发生化学变化(2016·四川理综,1B)
B.pH=2的溶液中可能大量存在Na+、NH、SiO(2016·四川理综,3B)
C.向Na2SiO3溶液中滴加稀盐酸的离子方程式:Na2SiO3+2H+===H2SiO3↓+2Na+
(2016·江苏,5D)
D.向Na2SiO3溶液中通入过量SO2的离子方程式:SiO+SO2+H2O===H2SiO3↓+SO
(2015·山东理综,12B)
答案 A
解析 B项,酸性条件下,SiO不能大量存在;C项,Na2SiO3是可溶于水的强电解质;D项,应生成HSO。
3.[2017·全国卷Ⅱ,26(1)(2)(3)]水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是________________________________________________________________________
________________________________________________________________________,还可使用________代替硝酸。
(2)沉淀A的主要成分是________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为________________________________________________________________________。
(3)加氨水过程中加热的目的是
_____________________________________________________
________________________________________________________________________。沉淀B的主要成分为___________________________________________________________________、
____________________________________________________________________(填化学式)。
答案 (1)将Fe2+氧化为Fe3+ 双氧水
(2)SiO2 SiO2+4HF===SiF4↑+2H2O
(3)防止胶体生成,易沉淀分离 Fe(OH)3 Al(OH)3
解析 (1)Fe3+容易在pH较小时转化为沉淀,所以需要将Fe2+氧化为Fe3+。双氧水可以将Fe2+氧化为Fe3+且不会引入杂质。(2)二氧化硅不溶于一般酸性溶液,所以沉淀A是二氧化硅。SiO2与HF反应的化学方程式为SiO2+4HF===SiF4↑+2H2O。(3)加热可以促进Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀。pH=4~5时Ca2+、Mg2+不沉淀,Fe3+、Al3+沉淀,所以沉淀B为Fe(OH)3、Al(OH)3。
相关文档
- 2020届高考化学一轮复习化学能与热2021-07-0210页
- 2021届高考化学一轮复习化学反应速2021-07-0218页
- 2020届高考化学一轮复习化学反应速2021-07-0210页
- 2021届高考化学一轮复习化学平衡状2021-07-028页
- 通用版高考化学微一轮复习化学实验2021-05-1415页
- 通用版高考化学微一轮复习化学平衡2021-05-1412页
- 高考一轮复习化学计量在实验中的应2021-05-1414页
- 通用版高考化学微一轮复习化学键学2021-05-1410页
- 高考化学一轮复习化学能与热能化学2021-05-1414页
- 2020版高考化学大一轮复习化学实验2021-05-1312页