- 482.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高一化学暑期摸底考试评估卷
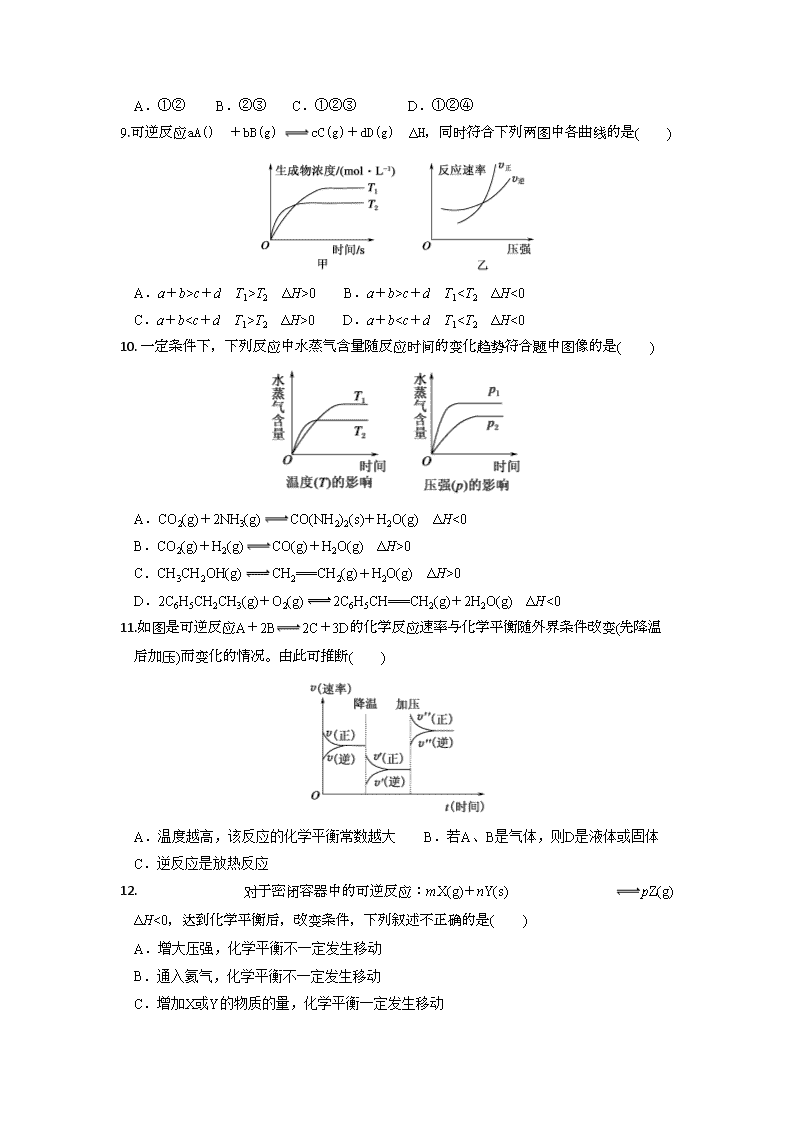
1.通过以下反应可获得新型能源二甲醚()。下列说法不正确的是( )
①
②
③
④
A. 反应①、②为反应③提供原料气
B. 反应③也是资源化利用的方法之一
C. 反应的
D. 反应的
2.下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
3.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol﹣1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g);△H=﹣192.9kJ•mol﹣1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9kJ•mol﹣1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+O2(g)=CO2(g)+2H2(g)的△H>﹣192.9kJ•mol﹣1
4.已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
(3)2H2(g)+O2(g)===2H2O(l) ΔH3=-571.6 kJ/mol
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为( )
A. -488.3 kJ/mol B. -244.15 kJ/mol C. 488.3 kJ/mol D. 244.15 kJ/mol
5. N2(g)+3H2(g) 2NH3(g),在四个不同容器内,在不同条件下合成氨。根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
A.v(H2)=0.3 mol·L-1·min-1 B.v(N2)=0.2 mol·L-1·min-1
C.v(NH3)=0.25 mol·L-1·min-1 D.v(H2)=0.4 mol·L-1·min-1
6.下列说法中,正确的是( )
A.化学反应速率是指一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8 mol·L-1·s-1是指1秒钟时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越快,反应现象就越明显
7.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积增大
A.①② B.①③ C.②③ D.③④
8.对于一定条件下进行的化学反应:2SO3(g) 2SO2(g)+O2(g),改变下列条件,可以提高反应物活化分子百分数的是( )
①增大压强 ②升高温度 ③加入催化剂 ④增大反应物浓度
A.①② B.②③ C.①②③ D.①②④
9.可逆反应aA() +bB(g) cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )
A.a+b>c+d T1>T2 ΔH>0 B.a+b>c+d T1T2 ΔH>0 D.a+b0
C.CH3CH2OH(g) CH2===CH2(g)+H2O(g) ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
11.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
A.温度越高,该反应的化学平衡常数越大 B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应
12. 对于密闭容器中的可逆反应:mX(g)+nY(s) pZ(g) ΔH<0,达到化学平衡后,改变条件,下列叙述不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其他条件不变,升高温度,化学平衡一定发生移动
13.下列说法中正确的是( )
A.能自发进行的反应一定能迅速发生 B.非自发进行的反应一定不能发生
C.能自发进行的反应也可能没有发生
D.常温下,2H2O2H2↑+O2↑,即常温下水的分解反应是自发反应
14. 在恒温、恒容的密闭容器中进行反应A(g)=B(g)+C(g)。若反应物A的浓度由2mol·L-1降到0.8mol·L-1需20s,那么反应物浓度由0.8mol·L-1降到0.2mol·L-1所需反应时间为
A. 10 s B. 大于10 s C. 小于10 s D. 无法判断
15. 在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生反应:A(g)+3B(g)2C(g); 经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
A. 用B表示反应速率为0.3 mol·L-1·s-1
B. 平衡后,向容器中充入无关气体(如Ne),反应速率增大
C. 3s时生成C的物质的量为1.2mol
D. 平衡后,v(正) (A)=v(逆) (A)
16. 某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)3C(? )+D(? )。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
17.以熔融的碳酸盐(K2CO3)为电解液,泡沫镍为电极,氧化纤维布为隔膜(仅允许阴离子通过)可构成直接碳燃料电池,其结构如图所示,下列说法正确的是( )
A. 该电池工作时,CO32-通过隔膜移动到b极
B. 若a极消耗1mol碳粉,转移电子数为4NA
C. b极的电极反应式为2CO2+O2-4e-=2CO32-
D. 为使电池持续工作,理论上需要补充K2CO3
18. 2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。钴酸锂(LiCoO2)电池的工作原理如图所示,其中A极材料是金属锂和石墨的复合材料(石墨作金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过。电池反应式为: LixC6+ Li1-xCoO2 C6+LiCoO2。下列说法中正确的是( )
A. 充电时Li由B极区域移向A极区域
B. 充电时,A为阴极,发生氧化反应C6+xLi++xe-=LixC6
C. 放电时,B为正极,电极反应式为Li1-xCoO2+xLi++xe-=LiCoO2
D. 废旧钴酸锂(LiCoO2)电池进行“放电处理”使锂进入石墨中而有利于回收
19. 用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇﹣氧化钠,其中O2﹣可以在固体介质
NASICON中自由移动.下列说法错误的是( )
A.负极的电极反应式为:CO+O2﹣﹣2e﹣═CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2﹣由电极a流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
20. 电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A.0.10mol∕L Ag+ B.0.20mol∕L Cu2+ C.0.20mol∕L Zn2+ D.0.20mol∕LPb2+
21. 按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不 正确
的是( )
A. E表示生成铜的物质的量 B. E表示反应消耗水的物质的量
C. F表示反应生成氧气的物质的量 D. F表示生成硫酸的物质的量
22. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )
A. 通电后中间隔室的SO42-向阳极迁移,阳极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 阴极反应为4OH--4e-=O2↑+2H2O,阴极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有11.2L O2生成(标况)
23. 分别放置在如图所示装置(都盛有0.1mol•L﹣1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( )
A. B. C. D.
24. 研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )
A.d为锌块,铁片不易被腐蚀 B.d为锌块,铁片上电极反应为2H++2e-==H2↑
C.d为石墨,铁片腐蚀加快
D.d为石墨,石墨上电极反应为O2+2H2O+4e-==4OH-
25. 研究生铁的锈蚀,下列分析不正确的是( )
序号
①
②
③
实验
现象
8小时未观察到明显锈蚀
8小时未观察到明显锈蚀
1小时观察到明显锈蚀
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e−+ 2H2O ==4OH−
D. 对比①②③,说明苯能隔绝O2
相关文档
- 云南省曲靖市宣威市第九中学2019-22021-07-0210页
- 安徽蚌埠市教师2020届高三仿真模拟2021-07-0214页
- 化学卷·2018届黑龙江省大庆四中高2021-07-0224页
- 2018-2019学年安徽省阜阳市第三中2021-07-0210页
- 【化学】北京专家2020届高三高考模2021-07-0218页
- 2021江苏常熟高三阶段性抽测化学试2021-07-0210页
- 2018-2019学年内蒙古巴彦淖尔市第2021-07-028页
- 山东省济宁市实验中学2018-2019学2021-07-025页
- 2018-2019学年吉林省长春市九台区2021-07-026页
- 黑龙江省安达七中2020届高三上学期2021-07-0212页